
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Химические свойства.. C6H5NH2 + 3Br2 → C6H2NH2Br3 + 3HBr. Получение аминов. г Н. Н. Зинин получил анилин восстановлением нитробензола - в промышленности. R-NO2+3(NH4)2S t, Fe в кислой среде →R-NH2 +3S↓ +6NH3↑ + 2H2O. р. Зинина) гор
7.. Химические свойства.
Опыт №1. Взаимодействие анилина с соляной кислотой.
С6H5NH2 + HCl → (С6H5NH3)+ Cl- получился хлорид фениламмония
Таким образом, АМИНЫ представляют собой органические основания.
Опыт №2. Горение анилина.
4CH3NH2 + 9O2 → 4CO2 + 2N2 + 10 H2O
Опыт №3. Галогенирование анилина.
C6H5NH2 + 3Br2 → C6H2NH2Br3 + 3HBr
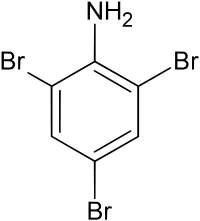 2,4,6-Триброманилин
2,4,6-Триброманилин
8. Получение аминов
Из-за запаха низшие амины долгое время принимали за аммиак, пока в 1849 году французский химик Шарль Вюрц не выяснил, что в отличие от аммиака, они горят на воздухе с образованием углекислого газа. Он же синтезировал метиламин и этиламин.
1842 г Н. Н. Зинин получил анилин восстановлением нитробензола - в промышленности
Восстановление нитросоединений:
R-NO2+3(NH4)2S t, Fe в кислой среде →R-NH2 +3S↓ +6NH3↑ + 2H2O
(р. Зинина) гордимся!!
Другие способы:
1). Промышленный
CH3Br + 2NH3 t, ↑p → CH3-NH2 + NH4Br
2). Пропусканием паров спирта и аммиака при 300оС над катализатором.
С2Н5ОН + NН3 С2Н5-NН2 +Н2О
9. Применение.
Амины используют при получении лекарственных веществ, красителей и исходных продуктов для органического синтеза. Гексаметилендиамин при поликонденсации с адипиновой кислотой дает полиамидные волокна.
Анилин находит широкое применение в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты).
Аминокислоты
1.Аминокислотами называются азотсодержащие соединения, в молекулах которых содержатся аминогруппа – NH2 и карбоксильная группа – СООН, связанные с углеводородным радикалом
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|