
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Примеры решения задач
Вопросы к модулю №1
1. Химическая посуда, указать назначение основных видов химической посуды. Мытье химической посуды.
2. Химическая посуда, указать назначение каждой. Мытье химической посуды.
Как проверить ее чистоту?
3. Какую посуду называют мерной, её основное предназначение? Правила работы
с нею. Устройство и назначение бюретки.
4. Какую посуду называют посудой общего предназначения, перечислите что именно относится к данной посуде?
5. Какую посуду называют посудой специального предназначения? Какие вы знаете колбы, их основное функциональное предназначение.
6.Керамическая посуда. Металлическое оборудование.
7.Основные понятия химии. Понятия: «атом», «ион», «химический элемент», «молекула», «вещество».
8. Количество вещества. Моль. Молярная масса.
9.Постоянная Авогадро.
10. Приведите определения понятий:
а) моль и молярная масса;
б) эквивалент и молярная масса эквивалента веществ;
в) реальные и условные частицы;
г) количество вещества эквивалента;
д) эквивалентный объем.
11.Сформулируйте закон эквивалентов. Приведите по крайней мере три математические записи этого закона.
12.Как определить эквивалент кислот и оснований, солей, оксидов и простого вещества? Приведите формулы.
13.Основные правила определения эквививалента и молярной массы эквивалента вещества в химических реакциях?
14.Основные стехиометрические законы. Понятие о стехиометрии.
15.Закон сохранения массы веществ в химических реакциях.
16.Закон постоянства состава вещества.
17.Газовые законы: закон объемных отношений
18.Закон Авогадро.
19. Объединенный газовый закон
20. Закон парциальных давлений.
Кроме теоритических вопросов в контрольной работе модуля № 1 необходимо решить задачи по теме «Основные законы и понятия химии»
Примеры решения задач
Пример 1. Определите значения эквивалента и эквивалентной массы для веществ: O2, Ca, H2SO4, Mg(OH)2, Al2(SO4)3.
Решение. 1 моль атомов кислорода способен соединиться с двумя молями атомов водорода, следовательно, на один моль атомов водорода приходится 1/2 моля атомов кислорода. Тогда, по определению эквивалента Э(О) = 1/2.
Молекула О2 состоит из двух атомов кислорода, следовательно, на 1 моль молекул О2 приходится 4 моль атомов водорода. Тогда Э(О2) = 1/4.
МЭ(О) = 1/432 = 8 г/моль.
Проведя аналогичные рассуждения и расчеты, получим:
| Са | H2SO4 | Mg(OH)2 | Al2(SO4)3 | |
| Э | 1/2 | 1/2 | 1/2 | 1/6 |
| MЭ, г/моль |
Пример 2.Определите значения эквивалентов, эквивалентных масс и число эквивалентов всех исходных и полученных веществ в реакциях:
1) H2SO4 +NaOH = NaHSO4 + H2O;
2) H2SO4 + 2NaOH = Na2SO4 + 2H2O;
3) 3H2SO4 + 2Al(OH)3 = Al2(SO4)3 + 6H2O.
Решение. 1) В первом уравнении реакции в каждой молекуле H2SO4 лишь один ион Н+ замещается на ион Na+, следовательно: Э(Н2SO4)= 1;
МЭ (H2SO4) = М (Н2SO4) иnЭ = 1моль. Далее, рассуждая аналогично, получим
| Н2SO4 | NaOH | NaHSO4 | H2O | |
| Э | ||||
| MЭ, г/моль | ||||
| nЭ, моль |
2) Во втором уравнении реакции в каждой молекуле H2SO4 два катиона Н+ замещаются на два катиона Na+, следовательно: Э(Н2SO4)= 1/2;
МЭ (Н2SO4)= 1/2 МЭ (Н2SO4), а в реакции принимает участие 1 моль молекул H2SO4 и 2 моль эквивалентов, т. е. nЭ = 2 моль. Тогда:
| H2SO4 | NaOH | Na2SO4 | H2O | |
| Э | 1/2 | 1/2 | 1/2 | 1/2 |
| MЭ, г/моль | ||||
| nЭ, моль |
Для третьего уравнения реакции получим:
| H2SO4 | Al(OH)3 | Al2(SO4)3 | H2O | |
| Э | 1/2 | 1/3 | 1/6 | |
| MЭ, г/моль | ||||
| nЭ, моль |
Пример 3.
Вычислите объем, занимаемый азотом массой 25 г при температуре 23 ºС и давлении 106 кПа. Каково число молекул в данной массе газа?
Решение:
 |
N2
m = 25г Определяем количество вещества азота
T = 27 0C = 300 K
p = 106 кПа =1,06 ∙ 105 Па 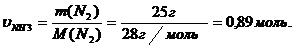
V−?
 N−?
N−?
Находим объем данного количества газа при нормальных условиях:
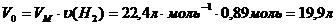
Пользуясь объединенным газовым законом, приводим объем азота к заданным условиям:
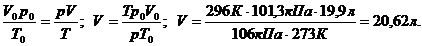
Число структурных частиц (n) рассчитывается с помощью числа Авогадро (NА):
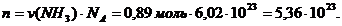
Эту задачу можно также решить используя уравнение Клапейрона − Менделеева:
PV= nRT; n = 25/28 = 0,89 моль;
тогда: V = nRT/ p = 0,89 ∙ 8,31 ∙ 296 / 1,06 ∙ 105 = 1,99 ∙ 10-2 м3 = 20,6 л .
N = NА ∙ n= 6,02 ∙ 1023 ∙ 0,89 ≈ 5,36 ∙ 1023 .
Пример 4.
В гидриде двухвалентного металла содержится 7,65 % водорода (по массе). Определите эквивалентную и молярную массу металла.
Решение.
Содержание металла в этом соединении 100,00-7,65 = 92,35 %.
Следовательно, при образовании 100 г гидрида 92,35 г металла соединяются с 7,65 г водорода. Используя закон эквивалентов, определяем эквивалентную массу металла:
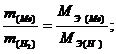
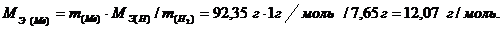
Вычисляем молярную массу металла, зная, что его степень окисления в данном соединении равна плюс двум:
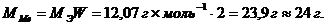
По таблице Д.И. Менделеева находим, что искомый металл Mg.
Пример 5.
Металл массой 1,75 г вытеснил из кислоты 0,7 л водорода (н.у.). Определить эквивалентную массу металла.
Решение. Эквивалентный объем водорода равен:
VЭ (Н2) = 22,4 / 2 = 11,2 л/моль.
Согласно закону эквивалентов:
m (Ме) V(H2)
——— = ——— ;
MЭ(Ме) VЭ(H2)
тогда эквивалентная масса металла:
m(Ме) ∙ Vэ(H2) 1,75 ∙ 11,2
MЭ(Ме) = —————— = —————— = 28 г/моль
V(H2) 0,7
Перебирая возможные значения эквивалента металла (1, ½, 1/3, ¼) получаем, что только Э=½ и М= 56 г/моль соответствует реальному
металлу −Fe.
Пример 6.
В какой массе NaBr содержится столько же эквивалентов, сколько в 123 г Ba(ОН)2?
Решение.
Эквивалентная масса Bа(ОН)2 рассчитывается по формуле:

Следовательно, в 123 г Bа(ОН)2 содержится 123 г : 85,5 г/моль =
= 1,4 моль эквивалентов.
Эквивалентная масса NaBr рассчитывается по формуле расчета эквивалентной массы соли:
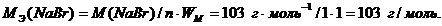
Тогда масса NaBr, в которой содержится 1,4 эквивалента:
m(NaBr) 103 г / моль · 1,4 моль = 113,3 г.
Пример 7.
Вычислите массу молекулы угольной кислоты Н2СО3.
Решение.
Моль любого вещества содержит число Авогадро (Na) структурных единиц (в рассматриваемом примере молекул). Молярная масса Н2СО3 равна 62 г/моль. Следовательно, масса одной молекулы
m0 (H2CO3) = 62/(6,02 · 10-23)=1,03 · 10-22г.
Пример 8.
Рассчитайте, каковы массы (в граммах) одной молекулы брома, двух атомов кальция.
Решение.
M(Br2) = 159,81 (г/моль)
NА = 6,02 ∙ 1023 (моль-1)
m0(Br2) = 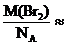 2,655 ∙ 10-22 (г)
2,655 ∙ 10-22 (г)
M(Ca) = 40,08 (г/моль)
m0(Ca) = 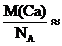 6,658 ∙ 10-23 (г)
6,658 ∙ 10-23 (г)
2 ∙ m0 (Ca) 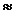 1,332 ∙ 10-22 (г)
1,332 ∙ 10-22 (г)
Ответ: m(Br2) 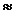 2,655 ∙ 10-22 (г)
2,655 ∙ 10-22 (г)
m(Ca) 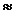 1,332 ∙ 10-22 (г)
1,332 ∙ 10-22 (г)
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|