
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
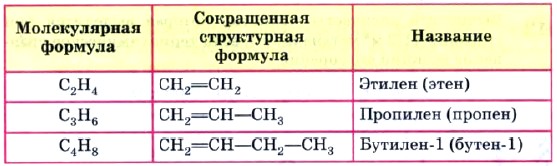
Таблица 3 Гомологический ряд этилена
Таблица 3 Гомологический ряд этилена
Строение молекулы этилена представлено на рисунке 14. Нетрудно заметить, что молекула этилена имеет плоскостное строение. Аналогично и у всех алкенов по месту расположения двойной связи фрагмент молекулы будет иметь плоскостное строение.
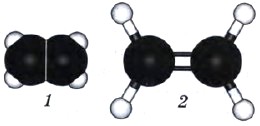
Рис. 14. Модели молекулы этилена: 1 — масштабная; 2 — шаростержневая
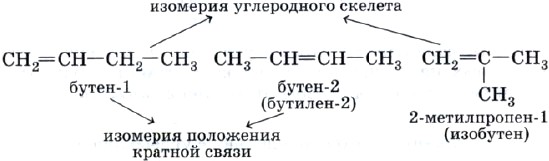
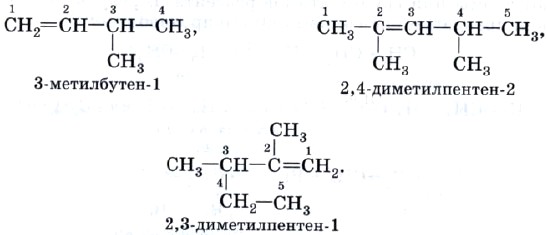
Начиная с третьего члена гомологического ряда алкенов, содержащего в молекуле четыре атома углерода, появляется изомерия углеродного скелета и изомерия положения кратной связи:
Для алкенов характерна межклассовая изомерия с углеводородами другого класса, имеющего такую же общую формулу CnH2n, — циклоалканами. Особенностью химического строения циклоалканов является наличие замкнутой цепочки атомов углерода — цикла, например:
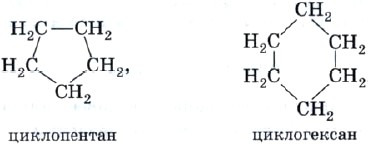
Особенности построения названий алкенов состоят в том, что главная цепь атомов углерода должна обязательно включать двойную С=С-связь, и ее нумерацию проводят с того конца главной цепи, к которому эта связь ближе. В названии углеводорода, оканчивающегося на -ен, цифрой указывают номер того атома углерода, от которого начинается двойная углерод-углеродная связь. Остальные правила формирования названий алкенов остаются такими же, как и для алканов. Например:
В промышленности этилен получают крекингом (расщеплением) продуктов переработки нефти, например керосина.
В лабораторных условиях этилен получают дегидратацией этилового спирта:
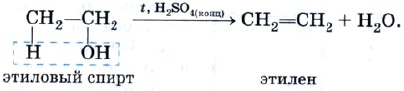
| Реакция дегидратации — это процесс отщепления молекулы воды от молекулы органического соединения. |
Этилен — это бесцветный газ без запаха, почти нерастворим в воде. Он обладает способностью ускорять созревание плодов и овощей, что используют в овощехранилищах, куда закладывают недозрелую плодоовощную продукцию.
Рассмотрим химические свойства алкенов на примере этилена.
Наличие в молекулах алкенов двойной С=С-связи обусловливает их химические свойства.
Для алкенов, как для непредельных углеводородов, характерны реакции присоединениях 1) водорода (гидрирование), 2) воды (гидратация), 3) галогенов (гало-генирование) и др. При этом одна из двух связей между атомами углерода разрывается, и оба атома присоединяют атомы или группу атомов реагента. В результате алкен превращается в алкан или его производное:
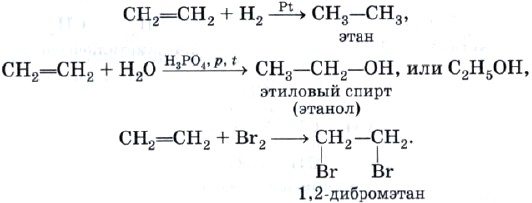
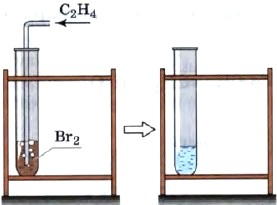
Последняя реакция применяется для обнаружения соединений с кратной (двойной или тройной) углерод-углеродной связью, т. е. является качественной на кратную связь. При этом происходит обесцвечивание бромной воды (раствора брома в воде) (рис. 15). Аналогичная реакция с хлором имеет практическое значение, поскольку приводит к образованию важного продукта — 1,2-дихлорэтана, используемого в качестве растворителя и для получения пластмасс.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|