
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Физические свойства.. Получение
Физические свойства.

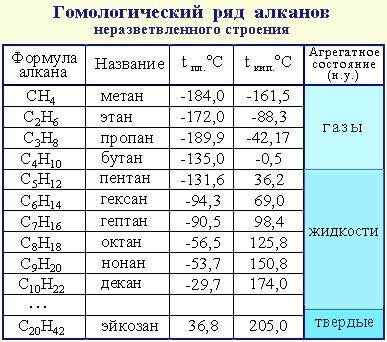
Получение
Способы выделения их из природного сырья.
| Природные источники алканов | Способы получения |
| Фракционная перегонка.
Фракции.
1) ректификационные газы (С3Н8, С4Н10 )
2) газолиновая фракция (С5Н12 до С11Н24 )
3) лигроиновая фракция (С8Н18 до С14Н30 )
4) керосиновая фракция (С12Н26 до С18Н38 )
5) дизельное топливо (С13Н28 до С19Н36 )
6) мазут(С18Н38 - С25Н52, С28Н58 - С38Н78)
Крегинг:
|
. «Синтетические способы получения алканов»
| Способ получения | Химизм реакции |
| Изомеризация | 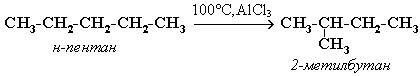
|
| Гидрирование | 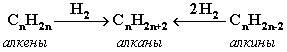
|
| Синтез Вюрца | 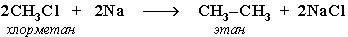
|
| Декарбоксилирование | CH3 COONa + NaOH t CH4 + Na2 CO3 |
| Гидролиз карбидов | 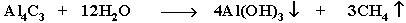
|
1. Горючесть алканов.
При поджигании (t = 600ºС) алканы вступают в реакцию с кислородом, при этом происходит их окисление до углекислого газа и воды.
СnН2n+2 + O2 ––CO2 + H2O + Q
например:
СН4 + 2O2 ––CO2 + 2H2O + Q
Смесь метана с кислородом или воздухом при поджигании может взрываться.
Наиболее сильный взрыв получается при объёмных отношениях 1 : 2 (с кислородом) или 1 : 10 (с воздухом), т.к. метан и кислород вступают в реакцию полностью.
Подобные смеси опасны в каменноугольных шахтах. Чтобы обеспечить безопасность работы в шахтах, там устанавливают анализаторы, сигнализирующие о появлении газа, и мощные вентиляционные устройства.
С3Н8 + 5O2 ––3CO2 + 4H2O + Q
Горение пропан - бутановой смеси можно продемонстрировать на примере газовой зажигалки.
При горении алканов выделяется много теплоты, что позволяет использовать их в качестве источника энергии. Но большая часть их используется в качестве сырья для получения других продуктов.
2. Разложение алканов.
СnН2n+2 → C + H2 ↑
С4Н10 → 4C + 5H2↑
При сильном нагревании (свыше 10000С) без доступа воздуха метан разлагается на углерод (в виде сажи) и водород:
СН4 → C + 2H2 ↑
Метан в термическом отношении более устойчив, чем другие алканы. Причина этого в достаточной прочности С – Н связей.
В этом процессе промежуточными продуктами могут являться этилен и ацетилен:
2СН4→Н2С=СН2 + 2Н2
2СН4→НС≡СН + 3Н2
3. Реакции замещения (протекают с галогенами и другими окислителями при определённых условиях: свет, температура).
1) Галогенирование:
CH4 + Cl2 → CH3Cl + HCl (хлорметан)
CH3Cl + Cl2 → CH2Cl2 + HCl (дихлорметан)
CH2Cl2 + Cl2 → CHCl3 + HCl (трихлорметан)
CHCl3 + Cl2 → CCl4 + HCl (тетрахлорметан).
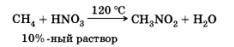
- Нитрование ( реакция Коновалова):
Алканы реагируют с 10% раствором азотной кислоты или оксидом азота N2O4 в газовой фазе при температуре 140° и небольшом давлении с образованием нитропроизводных. Реакция так же подчиняется правилу Марковникова.
Механизм цепных реакций достаточно сложен, объяснение ему было дано русским учёным Н.Н. Семёновым, за что он в 1956 г. был удостоен Нобелевской премии.
4. Реакции изомеризации характерны не для всех алканов. Обращается внимание на возможность превращения одних изомеров в другие, наличие катализаторов.
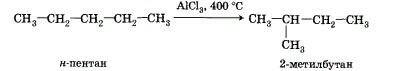
5. Каталитическое окисление метана приводит к образованию важных кислородсодержащих органических соединений.
2CH4 +O2=2CH3OH
Чаще для синтеза этих соединений используют так называемый синтез-газ, который получают при действии на метан водой в присутствии катализатора (Al2O3) и высокой температуры:
- Ароматизация:
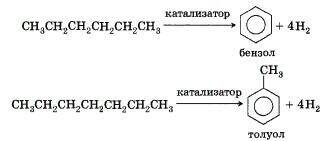
Следует указать, что метан и его гомологи не взаимодействуют в обычных условиях с кислотами и щелочами, окислителями и восстановителями.
Механизм реакции замещения
Стадия 1 – зарождение цепи
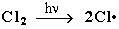
Стадия 2 – рост (развитие) цепи.
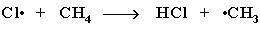
(Реакция Cl· + CH4 CH3Cl + H· не идет, т.к. энергия атомарного
водорода H· значительно выше, чем метильного радикала ·СН3).
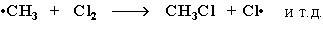
Стадия 3 – обрыв цепи.
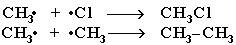
При хлорировании или бромировании алкана с вторичными или третичными атомами углерода легче всего идет замещение водорода у третичного атома, труднее у вторичного и еще труднее у первичного. Поэтому, например, при бромировании пропана основным продуктом реакции является 2-бромпропан:

|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|