
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Опыт 3. Произведение растворимости. Условия образования осадков.
Опыт 3. Произведение растворимости. Условия образования осадков.
Реактивы и оборудование: штатив для пробирок, пробирки, стеклянная палочка, раствор соли свинца 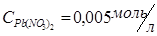 или раствор ацетата свинца
или раствор ацетата свинца 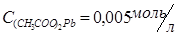 , раствор хлорида калия
, раствор хлорида калия 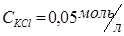 , раствор йодида калия
, раствор йодида калия 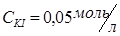 .
.
Методика выполнения:
В две пробирки налить по 1 мл 0,005 М раствора соли свинца (Pb(NO3)2 или (CH3COO)2Pb). В одну из пробирок прибавить равный объем 0,05М раствора хлорида калия, а в другую – такой же объем 0,05М раствора йодида калия. Отметьте наблюдаемые явления. Составьте уравнения реакций в молекулярной и ионной формах. Объясните полученные результаты, вычислив произведение концентрации ионов и сравнив полученные значения с произведением растворимости соответствующей малорастворимой соли (см. в интернете таблицу растворимости).
Опыт 4.Определение рН растворов солей при помощи рН-индикаторной бумаги
Реактивы и оборудование: универсальная pH-индикаторная бумага, дистиллированная вода, карбонат натрия Na2CO3, нитрит натрия NaNO2, нитрат алюминия Al(NO3)3, хлорид цинка ZnCl2, ацетат аммония CH3COONH4, хлорид калия KCl.
Методика выполнения: семь полосок рН-индикаторной бумаги поместите на предметные стекла. Одну из них смочите водой и оставьте для сравнения, а на оставшиеся шесть нанесите 1-2 капли исследуемого раствора соли. Анализируемые соли указаны в таблице
Таблица 2. – Определение рН растворов солей
| Анализируемая соль | Цвет рН-индикаторной бумаги | рН раствора соли |
| Na2CO3 NaNO2 Al(NO3)3 ZnCl2 CH3COONH4 KCl | Темно синий Синий Красный Красный Розовый Желтый |
Полученную окраску сравните с индикаторной шкалой, укажите соответствующее значение рН. Результаты отобразите в таблице.
Составьте уравнения гидролиза солей в молекулярной и молекулярно-ионной форме. Объясните наблюдаемое изменение окраски рН-индикаторной бумаги.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|