
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Опыт 2. Зависимость степени электролитической диссоциации от различных факторов.
Опыт 2. Зависимость степени электролитической диссоциации от различных факторов.
Реактивы и оборудование: штатив для пробирок, пробирки, стеклянная палочка, химическая ложечка (либо шпатель), пробиркодержатель, газовая горелка, раствор соляной кислоты 1М 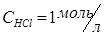 , раствор уксусной кислоты 1М
, раствор уксусной кислоты 1М 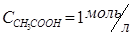 , концентрированная уксусная кислота (СH3COOH(конц.)), цинк металлический (Zn), раствор аммиака 1М
, концентрированная уксусная кислота (СH3COOH(конц.)), цинк металлический (Zn), раствор аммиака 1М 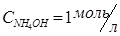 , кристаллический хлорид аммония (NH4Cl(крист.)), спиртовой раствор фенолфталеина.
, кристаллический хлорид аммония (NH4Cl(крист.)), спиртовой раствор фенолфталеина.
Методика выполнения:
Зависимость степени электролитической диссоциации от различных факторов:
а) От природы электролита. В одну пробирку налить 2-3 мл 1М HCl, в другую – равный объем 1М CH3COOH. В каждую из пробирок бросить по одинаковому кусочку цинка. Наблюдать выделение водорода. В какой из пробирок газ выделяется более энергично? Объясните, почему так происходит, учитывая то, что чем больше степень диссоциации кислоты, тем больше концентрация ионов водорода, тем интенсивнее происходит выделение водорода. Составьте уравнения реакций в молекулярной и ионной формах.
Интенсивнее с соляной кислотой
б) От температуры. В 2 пробирки налить по 2-3 мл раствора уксусной кислоты. В каждую из пробирок бросить по кусочку цинка. Одну пробирку оставить в штативе, а другую закрепить в пробиркодержателе и нагреть не до кипения. Что происходит в обеих пробирках? Одинакова ли скорость выделения водорода в первом и во втором случаях? Объясните, как влияет изменение температуры на степень диссоциации уксусной кислоты? Полагаясь на полученные данные и основываясь на принципе Ле-Шателье, сделайте вывод о том, экзотермическим или эндотермическим является процесс диссоциации уксусной кислоты. Запишите уравнение диссоциации.
При нагревании быстрее
в) От концентрации электролита.В одну пробирку налить 2-3 мл концентрированной уксусной кислоты, в другую пробирку налить такой же объем 1М раствора уксусной кислоты. В каждую из пробирок бросить по одинаковому кусочку цинка. Отметить наблюдаемые явления. Ответьте, как разбавление раствора влияет на степень диссоциации электролита?
Разбавленная реагирует лучше
г) От наличия одноименных ионов. В две пробирки налить по 2-3 мл 1М раствора гидроксида аммония и по 2-3 капли фенолфталеина. В одну из пробирок добавить несколько кристаллов хлорида аммония. Сравнить цвет растворов в пробирках. Объяснить наблюдаемое изменение окраски раствора во второй пробирке после добавления хлорида аммония, исходя из смещения равновесия в уравнении диссоциации гидроксида аммония. Как при этом изменится степень диссоциации гидроксида аммония?
В пробирке с аммонием светлее окраска
По каждому опыту написать уравнения и сделать выводы о том как влияют эти факторы на протекание реакции (по лекции)
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|