
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Теоретическая часть
Теоретическая часть
При объемно-аналитических определениях чаще всего приходится вычислять одну из трех величин: объем стандартного раствора V, израсходованный на титрование определяемого вещества (мл), концентрацию стандартного раствора си содержание определяемого вещества Q в растворе, в граммах. Данные величины связаны между собой, поэтому, зная две из них, всегда можно найти третью.
Концентрацию вычисляют по формулам:
Т = g / V (1)
где Т- титр раствора, г/мл;
g-навеска вещества, г;
V-объем раствора, мл
N = 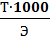 (2)
(2)
где N – нормальность раствора; моль/л
Э – эквивалентная масса вещества(молярная масса эквивалента)г/моль
Массу вещества Q в растворе рассчитывают по формуле:
Q = T·V (3)
или Q = 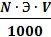 (4)
(4)
Для расчетов можно использовать и титр по определяемому веществу. Согласно закону эквивалентов на титрование 1 эквивалента любого вещества будет израсходован 1 эквивалент другого вещества. Из этого вытекает правило: объемы двух растворов разных веществ (например, кислоты и щелочи) реагируют между собой в количествах, обратно пропорциональных их нормальным концентрациям. Поэтому объем раствора можно вычислить из следующих соотношений:
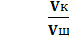 =
= 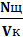 или Vк · Nк = Vщ · Nщ (5)
или Vк · Nк = Vщ · Nщ (5)
где Vк и Vщ - объемы растворов кислоты и щелочи
Nк и Nщ -нормальные концентрации растворов кислоты и щелочи



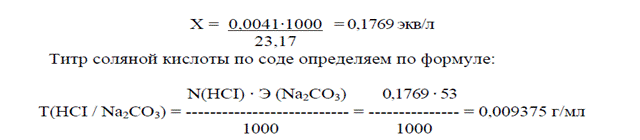
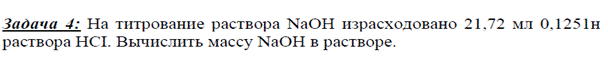
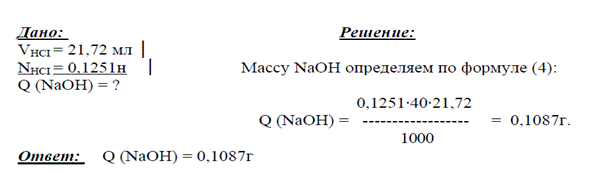
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|