
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Расчет фактора эквивалентности
29.05.20- 2 и 3 пара
1.Посмотрите видео-объяснение "Нормальная концентрация раствора" по ссылке:
https://www.youtube.com/watch?v=JO40bYE3KnI
- видео-объяснение "Титр раствора (Т). Решение задач. Часть 1." по ссылке: https://www.youtube.com/watch?v=SJA83AaMtUE
2. Разместить в комментариях к уроку до 12-50.
Тема. Эквивалент, молярная масса эквивалентов,
молярная концентрация эквивалентов, титр
Эквивалент (моль эквивалентов вещества) - это такое его количество, которое взаимодействует с одним молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Моль эквивалентов водорода равен одному 1 моль.
Число, показывающее, какая часть молекулы или другой частицы вещества соответствует эквиваленту, называетсяфактором эквивалентности (fЭ). Фактор эквивалентности – это безразмерная величина, которая меньше, либо равна 1.
Расчет фактора эквивалентности
1. Для элемента (Э) : fэ = 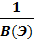 ;где В(Э) - валентность элемента. Например:
;где В(Э) - валентность элемента. Например:
fэ (Fe)FeO=  , т. к. валентность Fe в FeO равна 2.
, т. к. валентность Fe в FeO равна 2.
fэ (Fe)Fe2O3=  , т. к. валентность Fe в Fe2O3 равна 3.
, т. к. валентность Fe в Fe2O3 равна 3.
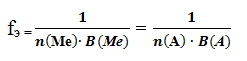
2. Для соли:
где n(Ме) – число атомов металла (индекс в химической формуле соли),
В(Ме) – валентность металла;
n(А) – число кислотных остатков,
В(А) – валентность кислотного остатка
Например:
f(Cr2(SO4)3) = 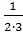 =
= 
Молярная масса эквивалента(МЭ) – это масса одного моля эквивалентов, г/моль. Она равна произведению молярной массы вещества на фактор эквивалентности:
МЭ = М · fЭ
Например: Молярная масса эквивалента гидроксида меди (II):
Mэ (Cu(OH)2) = M (Cu(OH)2) ∙ f(Cu(OH)2) = (64+ 16∙2+1∙2) ∙  = 49 г/моль
= 49 г/моль
2. Нормальная концентрация растворов (нормальность или молярная концентрация эквивалента) cн или N– число моль-эквивалентов данного вещества в одном литре раствора.
сн = 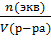 , сн =f· cм,
, сн =f· cм,
где n(экв) - количество вещества эквивалента, моль;
V(р-ра) - объем раствора, л;
f - фактор эквивалентности.
cм - молярная концентрация , моль/л
Для записи концентрации таких растворов используют сокращения н или N. Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.
Титр – содержание вещества в граммах в 1 мл раствора:
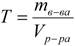
где:
T – титр растворённого вещества, г/мл;
mв-ва – масса растворенного вещества, г;
Vр-ра – объём раствора, мл.
Тема. Расчеты в титриметрии
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|