
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Дом. зад. Параграф 38, изучить лекцию. С.183 № 6
Прислать ответ сам. работы на эл. почту shuhnina@ukr.net
29.04.2020. Домашнее задание по химии. 10 класс. Тема: Белки ( Протеины). План.1Распространение белков в природе 2.Строение молекул белков. 3.Классификация белков. 4. Физические свойства белков. 5. Гидролиз белков. Денатурация белков. Качественные реакции белков.
Белки широко распространены в природе. Особенно много их содержат организмы животных и человека. Так, содержание белков в мышцах 18 – 23%, в мозгу 8 – 9%, в сердце 16 -18%, в крови 7 – 8,5%. Также белки содержатся в костях, хрящах, нервных тканях. Из белков состоят волосы, шерсть, нити натурального шелка, перья, чешуя рыб, копыта, рога, когти. В растениях находится от 5 до 20% белковых веществ. Особенно богаты белком семена бобовых и масляничных культур до 20 - 35%. Главным источником белков для человека является мясо животных до 20%, рыба до 18%, молоко до 3%, сыр до 22,5%, хлеб до 8%, крупы до 10%. Таким образом, белковые вещества – важнейшая составная часть пищи человека и животных наряду с жирами и углеводами. Средняя суточная потребность взрослого человека в белках 80 – 100г. Недостаток белков в пищи резко ухудшает жизнедеятельность организма. Строение белка. Что же собой представляют белки (протеины, полипептиды) – это природные, сложные органические полимеры молекулы, которые построены из остатков альфа α – аминокислот, соединенные пептидной связью - СО – NH – (Пептидная связь– связь между атомами углерода и азота в пептидной группе. Пептидная группа – группа атомов в составе пептидов, состоящая из атомов углерода, кислорода, азота и водорода).
Белки в основном состоят из углерода, водорода, кислорода, азота. С =50 -55%, Н – 6,7 – 7,3%, О = 21,5 – 23,5%, N = 15 – 18%. Также в состав белков могут входить: S, P, J, Se, металлы: Fe, Cu, Zn. Они имеют большую относительную молекулярную массу до 300000 и несколько млн. Mr белка куриного яйца 36000, а одного из белков мышц 150000. Белки делятся на две группы: простые белки (протеины) и сложные белки (протеиды). Протеины состоят только из α - аминокислот. Например, белок куриного яйца, глобулин, альбумин, гистон. Протеиды, кроме аминокислот, содержат фосфорные кислоты, углеводы и др. Например гемоглобин крови, белок молока, казеин. В казеине протеин связан с фосфорной кислотой. В состав молекулы белка входит по одной молекуле каждой из 20-ти аминокислот: NH2 – CH2 – COOH Глицин; СН2 – CHNH2 – COOH Аланин; CH3 – CH(CH3) – CHNН2- СООН Валин ОН –СН2 –СНNH2 –COOH Серин НООС- СН2 – СН2 - СНNН2- СООН Глутамин НS - СН2 - СНNН2 - СООН Цистеин Эти и другие кислоты могут давать при соединении различные комбинации. Они могут давать свыше 2,4.10 в 18 степени различных комбинаций. Вот поэтому строение молекулы белка так сложны. Русский биохимик А.Я.Данилевский в 1888г. доказал, что в молекулах белков содержатся повторяющиеся пептидные группы атомов - СО – и - NН-. Немецкий ученый Фишер синтезировал соединение, в молекулы которых входило 20 остатков различных аминокислот, соединенные пептидными связями. Эти полипептиды напоминали по свойствам белки. Пептиды – органические соединения, состоящие из нескольких аминокислотных остатков, соединённых пептидной связью. Полипептиды – макромолекулы, состоящие из 20–50 аминокислотных остатков, соединенных пептидной связью. Синтез (получение) полипептидов;
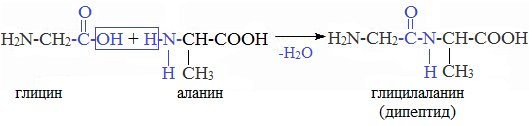 Для трипептида взяли глицин + серин + цистеин :
Для трипептида взяли глицин + серин + цистеин :
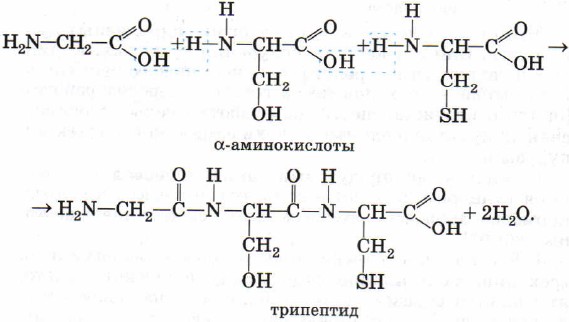
Трипептид глицилсерилцистеин:
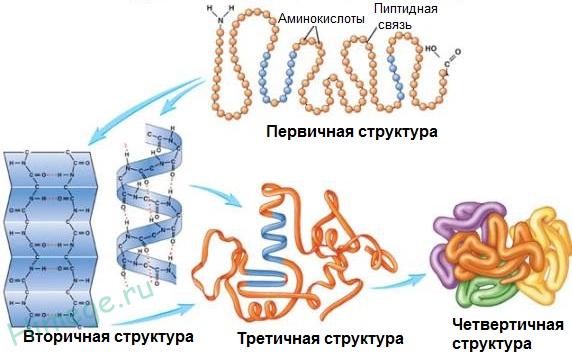
Классификация белков.В молекулах белков Амин (NH2) и кислотные (СООН) остатки повторяются в строгой последовательности. Эта последовательность аминокислотных звеньев в линейной полипептидной цепи называется первичной структурой белковой молекулы. Первичная структура белков представляет собой определенную последовательность чередования аминокислотных остатков в линейной полипептидной цепи. Аминокислоты связаны друг с другом пептидными связями, возникающими между углеродом карбоксильной группы одной и азотом аминогруппы последующей аминокислоты. H2N – CH R1 – CO – NH – CHR2 - COOH + H2O Вторичная структура – спираль, образованная полипептидной цепью, которая удерживается водородными связями между группами –СО – и - NH -. Третичная структура – это конфигурация, которую принимает в пространстве, закрученная в спираль, за счет гидрофобных связей, полипептидная цепь ( обусловлено взаимодействием функциональных групп между собой, например, с образованием сложноэфирного или дисульфидного мостика ). Четвертичная структура – полимерные образования белков, где мономерами являются макромолекулы белка. Эту структуру имеют не все белки. Примером такого белка является гемоглобин, который представляет комплекс из четырех макромолекул.
Физические свойства. Белки разнообразны по своему агрегатному состоянию. Часто это твердые аморфные тела в виде белых порошков. Белки шерсти (кератин) и шелка (фиброин) – прочные волокна. Некоторые белки получены в кристаллическом состоянии ( гемоглобин крови). Многие имеют консистенцию вязких жидкостей или студней (белок куриного яйца). Некоторые белки растворяются в воде (белок куриного яйца), в щелочах, кислотах, но не растворяются в органических растворителях. Белки не способны плавится. При нагревании они разлагаются. Гидролиз белков.Так как в молекуле белка находятся аминогруппа NH2 и карбоксильная группа СООН, то они могут проявлять амфотерные свойства. Яичный белок проявляет кислые свойства Рн = 4,8, белок пшеницы – щелочные свойства Рн = 9,8. Важнейшее свойство белков – их способность к гидролизу. Гидролиз белков – это распад белка на отдельные аминокислоты в водном растворе кислот или щелочей. Белок + пН2О = смесь α-аминокислот.
Гидролиз протекает под действием кислот при температуре. В результате гидролиза образуется смесь– α-аминокислот. Пример.
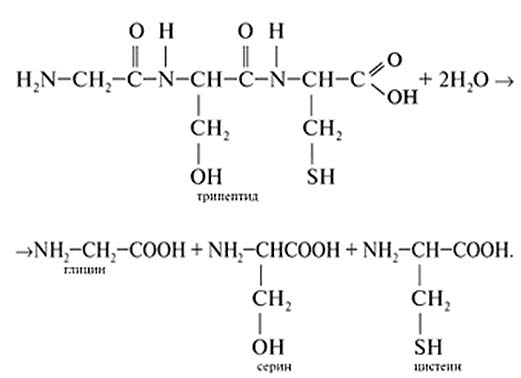
Из трипептида глицилсерилцистеин получили три аминокислоты глицин, серин и цистеин.
Для белков характерны реакции, в результате которых выпадает осадок. В одних случаях полученный осадок при избытке воды вновь растворяется, а в других происходит необратимое свертывание белков, т.е. денатурация (от латинского лишить природных свойств). Например, при кулинарной обработке мяса, рыбы, яиц. С химической точки зрения, денатурация– это разрушение вторичной, третичной и четвертичной структуры белка с сохранением первичной структуры. Она проходит под воздействием физических (температура, радиация) или химических (действием кислот, щелочей, солей тяжелых металлов) факторов. Значит, денатурация – свойства белка менять свою структуру при изменении внешних факторов. При денатурации белок сворачивается и выпадает в осадок. Это необратимый процесс, поэтому, например высокая температура опасна для человеческого организма. При этом белки теряют биологическую активность, живые клетки погибают. То же самое происходит и при действии на белки сильных кислот. Попадание кислоты на кожу вызывает химический ожог. Например, если на белок яйца подействовать разбавленным спиртом, то получим осадок, который можно растворить в воде. Но, если на белок подействовать неразбавленным спиртом, то происходит денатурация, т.е. необратимое свертывание белка. Если на белки подействовать солями легких металлов (NaCL, MgSO4, ZnSO4, (NH4)2SO4) образуется осадок, который опять можно растворить в воде. Если на белки подействовать солями тяжелых металлов ( Fe, Pb, Hg и др.) , а также конц. HNO3 происходит денатурация.
Качественные реакции белков. Цветные реакции белков. 1. Ксантопротеиновая реакция. Растворы белка при кипячении с конц. HNO3 окрашиваются в желтый цвет. Эта реакция доказывает, что в состав белков входят остатки ароматических аминокислот. Раствор белка + конц. HNO3 = желтое окрашивание 2. Биуретоваяреакция. Если к раствору, содержащему белок добавить 10%-ый раствор NaOH, а затем небольшое количество 1%-ого раствора CuSO4, то появится красно - фиолетовое окрашивание. Раствор белка +10%-ый р-р NaOH + 1%-ого р-ра CuSO4 =красно - фиолетовое окрашивание. В щелочной среде, находящиеся в белке пептидные связи образуют такую окраску. 3. Если к раствору, содержащему белок добавить ацетат свинца Pb(COOH)2, а затем + NaOH и нагреть, то выпадает черный осадок, что указывает на содержание серы (цистеин) Группу –SH. При горении белков ощущается запах растительного или животного происхождения. Белки могут разлагаться под действием микроорганизмов. В результате образуются не аминокислоты, а аммиак NH3 , сероводород H2S, фенол С6Н5ОН и другие вещества с неприятным запахом. Например, протухшее яйцо, испорченное мясо, рыба, т.е. происходит гниение белка.
Пример:
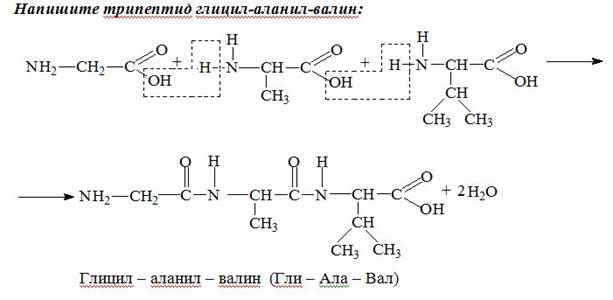
Дом. зад. Параграф 38, изучить лекцию. С.183 № 6
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|