
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
выражают также одно и то же вещество с одним и тем же химическим строением. При выводе каждого следующего члена полученного нами ряда веществ мы отнимали от молекулы предыдущего вещества атом водорода и замещали его на остаток —СН3, т. е. прибавляли групп
выражают также одно и то же вещество с одним и тем же химическим строением. При выводе каждого следующего члена полученного нами ряда веществ мы отнимали от молекулы предыдущего вещества атом водорода и замещали его на остаток —СН3, т. е. прибавляли группу —СН2—, содержащую один атом углерода и два атома водорода. Так как состав метана можно выразить формулой С1Н2+2, то состав следующего члена ряда выразится формулой С2Н2·2+2 и т. д. если допустить, что атомы углерода могут соединяться в молекулах в неограниченном количестве, то мы получим бесконечный ряд веществ, состав которых может быть выражен общей формулой CnH2n+2. Такой бесконечный ряд веществ, каждый последующий член которого отличается от предыдущего на группу СН2, носит название гомологического ряда; каждый член этого ряда является гомологом предыдущих и, естественно, гомологом первого члена ряда — метана. Разница в составе двух соседних членов гомологического ряда (группа СН2) носит название гомологической разности. Все члены гомологического ряда обладают сходными химическими свойствами вследствие сходства их химического строения. Таким образом, гомологами называются вещества, отличающиеся друг от друга по составу на любое число групп СН2, обладающие сходным химическим строением и, следовательно, сходными химическими свойствами. Каждый последующий гомолог может быть выведен из предыдущего путем замещения на метильную группу атома водорода, связанного с углеродным атомом углеродного скелета, или путем внедрения метиленовой группы между двумя углеродными атомами скелета. Понятие гомологии играет важнейшую роль в систематизации и классификации материала органической химии, позволяя свести рассмотрение огромного числа отдельных органических соединений к рассмотрению целых гомологических рядов, все члены которых обладают сходным химическим строением, а следовательно, и сходными химическими свойствами (гомологический ряд углеводородов, ряд спиртов, ряд кислот и т. Если от молекулы метана отнять два атома водорода, то получится остаток, или радикал, метилен=СН2. Этот радикал двухвалентен, так как он может, соответственно валентности углерода, присоединить два атома водорода или иного одновалентного элемента. Поэтому вполне естественно предположить, что два метилена, соединившись друг с другом, могут образовать молекулу. Строение вещества этилена С2Н4, представляющего собой два связанных друг с другом метилена, выражается формулой СН2=СН2. Такая формула означает, что в молекуле этого вещества атомы углерода связаны между собой двумя валентностями. Поэтому такая связь называется двойной связью, в отличие от простой, или ординарной, связи.
Путем таких же рассуждений, которые применялись для вывода гомологического ряда метана, т. е. последовательным замещением атомов водорода на метил, можно вывести другой гомологический ряд —ряд гомологов этилена. Второй член этого ряда С3Н6 будет иметь строение СН3—СН=СН2, а третий C4H8 уже может'существовать в трех изомерных формах:
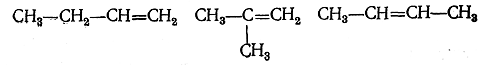
Весь жегомологический ряд этилена будет иметь состав, выражаемый общей формулой СnН2n .Аналогичным образом, соединяя два трехатомных остатка ≡СН (метин),получаем соединение С2Н2, называемое ацетиленом, которому обычно придается строение СН≡СН с тройной связью между атомами углерода. Замещением в ацетилене ато-ма водорода на метил получается его первый гомолог СН3—С≡СН и далее новый гомологический ряд углеводородов, имеющих общий состав CnH2n-2. Каждый из этих гомологических рядов, как и ряд метана, может быть мысленно продолжен до бесконечности, причем для высших гомологов возможна изомерия; число возможных изомеров с увеличением числа атомов в молекуле все увеличивается и в пределе может дойти до бесконечности. В цепи из трех атомов углерода каждый атом углерода может быть соединен с другими атомами углерода двойной связью. Присоединяя необходимое для удовлетворения валентности углерода число атомов водорода, получим углеводород С3Н4 строения СН2=С=СН2, от которого также можно вывести бесконечный гомологический ряд с возрастающим до бесконечности числом изомеров. Этот гомологический ряд будет иметь общую формулу CnH2n-2 тождественную формуле гомологов ацетилена. Сочетая в молекуле двойную и тройную связь, можно полупить углеводород строения СН2=СН—С≡СН и от него гомологический ряд CnH2n-4, при двух тройных связях — углеводород строения СН≡С—С≡СН и его гомологический ряд общей формулы СnH2n-6. Сочетая в более длинных цепях три двойные связи, получим второй гомологический ряд формулы CnH2n-4; при четырех двойных связях — второй гомологический ряд формулы CnH2n-6 и сочетанием еще большего числа двойных и тройных связей — гомологические ряды CnH2n-8, CnH2n-10 и т. д. со все меньшим и меньшим числом атомов водорода при разном числе атомов углерода.
Как видно из рассмотрения различных гомологических рядов, кроме углеводорода С2Н6, принадлежащего гомологическому ряду CnH2n+2 максимальным (предельным) числом атомов водорода, должны существовать углеводороды С2Н4 и С2Н2. Аналогичным образом для каждого из гомологов метана должен существовать ряд углеводородов, отличающихся от гомолога метана тем, что в них содержится меньше атомов водорода на 2, 4, 6 и вообще на любое четное число. Такой ряд получил название изо логического. Каждый член этого ряда по отношению к другому называется изологом. Так, например, изологами являются: этан, этилен и ацетилен или пропан, пропилен и метилацетилен и т. п.
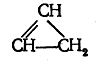
Три и более атомов углерода могут быть соединены в замкнутое кольцо, или цикл. Строение молекул углеводородов, содержащих замкнутое кольцо углеродных атомов, изображается следующими структурными формулами:

Состав циклических углеводородов выражается, как и состав этиленовых углеводородов, общей формулой СnН2n.Если представить себе, что в молекулах циклических углеводородов имеются двойные или тройные связи, то становится понятной возможность существования таких молекул, в которых число водородных атомов будет на четное число меньшим, чем у циклических углеводородов, не содержащих кратных связей. Простейший из таких углеводородов должен иметь строение
Число атомов водорода в молекуле может уменьшаться не только вследствие наличия кратных связей, но и за счет образования нескольких колец из углеродных атомов. При образовании, или «замыкании», каждого нового кольца число атомов водорода, необходимых для насыщения валентностей углеродных атомов, уменьшается на два. Поэтому существуют также изологические ряды углеводородов, содержащих разное число . (одно, два и более) колец углеродных атомов. Такие молекулы называются полициклическими, или многоядерными (бицикли-ческие, трициклические и т. д.).
Образование второго кольца возможно или вне первого кольца
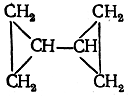
или внутри первого кольца углеродных атомов:
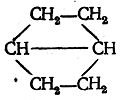
Системы второго рода носят название конденсированных циклов.
Гомологический ряд СnН2n+2 является единственным рядом, содержащим предельное (максимальное) число атомов водорода; он носит название гомологического ряда предельных углеводородов.
Для каждого следующего члена изологического ряда углеводородов (СnН2n, СnН2n-2...) возможен уже не один гомологический ряд, как для предельных углеводородов, а бесчисленное число гомологических рядов. Так, например, составу СnН2nотвечают, кроме ряда олефинов, также ряды циклопропана, цик-лобутана, циклопентана и т. д.
Подобно тому, как можно представить себе образование остатка метана (радикала метила) путем отнятия водорода от молекулы метана, можно получить различные остатки (называемые также радикалами или группами), отнимая от любой молекулы известного строения те или иные атомы. Следовательно, радикалы — это группы атомов, находящихся между собой в непосредственной или посредственной связи, причем один или несколько атомов связаны с числом атомов, недостаточным для удовлетворения правила валентности. Чтобы получить из радикала молекулу, к радикалу нужно присоединить еще некоторое число атомов. Необходимое для этого число одновалентных атомов определяет валентность радикала, или остатка. Так, при отнятии атома водорода от молекулы воды образуется одноатомный радикал — гидроксил ОН.Подобнометилу, гидроксил можетзамещать атомы водорода в молекулах углеводорода. При замещении в метане атома водорода на гидроксил получится молекула, строение которой изображается формулой СН3—О—Н или, сокращенно, СН3—ОН. Из этана этим путем может быть получена молекула структурной формулы СН3—СН2—ОН. При замещении атома водорода на гидроксил в пропане можно получить уже две изомерные молекулы:
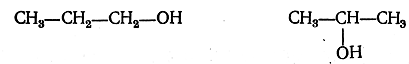
Замещая в метане и его гомологах один из атомов водорода на гидроксил, можно получить гомологический ряд гидроксил-содержаших соединений общей формулы СnН2n+2O, или СnН2n+1—OH. Такие соединения, содержащие радикал гидроксил, называются спиртами или алкоголями. При отнятии атома водорода от аммиака образуется одноатомный остаток —NH2 (аминогруппа), которым также можно заменять атомы водорода в углеводородах. Таким образом, например, можно получить молекулу с формулой строения СН3—NH2 и гомологический ряд соединений, называемых аминами.Остатки, или радикалы, можно производить также и от более сложных соединений. Например, если отнять от молекулы азотной кислоты гидроксил, то получится одноатомный остаток, или радикал, называемый нитрогруппой. Замещая атомы водорода в углеводородах на нитрогруппы, получим гомологические ряды нитросоединений.
Отнимая один из гидроксилов от серной кислоты, изображаемой формулой

получаем одноатомный остаток, называемый сульфоксилом:

При замещении атомов водорода в молекулах углеводородов на сульфоксил получаются гомологические ряды сульфо-кислот.
Радикалы могут быть также двухатомными, трехатомными и вообще многоатомными. Так, например, двухатомный остаток
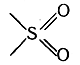
может заменять два водородных атома, вследствие чего на этот остаток можно заместить два атома водорода в двух молекулах метана или других углеводородов. Так получаются молекулы соединений, называемых сульфонами, например СН3—SO2—СН3. Атом кислорода можно рассматривать как двухатомный остаток молекулы воды, вследствие чего он также может замещать два атома водорода в двух молекулах метана и пр. Примером таких кислородных производных углеводородов служат соединения типа СН3—О—СН3, называемые эфирами. Если же атом кислорода связан только с одним атомом углерода (соответственно валентности кислорода, такую связь изображают в виде двойной связи), то у этого углеродного атома остается возможность соединения с двумя атомами водорода или с двумя одноатомными остатками, что соответствует формуле двухатомного радикала >С=О. Этот радикал называется карбонилом или карбонильной группой. Примерами соединений, содержащих карбонильную группу, могут являться вещества строения
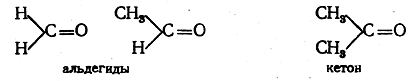
Из сказанного вытекает, что от каждого из углеводородов можно произвести ряд веществ, в углеводородных остатках которых содержится то же число атомов углерода, что и в исходных углеводородах, но один или несколько атомов водорода замещены на различные атомы (неуглеродные) или остатки неорганических молекул. Все соединения, производящиеся таким образом от углеводорода, называются производными этого углеводорода. Примером ряда производных может служить ряд производных метана: СН3—Сl, СН3—SO3H, СН3—SO2—СН3, СН2Сl2, СН2=О, СНСl3, ССl4 и т.д. Большое число углеводов производных представляет собой вещества, молекулы которых состоят из двух частей: углеводородных остатков, химические свойства которых в большинстве случаев близки, и групп, каждая из которых обладает характерной реакционной способностью. Эти группы в основном определяют химический характер молекул. Так, например, молекулы метилового спирта СН3ОН, метиламина CH3NH2, уксусной кислоты СН3—СООН состоят из углеводородного остатка метила и соответственно гидроксильной, аминной и карбоксильной группы. Именно эти группы и определяют принадлежность вещества к определенному классу соединений (спирты, амины, кислоты).
Такие группы, как —ОН, —NH2, 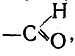 —SO3H, в основном определяющие химическое поведение соединения, называются функциональными группами или функциями. Чрезвычайно важным является то, что функциональные группы в различных соединениях (например, аминогруппа в CH3NH2, (CH3)2CHNH2, (CH3)3CNH2 и т. д.) в основном обладают одинаковым химическим характером. Это обстоятельство, замеченное еще сторонниками теории типов, имеет важнейшее значение как для классификации органических соединений, так и для изучения зависимости реакционной способности от химического строения. Теория радикалов была основана на ряде экспериментально проверенных данных, свидетельствовавших о том. что при химических реакциях сложных молекул целые группы атомов (радикалы) в неизменном виде переходят из одной молекулы в другую. Несмотря на то, что сторонники теории типов, правильно отвергнувшие аналогию радикалов с элементами, перестали обращать внимание на эту сторону химических реакций, их собственные опыты давали все новые и новые подтверждения правильности закона радикалов. Теория химического строения дала этому индуктивному закону свое объяснение и более точную формулировку. Весь громадный опыт исследования реакций сложных органических веществ свидетельствует о том, что при каждой отдельной химической реакции изменению подвергается лишь часть молекулы реагирующего вещества, остальная же часть молекулы целиком переходит во вновь образующиеся молекулы. Так как, согласно теории химического строения, отдельные атомы молекулы связаны между собой определенным образом, то естественно ожидать, что при переходе целых групп атомов без изменения из одной молекулы в другую в переходящих группах (называемых теперь радикалами или остатками) сохраняются все связи атомов. Действительно, исследования образующихся при реакции веществ показывают, что в новых веществах сохраняются все типы связей, за исключением немногих, т. е. что новые вещества обладают всеми типическими реакциями исходных веществ, за исключением реакций, соответствующих небольшому числу изменившихся связей. Закон остатков, или радикалов, можно поэтому формулировать следующим образом. При отдельных химических реакциях в молекулах исходных веществ ограниченное число связей между атомами (в простейшем случае — лишь одна связь) разрывается и заменяется связями с другими атомами; остальные же части молекулы, называемые остатками или радикалами, переходят во вновь образующиеся молекулы, сохраняя неизменными все существовавшие раньше связи между отдельными атомами.
—SO3H, в основном определяющие химическое поведение соединения, называются функциональными группами или функциями. Чрезвычайно важным является то, что функциональные группы в различных соединениях (например, аминогруппа в CH3NH2, (CH3)2CHNH2, (CH3)3CNH2 и т. д.) в основном обладают одинаковым химическим характером. Это обстоятельство, замеченное еще сторонниками теории типов, имеет важнейшее значение как для классификации органических соединений, так и для изучения зависимости реакционной способности от химического строения. Теория радикалов была основана на ряде экспериментально проверенных данных, свидетельствовавших о том. что при химических реакциях сложных молекул целые группы атомов (радикалы) в неизменном виде переходят из одной молекулы в другую. Несмотря на то, что сторонники теории типов, правильно отвергнувшие аналогию радикалов с элементами, перестали обращать внимание на эту сторону химических реакций, их собственные опыты давали все новые и новые подтверждения правильности закона радикалов. Теория химического строения дала этому индуктивному закону свое объяснение и более точную формулировку. Весь громадный опыт исследования реакций сложных органических веществ свидетельствует о том, что при каждой отдельной химической реакции изменению подвергается лишь часть молекулы реагирующего вещества, остальная же часть молекулы целиком переходит во вновь образующиеся молекулы. Так как, согласно теории химического строения, отдельные атомы молекулы связаны между собой определенным образом, то естественно ожидать, что при переходе целых групп атомов без изменения из одной молекулы в другую в переходящих группах (называемых теперь радикалами или остатками) сохраняются все связи атомов. Действительно, исследования образующихся при реакции веществ показывают, что в новых веществах сохраняются все типы связей, за исключением немногих, т. е. что новые вещества обладают всеми типическими реакциями исходных веществ, за исключением реакций, соответствующих небольшому числу изменившихся связей. Закон остатков, или радикалов, можно поэтому формулировать следующим образом. При отдельных химических реакциях в молекулах исходных веществ ограниченное число связей между атомами (в простейшем случае — лишь одна связь) разрывается и заменяется связями с другими атомами; остальные же части молекулы, называемые остатками или радикалами, переходят во вновь образующиеся молекулы, сохраняя неизменными все существовавшие раньше связи между отдельными атомами.
Имеются случаи, когда радикалы, переходящие при реакциях из молекулы в молекулу, не сохраняют своего первоначального строения, а входят в новую молекулу с измененным порядком связей атомов Такие сравнительно редко встречающиеся реакции называются внутримолекулярными перегруппировками. Перегруппировки иногда сильно затрудняют определение строения веществ. Однако широкое исследование внутримолекулярных перегруппировок показало, что и здесь происходит лишь ограниченное и притом строго определенное изменение порядка связей. Таким образом, возможность внутримолекулярных перегруппировок не находится в противоречии с законом радикалов, и их можно рассматривать лишь как особое проявление этого закона. Теория химического строения, как было показано выше, дает возможность заранее предсказать число индивидуальных молекул, обладающих данным составом. В химии в настоящее время неизвестно ни одного примера, когда число полученных изомеров превышало бы число предсказанных теорией. Имеется ряд примеров, когда теория предсказывает большее число изомеров сравнительно с числом существующих. Внимательное изучение этого кажущегося противоречия теории химического строения с фактами обогатило органическую химию новыми данными. Оказалось, что некоторые молекулы с определенным сочетанием атомов и атомных групп настолько легко претерпевают перегруппировки, что их не удается выделить в условиях опыта. Так, например, все попытки получить изомер аллилового спирта строения СН3—СН=СН—ОН оканчиваются неудачей; во всех случаях вместо такого спирта был выделен лишь про-пионовый альдегид СН3—СН2—СН=О; в тех реакциях, которые должны были бы привести к образованию кетона

удается выделить только α-нафтол:

Невозможность выделения подобных изомеров нисколько непротиворечит теории химического строения, а находит естественное объяснение в их малой энергетической устойчивости. В огромном большинстве случаев изомеры устойчивы при обычных условиях и друг в друга не превращаются. Известно, однако, довольно значительное число примеров, когда изомерные органические вещества самопроизвольно превращаются друг в друга. Это явление, открытое и объясненное А. М. Бутлеровым в шестидесятых годах, называется таутомерией. А.М. Бутлеров следующим образом характеризует явление таутомерии: «В огромном большинстве случаев мы имеем дело с веществами, в газообразной или жидкой массе которых, при обыкновенных условиях, химическому равновесию соответствует присутствие частиц одного известного определенного химического строения в бесконечно-большем числе, чем частиц других строений, изомерных с первым. Но вероятно, что в некоторых случаях можно встретить и такие тела, масса которых постоянно заключает в заметном количестве изомерные частицы различного химического строения, — частицы, постоянно «соперничест-вующие» между собою, перегруппировывающиеся взаимно из одного строения в другое. В первом случае можно смело говорить об определенном химическом строении тела, а во втором — суждение об каком-либо одном определенном строении явится бесполезным, потому что в массе вещества присутствуют частицы различных, например двух, строений, и, при склонности частиц к перегруппировке, вся эта масса, понятно, будет подвергаться реакциям, свойственным одному строению, или реакциям, свойственным другому строению, смотря по натуре реагента, влиянию которого подвергается вещество, — смотря, так сказать, по направлению действия этой реакции». Таким образом, явление таутомерии заключается в том, что вещество определенного состава и молекулярного веса существует в виде равновесной смеси двух или нескольких изомеров, легко переходящих друг в друга. Принципиально иной точки зрения на это явление придерживался Лаар (1885). Термином «таутомерия» он обозначал по существу двойственную реакционную способность, т. е. явление, при котором вещество вступает в химические реакции в соответствии с двумя (или более) возможными для него структурными формулами. Так, например, по мнению Лаара, причина таутомерии синильной кислоты заключается не в существовании дискретных молекул Н—C≡N и Я—N=C, способных к взаимному превращению, а в том, что атом водорода непрерывно осциллирует (подобно осцилляции двойных связей, происходящей, согласно Кекуле, в молекуле бензола) между атомами азота и углерода так, что все молекулы синильной кислоты имеют одинаковое строение. Представление Лаара о природе таутомерии было ошибочным. В химии стало общепринятым бутлеровское понимание таутомерии как. динамической изомерии. Если таутомерия обусловлена перемещением в молекуле атомов или групп атомов в виде катионов, то такие процессы называются катионотропными таутомерными превращениями. Во многих изученных случаях таутомерия обусловлена миграцией катиона водорода (протона) от одного атома молекулы к другому. Такие таутомерные превращения называются прото-тропными; они обусловливают, например, следующие виды таутомерии:

Прототропные превращения ускоряются как кислотами, так и основаниями.
Значительно менее изучены анионотропные таутомерные превращения, когда атомы или группы атомов мигрируют в виде анионов. Примером анионотропного превращения может служить наблюдающаяся в определенных условиях таутомерия замещенных непредельных углеводородов с заместителем X (галоид, ацилоксигруппа) в так называемом «аллильном» положении:
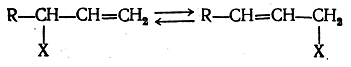
Таутомерные превращения, при которых таутомеры могут быть выделены в индивидуальном состоянии или обнаружены в смеси аналитическими методами, предложено называть десмотропией. Равновесная смесь таутомеров называется аллелотропной смесью. Те случаи таутомерии (амиды кислот, фенолы, и т. п.), когда вторая форма содержится в смеси в столь ни чтожных количествах, что ее не удается не только выделить, но и. обнаружить аналитическими методами, было предложено называть псевдомерией. Естественно, что о псевдомерии в любом случае можно говорить только предположительно. Вероятно, в большинстве случаев, когда предполагается наличие псевдомерии, в действительности наблюдается двойственная реакционная способность. Превращения таутомеров друг в друга происходят в жидком состоянии или в растворах. Если, например, два индивидуальных таутомера А и В нагреть выше их температур плавления или растворить в каких-либо растворителях, то в результате протекающих обратимых реакций
А ------> В и В ------> А
как из таутомера А, так и из таутомера В образуется одна и та же равновесная смесь таутомеров:
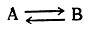
Таутомерное равновесие характеризуется его положением и скоростью установления. И положение таутомерного равновесия, и скорость его установления весьма различны. Они зависят от строения таутомерного вещества, природы растворителя и температуры. Следует отметить, что между явлениями изомерии и таутомерии нет резкой границы. Вещества, изомерные при определенных условиях, могут в других условиях подвергаться тауто-мерным превращениям. Так, например, изомерные винилуксус-ная и кротоновая кислоты, устойчивые в обычных условиях, способны превращаться друг в друга в горячем щелочном растворе:
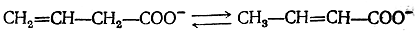
Бромистый пропил и бромистый изопропил, являющиеся в обычных условиях устойчивыми изомерами, при 250 °С (в запаянной трубке) образуют равновесную смесь:
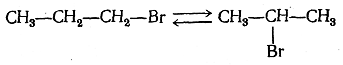
С другой стороны, например, енольная и кетонная формы ацетоуксусного эфира при температуре жидкого воздуха не способны переходить друг в друга и являются втаких условиях не таутомерами, а обычными изомерами. Понятие химического строения, данное А. М. Бутлеровым, включает порядок химической связи атомов в молекуле и в своем первоначальном виде не содержит каких-либо положений о размещении атомов в пространстве. Однако А. М. Бутлеров ясно сознавал неизбежность возникновения новой области органической химии — стереохимии. Совершенно справедливо полагая, что первоочередная задача заключается в установлении порядка химической связи атомов в молекулах и выяснении зависимости химических свойств вещества от его химического строения, А. М. Бутлеров не считал возможным в то время специально заниматься вопросами расположения атомов в пространстве. Однако он выступал против всяческих попыток считать это пространственное расположение принципиально непознаваемым. «Если же атомы действительно существуют, то я не вижу, почему, как думает Кольбе, должны быть тщетными все попытки определить пространственное расположение последних, почему будущее не должно научить нас производить подобное определение?»,— писал А. М. Бутлеров в 1863 г.
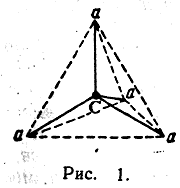
В 1874 г. французский ученый Ле-Бель (1847—1930) и голландский ученый Вант-Гофф (1852—1911), независимо друг от друга, высказали предположение, что четыре атома или радикала, связанные с углеродным атомом, расположены не в одной плоскости, а в пространстве по углам тетраэдра, в центре которого находится углеродный атом. Пространствен ное расположение четырех атомов вокруг атома углерода изображено на рис. 1. Если заменить любой из четырех атомов а каким-либо иным атомом b, то получатся пространственные фигуры, которые после вращения в пространстве при наложении совпадают друг с другом, а следовательно, изображаемые этими фигурами молекулы тождественны между собой. То же будет происходить при замещении любого второго атома а атомом с. Но при замещении одного из двух оставшихся незамещенными атомов а на атом d возможны два различных пространственных расположения, изображаемых в перспективе фигурами рис. 2 и 3.
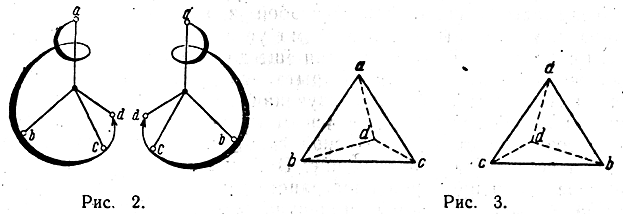
Эти фигуры ни при каком вращении в пространстве не могут совпасть друг с другом. Если из четырех точек а, b, с, d две любые точки совпадают, то остальные две точки окажутся расположенными в противоположных углах тетраэдра. Молекулы, построенные в пространстве аналогично изображенным схемам, следовательно, не тождественны, а различны; поэтому должны быть различны и составленные из этих молекул вещества.Таким образом, стереохимическая теория приводит к выводу, что если молекула асимметрична (не имеет элементов симметрии), то при одинаковом порядке связи атомов в молекуле появляется изомерия, зависящая от различия в пространственном расположении атомов, так называемая пространственная изомерия, или стереоизомерия. Внимательное рассмотрение моделей, изображенных на рис. 2 и 3, показывает, что в указанном случае молекулы обоего рода чрезвычайно сходны между собой и отличаются друг от друга только как несимметричный предмет (не имеющий плоскости симметрии) отличается от своего зеркального изображения. Так, зеркальное изображение левой перчатки не может совпасть с самой левой перчаткой, но может совпасть с правой перчаткой. Формы правой и левой рук не могут совпасть в пространстве, хотя они относятся друг к другу, как предмет к зеркальному изображению. Так же отличаются между собой винты с правой и левой нарезкой. При наличии в молекуле углеродного атома, соединенного с четырьмя различными атомами или группами, возможно существование двух изомерных форм молекул, относящихся друг к другу, как несимметричный предмет к своему зеркальному изображению. Поэтому такой атом называется асимметрическим атомом углерода. Вытекающая из стереохимической гипотезы, как следствие, необходимость существования особой изомерии при наличии в молекуле асимметрического атома углерода прекрасно согласуется с фактами. Такая изомерия еще до возникновения стерео-химической гипотезы была открыта знаменитым французским ученым Пастером (1848) при изучении им винной кислоты, молекула которой содержит два асимметрических атома углерода. После создания стереохимической гипотезы этот вид изомерии получил естественное объяснение. В дальнейшем было изучено огромное число примеров пространственной изомерии. Две изомерные формы, молекулы которых относятся друг к другу, как предмет к зеркальному изображению, почти по всем химическим и физическим свойствам не отличаются друг от друга. Их плотность, температуры плавления и кипения, теплопроводность, электропроводность, показатель преломления и пр. совершенно одинаковы. Однако такие изомерные формы отличаются друг от друга двумя свойствами.
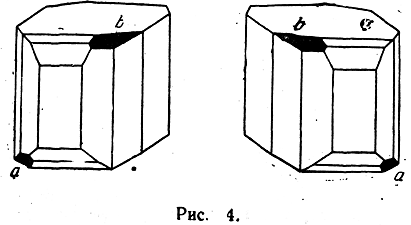
Первое свойство — способность этих веществ кристаллизоваться в так называемых энантиоморфных формах, т. е. в асимметрических формах, относящихся друг к другу (так же, как и сами стереоизомерные молекулы), как предмет к зеркальному изображению (рис. 4). Плоскость а находится у одного кристалла справа, а у другого слева, и их нельзя совместить никаким вращением (это же справедливо и относительно плоскости b). Вторым важным свойством таких изомеров является их способность в жидком, газообразном состоянии и в растворах вращать плоскость поляризации света. Угол вращения плоскости поляризации для обоих изомеров одинаков, но направление вращения противоположное. Если один изомер вращает плоскость поляризации вправо, то второй вращает ее на такой же угол влево (при равной толщине слоя и одинаковой концентрации). Изомеры этого рода поэтому называются оптическими изомерами или оптическими антиподами, а сама изомерия носит название оптической изомерии. Если смешать в жидком состоянии или в растворе равные количества обоих антиподов, то получится смесь, не вращающая вовсе плоскости поляризации, или оптически недеятельная (так как насколько одна из активных форм вращает плоскость поляризации вправо, настолько другая — влево). При кристаллизации этой смеси каждое вещество, согласно общему правилу, должно было бы кристаллизоваться отдельно, в присущей ему кристаллической форме. Однако последнее явление наблюдается сравнительно редко. В этих редких случаях при исследовании отдельных кристаллов обнаруживается присутствие правых и левых энантиоморфных форм, и так как большая часть их физических свойств тождественна, то и смесь кристаллов обладает рядом общих для обеих форм физических свойств, как, например, одинаковой плотностью, растворимостью и др. В большинстве же случаев активные формы обладают способностью вступать друг с другом в определенное молекулярное химическое соединение, содержащее оба антипода в отношении молекула на молекулу. Эти соединения антиподов, напоминающие своей непрочностью кристаллизационные соединения, носят название рацемических соединений. Как всякое молекулярное соединение, рацемическое соединение отличается всеми физическими свойствами от составляющих его веществ. Прежде всего, оно кристаллизуется в формах, отличных от форм активных сте-реоизомеров. Температура плавления, плотность и прочие подобные физические свойства рацемического соединения совершенно отличны от соответствующих свойств правого и левого изомеров. Таким образом, при наличии в молекуле асимметрического атома углерода, кроме структурной изомерии, возможна еще и пространственная изомерия, или стереоизомерия. При наличии в молекуле лишь одного асимметрического атома углерода возможно существование двух стереоизомеров, являющихся оптическими антиподами. В случае присутствия двух или более асимметрических атомов углерода число стереоизомеров возрастает (при наличии п асимметрических атомов углерода в общем случае число оптически деятельных стереоизомеров равняется 2n). Если молекула по своему строению обладает отдельными элементами симметрии, то число стереоизомеров уменьшается, причем появляются стереоизомеры, действительно оптически недеятельные, т. е. не состоящие из молекул оптических антиподов. Оптическая изомерия представляет собой только одну из разновидностей пространственной изомерии. Существуют некоторые разновидности пространственной изомерии, не связанные с наличием несовместимого зеркального расположения атомов в молекуле. Это, например, так называемая геометрическая, или цис-транс-изомерия, непредельных и циклических органических соединений, которая обусловлена различным расположением заместителей у углеродных атомов относительно двойной связи или плоскости кольца, например:
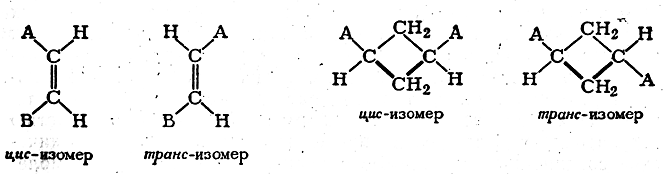
Легко видеть, что такого рода стереоизомеры не относятся друг к другу, как предмет к своему зеркальному изображению. Расстояния между заместителями у транс-изомеров всегда иные, чем у цис-изомеров. Отличия в строении цис- и транс-изомеров больше, чем в строении оптических антиподов. Вследствие этого цис-и транс-изомеры существенно различаются как по физическим, так и по химическим свойствам. У циклических соединений геометрическая и оптическая изомерия зачастую встречается одновременно, например:

Пространственная изомерия, как оптическая, так и геометрическая, встречается не только у соединений углерода, но и у соединений некоторых других . многовалентных элементов (азот, кремний, олово, сера, селен, теллур и др.). Таким образом, из стереохимической теории вытекает, что не всегда достаточно установить последовательность связи атомов в молекуле, чтобы признать строение вещества полностью выясненным. При некоторых особенностях строения молекулы, кроме последовательности связи атомов, необходимо установить и их пространственное расположение, т. е. конфигурацию молекулы.Способы установления конфигурации молекулы будут рассмотрены после более подробного ознакомления со свойствами некоторых классов органических веществ.Согласно представлениям классической стереохимии, вокруг простых связей возможно вращение частей молекул. Следовательно, вотличие от дихлор-зтилена СНСl=СНСl, для которого возможны цис- и транс-изомеры

дихлорэтан СН2Сl—СН2Сl не должен иметь изомеров, обусловленных различным углом поворота групп СН2Cl вокруг углерод-углеродной связи. Действительно, обычными химическими методами не удается ни выделить, ни обнаружить изомеров такого типа, за исключением некоторых специальных случаев. Однако подробное изучение физических свойств веществ (дипольные моменты, оптические свойства, термодинамические характеристики) показывает, что внутреннее вращение в молекулах вокруг простых связей обычно является не свободным, а заторможенным: повороты вокруг простых связей требуют определенной затраты энергии. Это обстоятельство и обусловливает возможность существования молекул в виде энергетически неравноценных форм, переходящих друг в друга только за счет свободного вращения иобычно называемых конформациями. На рис. 5 приведено изменение потенциальной энергии внутреннего вращения в молекуле дихлорэтана. Можно видеть, что по мере поворота групп СН2Сl вокруг оси углерод-углеродной связи энергетическая кривая проходит через минимумы и максимумы. Минимумы энергии отвечают термодинамически наиболее устойчивым конформациям (поворотным изомерам).
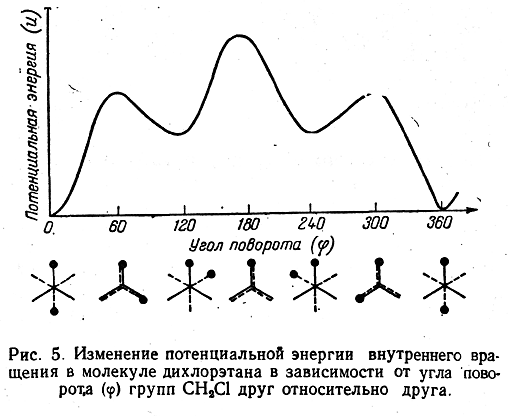
Таким образом, дихлорэтан представляет собой, динамичную смесь трех конформаций: наиболее устойчивой заторможенной, или транс-конформации (φ = 0° и 360°), и двух так называемых скошенных конформаций (φ = 120° и 240°), которые обладают одинаковой энергией:
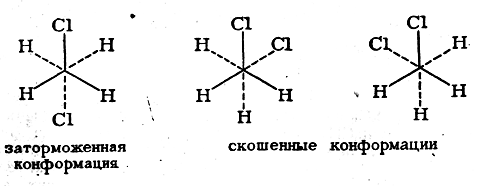
При обычных температурах преобладает более устойчивая затормоная конформация. Она может превращаться в менее устойчивые скошенные при затрате определенной энергии, например при нагревании вещества. Поэтому при повышении температуры содержание скошенных конформаций возрастает (о чем, например, свидетельствует возрастние дипольного момента дихлорэтана сповышением температуры).При достаточно низких температурах молекулы, обладающие различной конформацией, теряют возможность превращаться друг в друга. Известны случай настолько заторможенного вращения вокруг простой связи С—С, что по воротные изомеры удается изолировать в индивидуальном состоянии и при обыч
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|