
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Автономная некоммерческая профессиональная образовательная организация
Автономная некоммерческая профессиональная образовательная организация
НИЖЕГОРОДСКИЙ КОЛЛЕДЖ ТЕПЛОСНАБЖЕНИЯ
И АВТОМАТИЧЕСКИХ СИСТЕМ УПРАВЛЕНИЯ
Реферат
по дисциплине: "Химия"
Тема: Современная теория химического строения.
Выполнил студент: Дюдин О.В.
Группа: СБЗ-2
Специальность:
Преподаватель:
Оценка: ________________
Нижний Новгород
СОДЕРЖАНИЕ
1.Введение……………………………………………………………………………...…….…2 2.Теория химического строения……………………………………………………….........…4 3.Современные представления о теории химического строения……………….…….....38 4.Заключение……………………………………………………………..…………...………40. 5.Список литературы…………………………………………………………………….…....42
Введение
К шестидесятым годам прошлого столетия в органической химии накопился огромный фактический материал, который требовал объяснения. На фоне беспрерывного накопления экспериментальных фактов особенно остро проявлялась недостаточность теоретических представлений органической химии. Теория отставала от практики, от эксперимента. Такое отставание болезненно отражалось на ходе экспериментальных исследований в лабораториях; химики проводили свои исследования значительной мере наугад, вслепую, зачастую не понимая природы синтезированных ими веществ и сути реакций, которые приводили к их образованию. Так, например, англичанин В. Перкин старш., синтезировавший в1856 г. краситель мовеин окислением нечистого анилина, совершенно не представлял себе механизма открытой им реакции; к тому же он вовсе не ставил перед собой задачу синтеза красителя, а пытался получить хинин. Органическая химия, по меткому выражению Вёлера, напоминала дремучий лес, полный чудесных вещей, огромную чашу до конца. Насущные задачи органической химии требовали разрешения основного вопроса: являются ли молекулы беспорядочным нагромождением атомов, удерживаемых силами притяжения, или же молекулы представляют собой частицы с определенным строением, которое можно установить, исследуя свойства вещества. Теория типов Жерара, с теми или иными оговорками признававшаяся большинством химиков того времени, отказывалась на основании изучения химических свойств решать вопрос о строении молекул. А между тем в органической химии к этому времени уже накопились факты и обобщения, которые могли служить основой для решения этого вопроса. Так, например, теория радикалов дала органической химии чрезвычайно важное обобщение, заключавшееся в том, что при химических реакциях некоторые группы атомов в неизменном виде переходят из молекул исходных веществ в молекулы, образующиеся при этих реакциях. Теория типов, со своей стороны, в значительной мере способствовала изучению наиболее изменчивых частей молекул и причины их изменчивости. Теория химического строения — учение о строении молекулы, описывающее все те её характеристики, которые в своей совокупности определяют химическое поведение (реакционную способность) данной молекулы. Сюда относятся: природа атомов, образующих молекулу, их валентное состояние, порядок и характер химической связи между ними, пространственное их расположение, характерное распределение электронной плотности, характер электронной поляризуемости электронного облака молекулы. Основные положения теории химического строения, являющейся фундаментом химии, были развиты русским химиком Бутлеровым. А.М.Бутлеров родился 15 сентября 1828 г.,г. Чистополь, Казанская губерния, Российская империя. Русский химик, создатель теории химического строения органических веществ, родоначальник «бутлеровской школы» русских химиков, учёный-пчеловод и лепидоптеролог, общественный деятель, ректор Императорского Казанского университета в 1860-1863 годах.Умер 5 августа 1886 г.Бутлеров определял понятие химического строения так: «Исходя от мысли, что каждый химический атом, входящий в состав тела, принимает участие в образовании этого последнего и действует здесь определённым количеством принадлежащей ему химической силы (сродства), я называю химическим строением распределение действия этой силы, вследствие которой химические атомы, посредственно или непосредственно влияя друг на друга, соединяются в химическую частицу».
Теория химического строения. Исследуя состав металлоорганических соединений, Франкланд (1853) нашел, что каждый металл дает соединения со строго определенным числом радикалов; это число и представляет собой валентность данного металла. Ниже приведены простейшие металлоорганические соединения одного,- двух,- трех- и четырехвалентных металлов. 
После открытия Франкланда стало ясно, что атомы могут соединяться в молекулы только в отношениях, определяемых валентностью атомов. В частности, было установлено, что углерод четырехвалентен (Кекуле, Кольбе)Открытие валентности непосредственно подводило к мысли, что молекулы имеют определенное строение. Однако вопросы о путях установления строения молекул, а также о зависимости свойств вещества от строения его молекул оставались открытыми. Новая эпоха в органической химии наступила с возникновением теории химического строения. Главная роль в создании, обосновании и подтверждении теории строения принадлежит знаменитому русскому ученому Александру Михайловичу Бутлерову , хотя кроме него элементы этой теории начали разрабатывать А. Купер (1831—1892) в Англии и А. Кекуле (1829— 1896) в Германии. В 1858 г. Купер опубликовал на трех языках (английском, французском и немецком) статью «О новой химической теории», где он отбрасывает теорию типов и высказывает точку зрения, согласно которой все особенности органических веществ могут быть объяснены, если учитывать только два свойства атомов: «избирательное сродство» (связь атомов) и «степень сродства» (валентность атомов). Купер писал: «С моей точки зрения этих двух свойств достаточно для объяснения всего того, что характерно для органической химии: именно это я докажу ниже... В молекуле, состоящей из трех, четырех, пяти и т. д. атомов углерода и эквивалентного количества водорода, кислорода и др., последние могут быть заменены другими элементами, в то время как углерод образует взаимно-связанный узел. Это означает, что один углерод связан с другим углеродом . Такое свойство придает углероду, так сказать, своеобразную физиономию и дает возможность понять непонятный до этого факт наслоения атомов углерода в органических соединениях».
Придя, таким образом, к важному представлению о цепи углеродных атомов, Купер выражает далее свои взгляды в формулах, которые, по его замыслу, должны дать картину строения соединений. В качестве примера его формул, которые были первыми конституционными формулами, можно привести следующие:
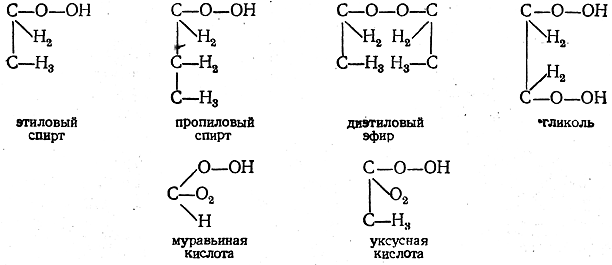
Из этих примеров видно, что Куперу удалось удивительно правильно передать конституцию этих соединений, а также некоторых более сложных и в то время мало исследованных (винная и виноградная кислоты). Однако все эти формулы были лишены опытного обоснования. Купер совершенно не ставил вопроса о возможности их экспериментальной проверки. Его формулы, как легко видеть, были основаны на формальной интерпретации понятий валентности и связи атомов, а отчасти даже на интуиции. Естественно, что при таком подходе невозможно избежать ошибок. Так, например, формулы глицерина, глицериновой кислоты и щавелевой кислоты, данные Купером, уже неверны:
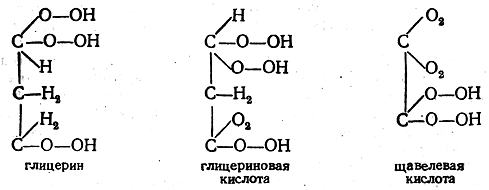
Таким образом, взгляды Купера, развитые им в его талантливой, интересной работе, не носят характера строгой теории. Другая попытка изображения органических соединений конституционными формулами была сделана в 1861 г. Лошмидтом. При построении своих формул Лошмидт рассматривал атомы как мельчайшие материальные частицы, подвергающиеся действию сил притяжения и отталкивания. Эти силы при сближении атомов уравновешиваются, и различные атомы удерживаются друг около друга в некотором равновесном положении. Сферы действия атомных сил Лошмидт условно обозначал кружками (например, атомы углерода и водорода — простыми кружками, кислорода—двойными, азота—тройными). Формулы Лошмидта имели следующий вид:
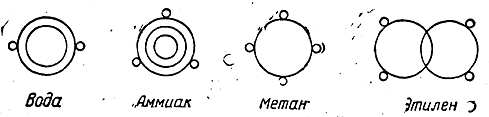
Не пытаясь составить какое-либо представление о способе связи шести углеродных атомов в молекуле бензола, Лошмидт обозначал бензол символом
В отличие от Купера, Лошмидт при выборе формул, кроме валентности («поллентности» по его выражению), иногда руководствовался и химическими свойствами. Однако в целом метод вывода формул Лошмидта был абстрактным, а зачастую просто необоснованным. Так, не опираясь на химические данные, Лошмидт пытался вывести формулы таких сложных веществ, как индиго, мочевая кислота и т. п. Естественно, что эти формулы оказались ошибочными. Несмотря на то, что многие из предложенных Лошмидтом формул органических соединений оказались удачными, работа его осталась почти не замеченной химиками того времени и не оказала сколько-нибудь существенного влияния на развитие теории органической химии. Большой вклад в создание структурной теории внес знаменитый немецкий химик Кекуле . Он установил четырехвалентность углерода, ввел тип метана, предложил известную формулу бензола и, что особенно важно, правильно сформулировал одну из основных задач органической химии того времени.В статье «О конституции и превращениях химических соединений и о химической природе углерода» в 1858 г. Кекуле писал : «Я считаю, что в настоящее время главной задачей химии не является обнаружение атомных групп, которые, вследствие некоторых своих свойств, могут быть рассматриваемы как радикалы, и причисление соединений к некоторым типам, которые едва ли при этом имеют иное значение, кроме как образца формулы. Напротив, я полагаю, что необходимо распространить размышление и на строение самих радикалов; из природы элементов должна быть выведена как природа радикалов, так и их соединений». Исходным пунктом для этого Кекуле считал «основность элемента» (валентность), а в отношении органических соединений прежде всего — природу углерода. Кекуле высказал также ряд других верных мыслей о связи атомов, выражая ее графическими формулами. Однако своим формулам Кекуле не придавал значения формул строения, он стремился выразить ими только реакционную способность. Так, он писал: «Рациональные формулы имеют своей целью дать определенное представление о химической природе соединения, следовательно, о его метаморфозах и отношениях, в которых оно находится к другим телам... При этом, естественно, необходимо иметь в виду, что рациональные формулы — это лишь формулы превращений, а не конституционные формулы, что они являются лишь средством выражения для метаморфоз тел и результатов сравнения различных веществ между собою; что они ни в коем случае не должны выражать конституцию, т. е. расположение атомов в соответствующем соединении».Установление истинного строения молекул Кекуле также считал задачей химии, но, по его мнению, это может быть достигнуто не путем изучения химических превращений, а только сравнительным исследованием физических свойств соединений. Таким образом, и в этом вопросе Кекуле стоял на позиции Же-рара.Как и другие сторонники теории типов, Кекуле изображал вещество несколькими типическими формулами. Так, например, чтобы передать известные тогда химические свойства уксусной кислоты, Кекуле предлагал изображать ее восемью формулами. Таким образом, хотя взгляды Кекуле и были близки к новым структурным воззрениям, хотя Кекуле и внес существенный вклад в развитие теории химического строения, он так и не смог полностью освободиться от представлений теории типов.Ко времени создания А. М. Бутлеровым теории химического строения органических веществ (1861 г.) были известны многие десятки и сотни тысяч органических соединений. Возникновение органической химии как самостоятельной науки можно отнести к 1807 г., когда известный шведский химик Й. Берцелиус впервые ввел термины «органическая химия» и «органические вещества». До этого времени вещества классифицировали по источнику их получения и поэтому еще в XVIII в. различали три химии: «растительную», «животную» и «минеральную».В конце XVIII в. французский химик А. Лавуазье показал, что вещества, получаемые из организмов растений и животных (отсюда их название — органические вещества), содержат, в отличие от минеральных, лишь немногие элементы: углерод, водород, кислород, азот, а иногда фосфор и серу. Так как углерод обязательно присутствует во всех органических соединениях, то органическую химию по предложению А. Кекуле с середины XIX в. стали называть химией соединений углерода. Позднее немецкий химик К. Шорлеммер дал более точное определение этой науки: органическая химия — это химия углеводородов и их производных (то есть соединений, которые могут быть получены на основе углеводородов).Введение Й. Берцелиусом в 1830 г. термина «изомерия» для явления существования веществ одинакового состава, обладающих различными свойствами.Успехи в синтезе органических соединений, в результате которых было развеяно учение о витализме, то есть о «жизненной силе», под влиянием которой якобы в организме живых существ образуются органические вещества:
• в 1828 г. Ф. Велер из неорганического вещества (цианата аммония) синтезировал мочевину;
• в 1842 г. русский химик Н. Н. Зинин получил анилин;
• в 1845 г. немецкий химик А. Кольбе синтезировал уксусную кислоту;
• в 1854 г. французский химик М. Бертло синтезировал жиры, и, наконец,
• в 1861 г. сам А. М. Бутлеров синтезировал сахароподобное вещество.
В середине XVIII в. химия становится более строгой наукой. В результате работ Э. Франкланда и А. Кекуле утвердилось понятие о валентности атомов химических элементов. Кекуле развил представление о четырехвалентности углерода. Благодаря трудам Канниццаро четче стали понятия об атомных и молекулярных массах, уточнены их значения и способы определения. В 1860 г. более 140 ведущих химиков из разных стран Европы собрались на международный конгресс в г. Карлсруэ. Конгресс стал очень важным событием в истории химии: были обобщены успехи науки и подготовлены условия для нового этапа в развитии органической химии — появления теории химического строения органических веществ А. М. Бутлерова (1861 г.), а также для фундаментального открытия Д. И. Менделеева — Периодического закона и системы химических элементов (1869 г.). В 1861 г. А. М. Бутлеров выступил на съезде врачей и естествоиспытателей в г. Шпейере с докладом «О химическом строении тел». В нем он изложил основы разработанной им теории химического строения органических соединений. Под химическим строением ученый понимал порядок соединения атомов в молекулах. А. М. Бутлерова отличали энциклопедичность химических знаний, умение анализировать и обобщать факты, прогнозировать. Он предсказал существование изомера бутана, а затем получил его, равно как изомер бутилена — изобутилен.
А. М. Бутлеров выступил против положения теории типов о невозможности установления строения молекул химическим путем; он показал, что в молекуле имеется определенная последовательность химической связи атомов (химическое строение) . Далее Бутлеров доказал, что строение молекулы можно установить, исследуя химические свойства вещества, и, наоборот, зная строение, можно предвидеть многие свойства соединения. Бутлеров не только обосновал это положение уже имевшимся фактическим материалом, но и предсказал на его основе возможность существования новых веществ, которые впоследствии были открыты им и другими химиками. Основная идея теории А. М. Бутлерова сформулирована им в 1861 г. в статье «О химическом строении веществ». Он писал: «Исходя от мысли, что каждый химический атом, входящий в состав тела, принимает участие в образовании этого последнего и действует здесь определенным количеством принадлежащей ему химической силы (сродства), я называю химическим строением распределение действия этой силы, вследствие которого химические атомы, посредственно или непосредственно влияя друг на друга, соединяются в химическую частицу». Основой теории Бутлерова является идея о порядке химического взаимодействия атомов в молекуле. Этот порядок химического взаимодействия не включает представления о механизме химической связи и физическом расположении атомов. Эта важная особенность теории химического строения позволяет всегда опираться на нее при построении физической модели молекулы. Установив понятие химического строения, А. М. Бутлеров дает новое определение природы вещества : «химическая натура сложной частицы определяется натурой элементарных составных частей, количеством их и химическим строением ». Таким образом, А. М. Бутлеров первый установил, что каждая молекула имеет определенное химическое строение, что строение определяет свойства вещества и что, изучая химические превращения вещества, можно установить его строение. Теория химического строения объясняет многообразие органических соединений. Оно обусловлено способностью четырехвалентного углерода образовывать углеродные цепи и кольца, соединяться с атомами других элементов и наличием изомерии химического строения органических соединений
Эта теория заложила научные основы органической химии и объяснила ее важнейшие закономерности. Основные принципы своей теории А.М. Бутлеров изложил в докладе «О теории химического строения».
Основные положения теории строения сводятся к следующему:
1) в молекулах атомы соединены друг с другом в определенной последовательности в соответствии с их валентностью. Порядок связи атомов называется химическим строением;
2) свойства вещества зависят не только от того, какие атомы и в каком количестве входят в состав его молекулы, но и от того, в каком порядке они соединены между собой, т. е. от химического строения молекулы;
3) атомы или группы атомов, образовавшие молекулу, взаимно влияют друг на друга.
В теории химического строения большое внимание уделяется взаимному влиянию атомов и групп атомов в молекуле. Химические формулы, в которых изображен порядок соединения атомов в молекулах, называются структурными формулами или формулами строения.
Значение теории химического строения А.М. Бутлерова:
1) является важнейшей частью теоретического фундамента органической химии;
2) по значимости ее можно сопоставить с Периодической системой элементов Д.И. Менделеева;
3) она дала возможность систематизировать огромный практический материал;
4) дала возможность заранее предсказать существование новых веществ, а также указать пути их получения.
Теория химического строения служит руководящей основой во всех исследованиях по органической химии.
Взгляды А. М. Бутлерова на значение химических структурных формул вытекают из основных положений его теории. Бутлеров считал, что эти формулы должны быть не «типическими», «реакционными», а конституционными. В этом смысле для каждого вещества возможна лишь одна рациональная формула, на основании которой можно судить о химических свойствах. Что же касается способа написания структурных формул, то Бутлеров справедливо считал этот вопрос второстепенным: «Помня, что дело не в форме, а в сущности, в понятии, в идее,— и принимая во внимание, что формулами, обозначающими изомерию, логически-необходимо выражать настоящее частицы, т. е. некоторые химические отношения, в ней существующие,— не трудно прийти к убеждению, что всякий способ писания может быть хорош, лишь бы только он с удобством выражал эти отношения. Весьма естественно даже употреблять разные способы, предпочитая тот, который является более выразительным для данного случая. Например, этан С2Н6 почти совершенно безразлично может быть изображен:
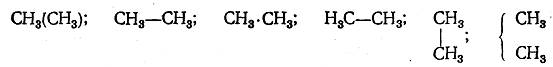
...Однако же, при недостаточно-определенном понимании, иной способ писания может привести к недоумениям».
С возникновением теории химического строения органическая химия вышла из лабиринта типических формул; были показаны пути к познанию внутреннего строения молекул; появилась теоретическая основа для понимания химических процессов, для предсказания новых путей синтеза органических соединений. С самого момента своего возникновения теория химического строения дала возможность химикам проводить экспериментальные исследования направленно, целеустремленно. Замечательным успехом теории химического строения явилось объяснение явления изомерии, открытого в первой четверти прошлого столетия. Как известно, в конце XVIII века был установлен закон постоянства состава, согласно которому каждое данное вещество имеет определенный, постоянный состав. В течение нескольких десятков лет этому закону придавалось и обратное значение, т. е. считалось, что данным определенным составом обладает лишь одно определенное вещество. Неправильность последнего положения была показана в результате исследования ряда органических веществ. В 1823 г. Либих, исследовав серебряную соль гремучей кислоты, установил, что ее состав (AgCNO) тождествен составу полученного в 1822 г. Вёлером и резко отличного от нее изоциановокислого серебра. Этот замечательный факт недолго оставался единичным; вскоре были обнаружены многие другие вещества, обладающие одинаковым составом, но разными свойствами. Открытое явление с 1830 г. начали называть изомерией (от греч. — составленный из одинаковых частей), а вещества с одинаковым составом — изомерами. Попытки объяснить изомерию теорией радикалов и теорией типов были односторонними (как и сами эти теории), а потому не давали удовлетворительных результатов. Фактически в течение почти четырех десятилетий явление изомерии не находило теоретического объяснения. Такое объяснение стало возможным только после создания теории химического строения, согласно которой природа вещества определяется не только характером и числом атомов, входящих в состав молекулы, но и ее структурой, химическим строением. Отсюда с несомненной очевидностью вытекает возможность существования веществ, имеющих одинаковый состав и молекулярный вес и, тем не менее, совершенно различных вследствие неодинакового химического строения. Таким образом, различие в химическом строении явилось естественным и простым объяснением явления изомерии
Следует отметить, что А. М. Бутлеров открыл и впервые объяснил также явление динамической изомерии , заключающееся в том, что два или несколько изомеров в определенных условиях легко переходят друг в друга (явление это в настоящее время носит название таутомерия). Проблема изомерии в целом явилась серьезным испытанием для бутлеровской теории и была ею блестяще решена. Важной особенностью учения А. М. Бутлерова является то, что он отнюдь не считал молекулу каким-то неподвижным образованием, в котором отдельные атомы связаны в мертвую, безжизненную конструкцию . По этому поводу он писал: «...в настоящее время мы смотрим на химическое соединение не как на что-либо мертвое, неподвижное; мы принимаем, напротив, что оно одарено постоянным движением, заключенным в его самых мельчайших частичках, частные взаимные отношения которых подлежат постоянным переменам, суммируясь при этом в некоторый постоянный средний результат. Мы можем иметь здесь и постоянные изменения в химических частицах, составляющих массу веществ, но все это сводится к известному среднему состоянию самой массы. Словом, вообще мы имеем всегда перед собою состояние известного подвижного равновесия. С этой динамической точки зрения на натуру химического соединения и на химические реакции, мы ясно объясняем такие явления, которые, с прежней точки зрения, были совсем непонятны. Стоит указать, например, на диссоциацию,— на то, как легко мы теперь объясняем обратные реакции и т. п.».
Сформулированные А. М. Бутлеровым ясные, неопровержимые положения теории химического строения в короткий срок обеспечили ей всеобщее признание. Однако вместе с тем появилась тенденция замолчать заслуги А. М. Бутлерова и представить творцами теории строения только Кекуле и Купера. Уже несколько лет спустя после создания теории строения А. М. Бутлерову пришлось выступить в защиту своего приоритета, так как некоторые зарубежные химики, вначале не признававшие и даже не понимавшие его теории, впоследствии пытались приписать честь создания основных положений этой теории себе. Решающую роль А. М. Бутлерова в создании теории химического строения ярко подчеркнул в 1868 г. великий русский ученый Д. И. Менделеев , рекомендуя А. М. Бутлерова в Петербургский университет . Менделеев писал, что Бутлеров «...вновь стремится, путем изучения химических превращений, проникнуть в самую глубь связей, скрепляющих разнородные элементы в одно целое, придает каждому из них прирожденную способность вступать в известное число соединений, а различие свойств приписывает различному способу связи элементов. Никто не проводил этих мыслей столь последовательно, как он, хотя они и проглядывали ранее... Для проведения того же способа воззрения через все классы органических соединений Бутлеров издал в 1864 г. книгу: «Введение к полному изучению органической химии», в прошлом году переведенную на немецкий язык Бутлеров чтениями и увлекательностью идей образовал вокруг себя в Казани школу химиков, работающих в его направлении. Имена Марковникова, Мясникова, Попова, двух Зайцевых, Моргунова и некоторых других успели получить известность по многим открытиям, сделанным преимущественно благодаря самостоятельности бутлерозского направления. Могу лично засвидетельствовать, что такие ученые Франции и Германии, как Вюрц и Кольбе, считают Бутлерова одним из влиятельнейших в наше время двигателей теоретического направления химии». А. М. Бутлеров справедливо считал, что теория химического строения будет развиваться по мере накопления нового фактического материала . Он писал: «...не могу не заметить, что те заключения, к которым ведет принцип химического строения, оказываются в тысячах случаев согласными с фактами. Как во всякой теории, и здесь, конечно, есть недостатки, несовершенства, — встречаются факты, которые не отвечают строго понятию о химическом строении. Разумеется, следует желать в особенности размножения таких именно фактов; факты, не объясняемые существующими теориями, наиболее дороги для науки, от их разработки следует по преимуществу ожидать ее развития в ближайшем будущем»).
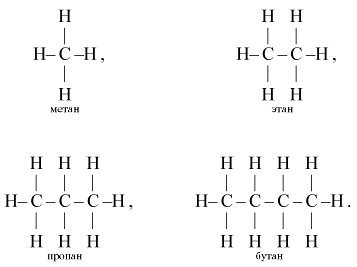
Из учения о валентности вытекает понятие о связи атомов между собой. В органических веществах атомы разных элементов связаны в молекуле непосредственно друг с другом по правилу валентности. Наиболее часто непосредственная связь обозначается черточками, соединяющими буквенные обозначения атомов. Так связь между атомами в молекулах водорода, хлористого водорода, воды, аммиака и метана изображаются следующим образом:

Такое изображение означает, что, например, в молекуле воды каждый атом водорода непосредственно связан с атомом кислорода, но что атомы водорода между собой непосредственно не связаны, аудерживаются в молекуле исключительно благодаря атому кислорода. Связь между атомами водорода в молекуле воды не прямая, а посредственная. Возможность усложнения молекулы благодаря присутствию многовалентных элементов. Атомы одновалентных элементов могут быть непосредственно связаны только с каким-нибудь одним атомом. Атомы же многовалентных элементов могут быть непосредственно связаны с разными атомами. Так, например, если атом трехвалентного азота связан с атомом двухвалентного кислорода, то остальные связи азота икислорода могут быть затрачены на соединение с атомами водорода:
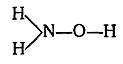
Именно такая последовательность связи атомов имеется всоединении, известном под названием гидроксиламина.В молекуле перекиси водорода Н2О2 два атома кислорода связаны между собой, и каждый из них в свою очередь связан еще с атомом водорода. Последовательность связи атомов в молекуле перекиси водорода, в соответствии с правилами валентности, изображается формулой
H—O—O—H
Аналогичным образом можно представить себе, что между собой связаны два атома углерода. Тогда с этими углеродными атомами могут быть соединены еще шесть атомов водорода (по три атома водорода с каждым углеродным атомом). Строение молекулы С2Н6 в таком случае выразится формулой со следующим порядком связи атомов:
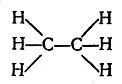
Если далее представить себе ряд из трех атомов углерода, соединенных между собой непосредственной связью, а оставшимися валентностями связанных с атомами водорода, то получится следующий порядок связи атомов в молекуле С3Н8:
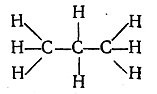
Возможность различия молекул вследствие различной последовательности связи атомов (изомерия). К цепи из. трех атомов углерода четвертый углеродный атом может быть присоединен двояким образом: а) к одному из двух крайних атомов и б) к среднему атому. При последующем присоединении атомов водорода, число которых должно соответствовать четырехвалентности углеродных атомов, возможен не один, а два различных порядка связи атомов в молекулах общей формулы С4Н10:
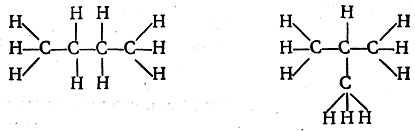
Таким образом, если допустить, что между собой могут быть непосредственно связаны не только разнородные атомы, но и атомы одного и того же элемента, то учение о валентности приводит к заключению, что молекулы, не отличающиеся между собой ни качеством, ни числом входящих в них атомов, могут отличаться порядком связей между атомами. В данном случае следует признать, что эмпирической формулой С4Н10 могут обладать два вещества, имеющие одинаковый качественный и количественный состав, а также одинаковый молекулярный вес, но отличающиеся порядком химической связи атомов в молекулах (химическим строением). Такие два вещества называются изомерными веществами или, кратко изомерцами. Изображенные выше схемы, отражающие порядок химической связи атомов, называются формулами строения или структурными формулами, в отличие от эмпирических формул, показывающих только, какое число атомов каждого элемента входит в молекулу.
Обычно для изображения строения молекул применяют упрощенные структурные формулы, в которых связи с атомами водорода не показывают валентными черточками. Таким образом, строение двух изомерных веществ эмпирической формулы С4Н10 может быть сокращенно выражено следующими формулами:
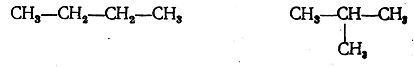
Структурные формулы ряда углеводородов с эмпирическими формулами СН4, С2Н6, С3Н8, С4Н10 могут быть выведены с помощью следующего приема рассуждения. Если мы представим себе, что от молекулы метана СН4 отнят один атом водорода, то останется остаток, или радикал, метил —СН3, способный вступать в связь с одним атомом водорода или каким-либо иным одновалентным атомом, и, следовательно, его можно назвать одновалентным остатком. Согласно правилам валентности, метил может заместить атом водорода в метане, или, другими словами, два метила могут соединиться вместе, вследствие чего получится молекула структурной формулы СН3—СН3, или эмпирической формулы С2Н6, — молекула этана.В молекуле этана можно отнять атом водорода от любого издвух составляющих эту молекулу радикалов (метилов) и получить новый одноатомный остаток — этил СН3—СН2—. Одноатомный этил можно соединить с одноатомным метилом или, что то же самое, заместить в молекуле этана атом водорода на метил, и тогда получится молекула С3Н8 строения СН3—СН2—СН3, т. е. молекула вещества, называемого пропаном. В молекуле пропана можно отнять атом водорода или от одного из крайних углеродных атомов, или от среднего атома углерода и заместить его на метил. В обоих случаях получится вещество эмпирической формулы С4Н10, но в первом случае молекула будет обладать строением СН3—СН2—СН2—СН3 (бутан), а во втором случае
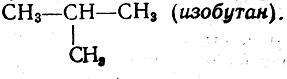
Продолжая рассуждения дальше, мы придем к выводу, что при замещении на метил атомов водорода в молекулах бутана и изобутана получится вещество с эмпирической формулой C5H12 {пептон), причем оказывается возможным существование трех изомеров:
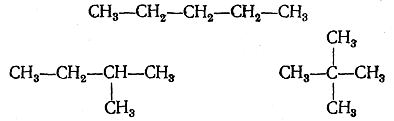
При выводе возможных структурных формул следует иметь в виду, что эти формулы изображают только порядок связи атомов, а не пространственное их расположение и что поэтому формулы
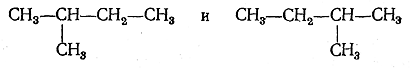
выражают одно и то же строение вещества. Изображения

|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|