
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
pV = const. Ход работы
pV = const
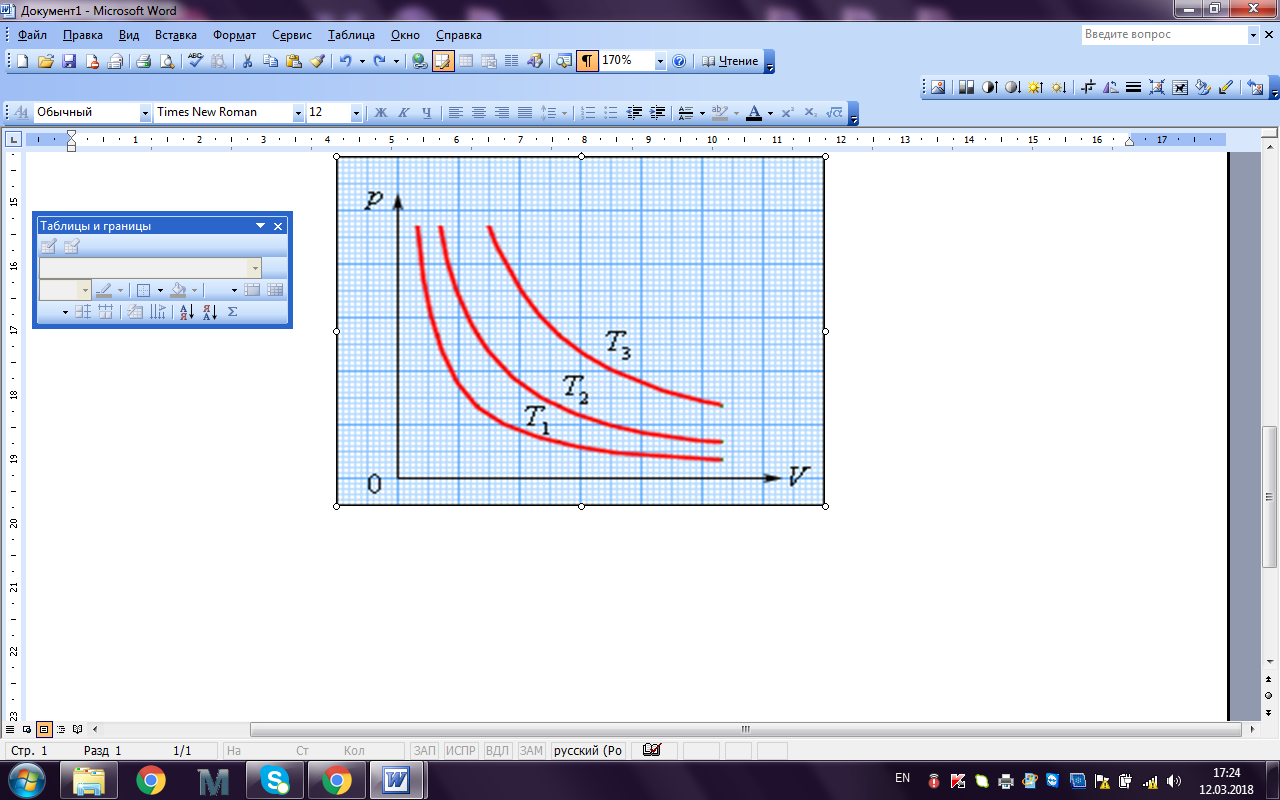
Процесс изменения давления и объема газа при постоянной температуре называется изотермическим процессом.График зависимости давления газа от его объема при изотермическом процессе называется изотермой. На плоскости (P, V) изотермы изображаются при различных значениях температуры T семейством гипербол P ~ 1 / V (рис. 1.1).
Так как коэффициент пропорциональности в этом соотношении увеличивается с ростом температуры, изотермы, соответствующие более высоким значениям температуры, располагаются на графике выше изотерм, соответствующих меньшим значениям температуры.
|
| Рис. 1.1. Семейство изотерм на плоскости (p, V): T3 > T2 > T1 |
Уравнение изотермического процесса, выражающее зависимость давления от объема газа при постоянной температуре было получено из эксперимента английским физиком Р. Бойлем (1662 г.) и независимо французским физиком Э. Мариоттом (1676 г.). Поэтому это уравнение называют законом Бойля–Мариотта
Перейдите по ссылке: http://mediadidaktika.ru/mod/page/view.php?id=356
Ход работы
1. Запустить виртуальный стенд.
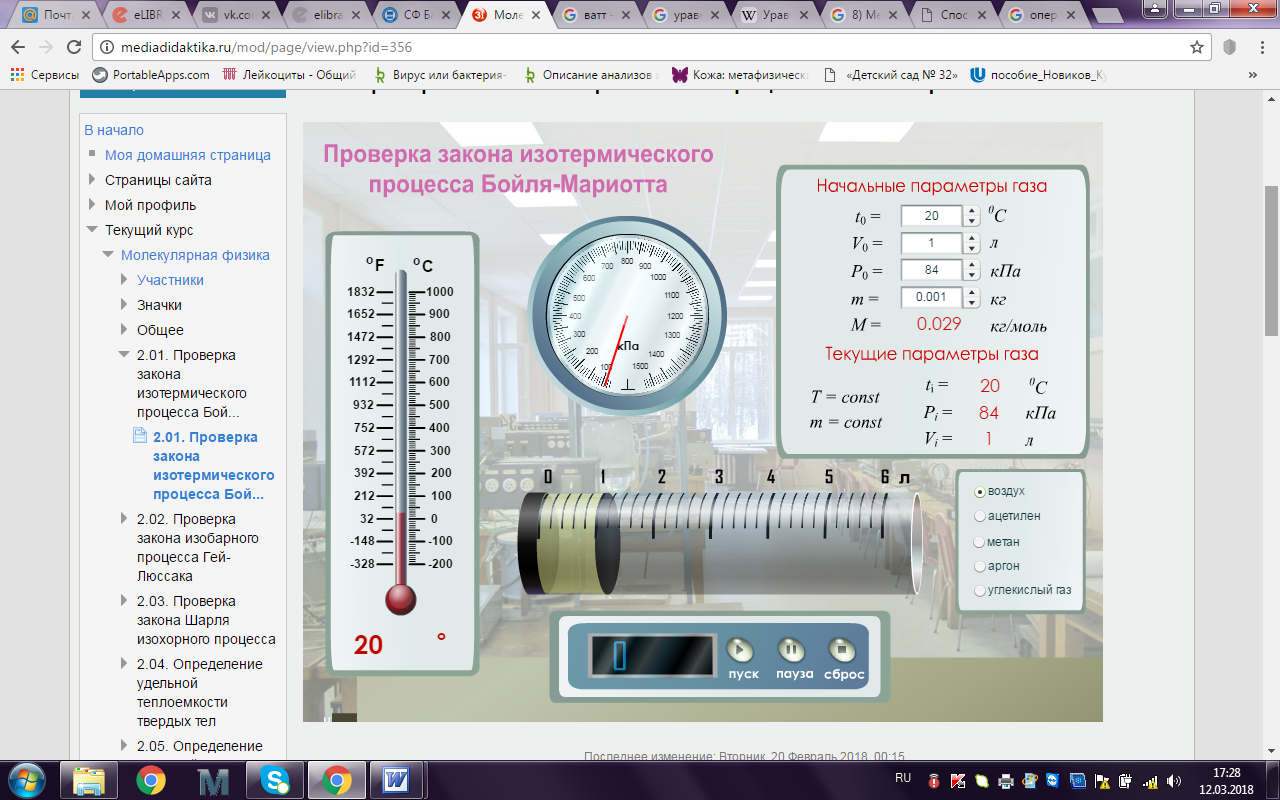
2. Установить начальные параметры газа: давление P0, температуру t0 и объем V0.
3. Выбрать для исследования газ из пяти возможных: воздух, ацетилен, метан, аргон, углекислый газ.
4. Нажать на кнопку «Пуск» для начала изменения объема газа.
5. При достижении кратных величин останавливать процесс кнопкой «Пауза».
6. Снять показания установившегося объема газа V1 и давления P1 и найти произведение Р1V1.
7. Продолжить процесс, нажав на кнопку «Пуск».
8. Вновь останавливать процесс кнопкой «Пауза».
9. Записать значения конечного объема V2 при увеличении давления P2. Найти произведение Р2V2 и убедиться в их примерном равенстве, т.е. в справедливости закона Бойля‑Мариотта.
10. Определить оценку абсолютной и относительной погрешностей измерения.
11. Данные исследования занести в таблицу.
| №, п/п | газ | М, кг/моль (молярная масса) | m, кг (масса газа) | Начальные показатели (для всех газов можно взять одинаковые) | ||||
| P0, кПа (давление) | V0, л (объем) | t0, °С (температура по Цельсию) | T0, К (температура Кельвина) | 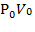 Па× м3
Па× м3
| ||||
|
|
|
|
|
|
|
| ||
| № | газ | Конечные показатели | Р1V1, Па× м3 | Р2V2, Па× м3 | D(PV), Па× м3 | e(PV), % | |||
| Р1, кПа (давление) | V1, л (объем) | Р2, кПа (давление) | V2, л (объем) | ||||||
| воздух | |||||||||
D(PV)=|Р1V1- Р2V2|=
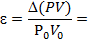
Обратите внимание на единицы измерения: Па× м3=кПа∙л=103Па∙10-3м3 (что фактически исключает ошибку при расчетах)
12. Сформулировать выводы (НЕ копируйте цель работы):
____________________________________________________________________________________________________________________________________
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|