
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Проверка закона изотермического процесса Бойля ‑ Мариотта
4. Проверка закона изотермического процесса Бойля ‑ Мариотта
Компьютерный эксперимент.
Цель работы:экспериментальным путем проверить верность закона Бойля – Мариотта (доказать постоянную PV).
Краткая теория
Для реальных и идеальных газов, уравнение состояния можно описать тремя параметрами P, V, T и получить уравнение состояния идеального газа:
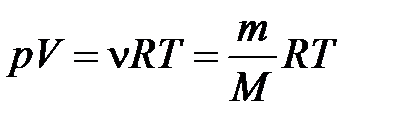 . (1.1)
. (1.1)
Это соотношение может принять такой вид (с учетом для одного моля любого газа):
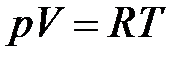 .
.
В 1834 году, физиком Бенуа Поль Эмиль Клапейрон, было открыто уравнение устанавливающее зависимость между давлением, объемом и температурой газа. Это уравнение имеет вид:
pV = (ν1 + ν2 + ν3 + ...)×RT.
В форме (1.1) оно было впервые записано Дмитрием Ивановичем Менделеевым. Поэтому уравнение состояния газа называется уравнением Клапейрона – Менделеева.
Объединенный газовый закон для любой постоянной массы газа (а значит, и для одного моля газа) имеет вид:
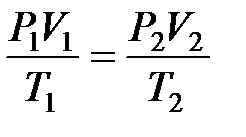 ,
,
или
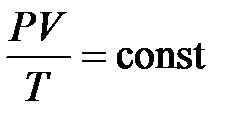 .
.
Необходимо выделить, что задолго до того, как уравнение состояния идеального газа было теоретически получено на основе молекулярно-кинетической модели, закономерности поведения газов в различных условиях были хорошо исследованы опытным путем. Поэтому уравнение  можно рассматривать как обобщение опытных фактов, которые находят объяснение в молекулярно-кинетической теории.
можно рассматривать как обобщение опытных фактов, которые находят объяснение в молекулярно-кинетической теории.
Газ может участвовать в различных тепловых процессах, при которых могут изменяться все параметры, описывающие его состояние (P, V и T). Процессы могут быть изображены на диаграмме состояний (например, в координатах P, V) в виде некоторой траектории, каждая точка которой представляет равновесное состояние.
Интерес представляют процессы, в которых один из параметров (P, V или T) остается неизменным. Такие процессы называются изопроцессами.
Для пояснения приведем пример.
Возьмем цилиндрический сосуд с плотно притертым поршнем. Если, перемещая поршень, изменять объем газа в сосуде то, температура газа тоже будет изменяться, однако если охлаждая сосуд при сжатии газа или нагревая при расширении можно достичь того, что температура будет постоянной при изменениях объема и давления, такой процесс называется изотермическим (Т = const).
Предоставим газу возможность расширяться и производить при этом работу против сил внешнего давления. Это можно осуществить следующим образом. Пусть в большой бутыли находится сжатый воздух, имеющий комнатную температуру. Сообщим бутыль с внешним воздухом, дадим воздуху в бутыли возможность расширяться, выходя из небольшого отверстия наружу, и поместим в струе расширяющегося воздуха термометр. Термометр покажет температуру, заметно более низкую, чем комнатная, а что будет указывать на понижение температуры воздуха в струе.
Следовательно, сжатие газа внешней силой вызывает его нагревание, а расширение газа сопровождается его охлаждением.
Из уравнения PV=νRT состояния идеального газа следует, что при постоянной температуре T и неизменном количестве вещества ν в сосуде произведение давления P газа на его объем V должно оставаться постоянным:
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|