
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Часть 1. (1 балл за каждый правильный результат = 10 баллов).
20.05 Здравствуйте, начинаем урок.
Решение задач на «пластинки».
Ответы. Контрольная работа по теме «Вещества и их свойства»
Вариант 1.
Часть 1. (1 балл за каждый правильный результат = 10 баллов).
| 1 - 412 2 - 15 3 - 14 4 - 43 | 5 - 24 6 - 3214 7 - 412 8 - 14 | 9 - 32 10 - 3434 |
Часть 2.
11. (5 баллов) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения (при написании уравнений реакций используйте структурные формулы органических веществ):
Na дегидроциклизация CH3(CH2)2Cl (AlCl3) KMnO4, H2SO4 Na
бромпропан → Х1 → Х2 → Х3 → Х4 → бензоат натрия
1) СН3 − СН2 − СН2− Br + 2 Na → СН3 – ( СН2)2 – СН3 + NaBr
2) СН3 – ( СН2)2 – СН3 → 4H2 + 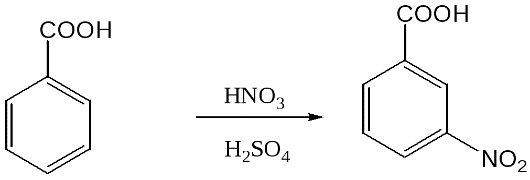
3).

| + CH3− СН2 − СН2Cl → | CH3−СН − СH3

| + H Cl |
-2 -2 -3 +3 +4
4) 5C6H5− СН2 − СН2− СH3+ 18 K MnO4 + 27 H2SO4 → 5 C6H5 − СOOH + 10 CO2+ 9 K2SO4 +
↓ ↓ ↓ ↑ 18 MnSO4 + 42 H2O
5e 6e 7e 5 e
18 e
5) 2 C6H5 – СOOH + 2 Na → 2 C6H5 – СOONa + H2
12. (5 баллов) На 25 г смеси цинка и оксида цинка подействовали 40% - ным раствором гидроксида калия плотностью 1,39 г/мл. Объём выделившегося газа равен 4,48 л (н.у.). Рассчитайте объём исходного раствора гидроксида калия.
Задачу решили правильно, но 2 ученика привели не правильный ответ:
V (КОН) р-ра = 97,5 г/ 1,39 г/мл = 70,1 мл
Вариант 2.
Часть 1. (1 балл за каждый правильный результат = 10 баллов).
| 1 - 321 2 - 35 3 - 23 4 - 13 | 5 - 21 6 - 2431 7 - 341 8 - 34 | 9 - 34 10 - 3354 |
Часть 2.
11. (5 баллов) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения (при написании уравнений реакций используйте структурные формулы органических веществ):
CH3Cl (AlCl3) НNО3 (H2SO4) KMnO4, H2SO4 CH3CH2ОН Н2, кат.
бензол → Х1 → Х2 → Х3 → Х4 → n – NH2–C6H4–COO–C2H5
пара – аминобензойная к - та кислота
| 1.
| + CH3Cl → | СH3
|
+ H Cl
| |||||
| 2. СH3
| + HNO 3 → |
С H3
 NO2
NO2
|
+ H2O
| |||||
| 3. 5 СH3
5 С6Н5 -СН3 |
+ 6 K MnO4 + 9 H2SO4 → 5 |
СOOH
 NO2
NO2
|
+3 K2SO4 + 6 MnSO4 + 14 H2O
| |||||
4.
СOOH

|
+ CH3CH2ОН → |
СOO C2H5
 NO2
NO2
|
+ H2O
| |||||
5.
СOOH

|
+ 3 H2 → |
СOO C2H5
 NH2
NH2
|
+ 2H2O
| |||||
12. (5 баллов) В 250 г 26 % - ной азотной кислоты внесли 15,9 г меди. Определите массовые доли веществ, содержащихся в растворе по окончании реакции. Растворимостью газообразного продукта можно пренебречь.
3 Cu + 8 HNO3 → 3 Cu(NO3)2 +2 NO + 4H2O - уравнение не то, так как NO не растворим в воде.
Уравнение для задачи:
1) Cu + 4 HNO3 → Cu(NO3)2 +2 NO2 + 2H2O ( NO2 растворим в воде п по условию задачи)
1 моль 4 моль 1 моль 2 моль
2) Проведён расчёт по уравнению реакции:
n (HNO3) = m(в - ва)⋅ω / M = 250 ⋅ 0,26 / 63 = 1,03 моль – избыток
n (Cu ) = 15.9 / 64 = 0,25 моль
Cu 0,25 /1 < 1,03/4 HNO3, расчёты по количеству меди
3) n (Cu(NO3)2) = 0,25 моль; m(Cu(NO3)2 ) = 0,25 ⋅ 188 = 47 г
n (HNO3) прореаг. = 1 моль; n (HNO3) ост. = 0,03 моль
m (HNO3) ост. = 0,03 ⋅ 63 = 1,89 г
4) Масса газа и масса раствора после реакции:
n (NO2) = 0,5 моль; m(NO2 ) = 0,5 ⋅ 46 = 23 г
m (раствора ) = 250 = 15,9 - 23 = 242,9 г
5) Массовые доли веществ в растворе после реакции:
ω (НNO3) = 47 / 242,9 ⋅100 % = 19,35 %
ω (Cu(NO3)2) = 1,89 / 242,9 ⋅100 % = 0,78 %
Новый тип задач.
Задача 1.
В раствор нитрата ртути (II) опустили медную пластинку массой 50 г. Через некоторое время пластинку вынули из раствора, промыли, высушили и взвесили. Масса её оказалась 51,37г. Какая масса ртути отложилась на медной пластинке?
| Медь, как более активный металл, растворяется. На поверхности пластинки выделяется слой ртути. Если не проводить процесс до полного растворения | |||
|
|
| меди, пластинка внутри останется медной, а на поверхности будет находиться ртуть. Молярная масса ртути больше, чем меди, поэтому пластинка стала тяжелее. Если выделяется более лёгкий металл, пластинка становится легче. | |
| Cu | |||
| Hg(NO3)2 (р-р) |
Решение:
Составим уравнение реакции:
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|