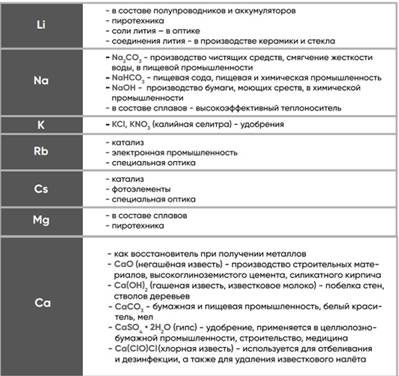
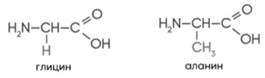- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
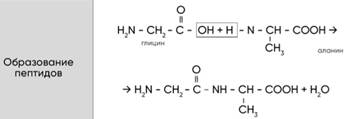
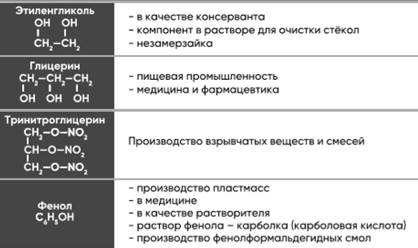
Диссоциация. С кислотными оксидами. С амфотер оскидами(на зад стороне). С кислотами. С амф гидроксид.(на зад стороне). С солями (СОЛЬ РАСТВОРИМА!). C металлами. Разложение. Cr/Al/Fe-ПАССИВИРУЕТ В ХОЛ. HNO3(к) Нагреть нужно!. ХИМИЧЕСКИЕ СВ-ВА. кислотный ги
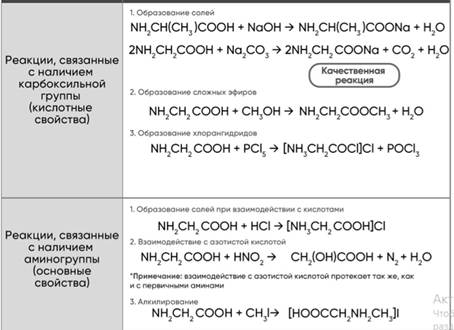
1. Диссоциация
2. С кислотными оксидами
2KOH+CO2(нед)=K2CO3+H2O
NaOH+CO2(изб)=NaHCO3
Ca(OH)2+SO3(изб)=Ca(HSO4)2
3. С амфотер оскидами(на зад стороне)
4. С кислотами
-Средние соли КOH+HNO3=KNO3+H2O
-Кислые соли KOH+H3PO4(изб)=KH2PO4+H2O
5. С амф гидроксид.(на зад стороне)
6. С солями (СОЛЬ РАСТВОРИМА!)
-Средние соли Fe2(SO4)3+6NaOH=3Na2SO4+2Fe(OH)3
- Кислые соли KHSO4+KOH=K2SO4+H2O/ KHSO4+NaOH=K2SO4+Na2SO4+H2O
- C солями ам.солей AlCl3+KOH=Al(OH)3+KCl/Al(OH)3+KOH=K{Al(OH)4}
7. C металлами
Al+H2O+NaOH=Na{Al(OH)4}+H2
8. Разложение
2LiOH=Li2O+H2O





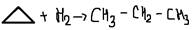 2. Галогенирование
2. Галогенирование
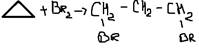
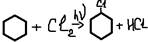 3. Гидрогалогенирование(усл t)
3. Гидрогалогенирование(усл t)
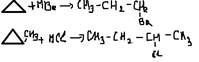 4. Дегидрирование
4. Дегидрирование
 5. Нитрование
5. Нитрование
 5. Изомеризация
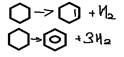
6. Горение-полное окисление
5. Изомеризация
6. Горение-полное окисление
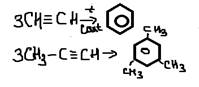 -полимеризация
Кислот. св-ва алкинов
1. с гидридами ЩМ
HC=CH+NaH=NaC=CNa+2H2
2. с амидами ЩМ
HC=C-CH3+NH2Na=CH3-C=CNa+NH3
3. с амиачным рас-ом AgOH и CuCl(кач реакция)
HC=CH+2{Ag(NH3)2}OH=AgC=CAg+4NH3+2H2O
ОКИСЛЕНИЕ АЦЕТИЛЕНА
5HC=CH+8KMnO4+12H2SO4=5HOOC-COOH+8MnSO4+4K2SO4+12H2O
3HC=CH+8KMnO4=3KOOC-COOH+8MnO2+4KOH+2H2O
ЖЕСТКОЕ ОКИСЛЕНИЕ АЛКИНОВ
-полимеризация
Кислот. св-ва алкинов
1. с гидридами ЩМ
HC=CH+NaH=NaC=CNa+2H2
2. с амидами ЩМ
HC=C-CH3+NH2Na=CH3-C=CNa+NH3
3. с амиачным рас-ом AgOH и CuCl(кач реакция)
HC=CH+2{Ag(NH3)2}OH=AgC=CAg+4NH3+2H2O
ОКИСЛЕНИЕ АЦЕТИЛЕНА
5HC=CH+8KMnO4+12H2SO4=5HOOC-COOH+8MnSO4+4K2SO4+12H2O
3HC=CH+8KMnO4=3KOOC-COOH+8MnO2+4KOH+2H2O
ЖЕСТКОЕ ОКИСЛЕНИЕ АЛКИНОВ
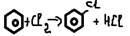
 -нитрование(H2SO4)
-нитрование(H2SO4)
 -алкилирование(kat AlCl3)
-алкилирование(kat AlCl3)
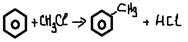 -алкилирование алкенами (kat AlCl3, H+)
-алкилирование алкенами (kat AlCl3, H+)
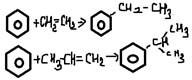
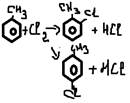
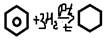 -хлорирование(с Br2 не идет)
Радикальное присоединение
-хлорирование(с Br2 не идет)
Радикальное присоединение
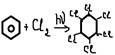 Радикальное замещение
Радикальное замещение
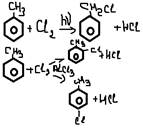 3. замещение в бок цепи (гомологи бензола)
3. замещение в бок цепи (гомологи бензола)
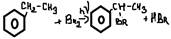 4. окисление (бензол не окисляется!)
5. горение
4. окисление (бензол не окисляется!)
5. горение




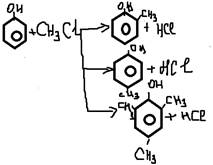
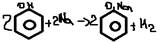 -с щелочами
-с щелочами
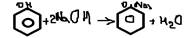 -особенности фенолятов
-особенности фенолятов
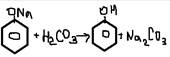 -получение эфиров фенола
-с FeCl3
2. по бензольному кольцу
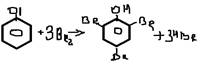
-галогенирование
-получение эфиров фенола
-с FeCl3
2. по бензольному кольцу
-галогенирование
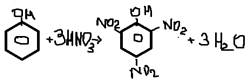
 -нитрование
-нитрование
 -восстановление
-восстановление
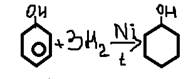
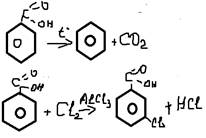
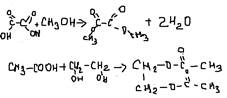 7. галогениды
CH3-COOH+PBr5=CH3-COOBr+POBr3+HBr
3CH3-COOH+PCl3=3CH3-COOCl+H3PO4
8. дегидратпция с P2O5
7. галогениды
CH3-COOH+PBr5=CH3-COOBr+POBr3+HBr
3CH3-COOH+PCl3=3CH3-COOCl+H3PO4
8. дегидратпция с P2O5
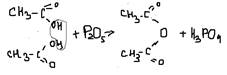 9. с аммиаком
CH3-COOH+NH3=CH3-COONH4=CH3-CONH2+H2O
Замещение в a-положении
10. с хлором( kat Pkp)
CH3-COOH+Cl2=CH2(Cl)-COOH+HCl
9. с аммиаком
CH3-COOH+NH3=CH3-COONH4=CH3-CONH2+H2O
Замещение в a-положении
10. с хлором( kat Pkp)
CH3-COOH+Cl2=CH2(Cl)-COOH+HCl


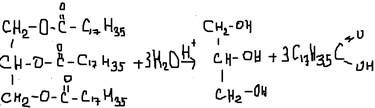
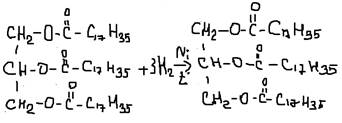
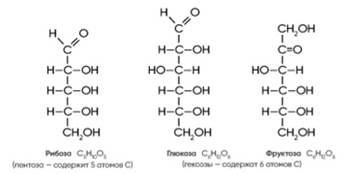 ГЛЮКОЗА-ГЛЮКАЛЬ/ФРУКТОЗА-ФРУКТОН
УГЛЕВОДЫ
ГЛЮКОЗА-ГЛЮКАЛЬ/ФРУКТОЗА-ФРУКТОН
УГЛЕВОДЫ

 ХИМИЧЕСКИЕ СВ-ВА ЦЕЛЛЮЛОЗЫ
1. С HNO3
2. C CH3-COOH
ХИМИЧЕСКИЕ СВ-ВА ЦЕЛЛЮЛОЗЫ
1. С HNO3
2. C CH3-COOH
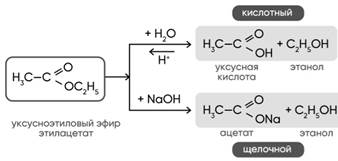
 1. C H2O
СH3-NH2+H2O=[CH3-NH3]OH
CH3-NH-CH3+H2O=[ CH3-NH2-CH3]OH
2. C кис-ми
-мин к-ми
СH3-NH2+HCl=[CH3-NH3]Cl
CH3-N(CH3)-CH3+H2SO4=[CH3-NH(CH3)-CH3]2SO4
-орг к-ми
СH3-NH2+CH3COOH=CH3COO[CH3-NH3]
CH3-N(CH3)-CH3+CH3-CH(CH3)-COOH=CH3-CH(CH3)-COO[CH3-NH(CH3)-CH3]
СОЛИ АМИНОВ
-С щелочами
[CH3-NH2-CH3]Cl+NaOH=NaCl+CH3+NH-CH3+H2O
-С солью
[CH3-NH2-CH3]Cl+AgNO3=[CH3-NH2-CH3]NO3+AgCl
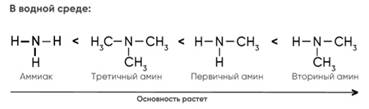
КИСЛОТНОСТЬ АМИНОВ
3. С солями
2СH3-NH2+FeCl2+2H2O=2[CH3-NH3]Cl+Fe(OH)2
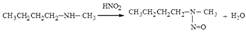
4. C HNO2
-первичные амины-спирты
СH3-NH2+HNO2=CH3OH+N2+H2O
-вторичные амины-нитрозы
1. C H2O
СH3-NH2+H2O=[CH3-NH3]OH
CH3-NH-CH3+H2O=[ CH3-NH2-CH3]OH
2. C кис-ми
-мин к-ми
СH3-NH2+HCl=[CH3-NH3]Cl
CH3-N(CH3)-CH3+H2SO4=[CH3-NH(CH3)-CH3]2SO4
-орг к-ми
СH3-NH2+CH3COOH=CH3COO[CH3-NH3]
CH3-N(CH3)-CH3+CH3-CH(CH3)-COOH=CH3-CH(CH3)-COO[CH3-NH(CH3)-CH3]
СОЛИ АМИНОВ
-С щелочами
[CH3-NH2-CH3]Cl+NaOH=NaCl+CH3+NH-CH3+H2O
-С солью
[CH3-NH2-CH3]Cl+AgNO3=[CH3-NH2-CH3]NO3+AgCl
КИСЛОТНОСТЬ АМИНОВ
3. С солями
2СH3-NH2+FeCl2+2H2O=2[CH3-NH3]Cl+Fe(OH)2
4. C HNO2
-первичные амины-спирты
СH3-NH2+HNO2=CH3OH+N2+H2O
-вторичные амины-нитрозы
 5. Алкилирование
CH3-NH2+CH3Cl=[CH3-NH2-CH3]Cl
6. Горение
5. Алкилирование
CH3-NH2+CH3Cl=[CH3-NH2-CH3]Cl
6. Горение
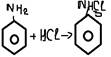 2. Р по бензольному кольцу
-бромирование
2. Р по бензольному кольцу
-бромирование
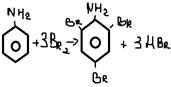 Получение анилина
-Промышленный способ
Получение анилина
-Промышленный способ
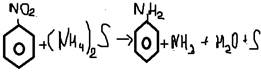
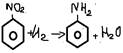 -Лаб способ
-Лаб способ
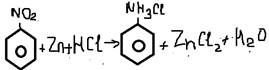
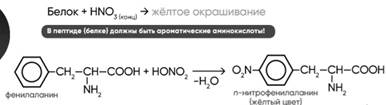
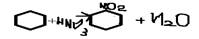
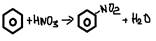
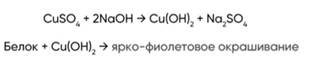 4. +HNO3
4. +HNO3