Щелочи хим св-ва
| НЕОРГАНИКА
| S-элементы: H Li Na K Be Mg Ca He
P-элементы: B Al Ga C Si Ge N P As O S Se F Cl Br Ne Ar Kr
d-элементы: Sc Ti V Cr Mn Fe Co Ni Cu Zn
Проскок электрона- медь и хром
Неспаренные электроны-1-1; 2-0;3-1;4-2;5-3;6-2;7-1;8-0
ВалентностьНЕ равна№группы- азот(N2) , кислород(O2), фтор(F), инертные газы, металлы побочных подгрупп(1 и 8 B)
Атомный радиус увеличивается( книзу, влево)
ЭО увеличивается(вправо, наверх)
Неметалич. св-ва(окислит) увеличиваются( в сторону фтора)
Металл.св-ва(восст) увеличиваются (в сторону франция)
|
| Группа (вниз)
| Период(вправо)
| | Изменение кислот. и основн. Оксидов и гидроксид
| Кислотные св-ва умен, основные св-ва увелич
| Кислотные св-ва увелич, основные умен
| | Изменение кислотных и основных св-в водород соединений
| Кислотные св-ва увелич, основные умен
| Кислотные св-ва увелич, основные умен
| |
| ТИПЫ ХИМ СВЯЗЕЙ/РЕШЕТКИ
| Ковалентная(полярная)-два разных НеМе, ковалентная(неполярная)-два одинак. НеМе
Ионная- Ме+НеМе
Металлическая-Ме
Наиб.поляр связи(ионная и ковалентная поляр(I-Br-Cl-F увелич)
 Кристалл. Решетки-
Молекулярная-тип связи-ковалент; вещ-ва- неор: соединения НеМе(искл Si/C), С60, Р4(белый), I2, лед(H2O), сера(S8- ромбич, моноклин.); орг:все вещ-ва не ионного стр, CH4, CH3COOH, CH3-NH2, HCOH
Св-ва: небольшая твердость и прочность, летучесть, низкая tплав, в узлах решетки-молекулы
Атомная-тип связи-ковалент; вещ-ва- C(алмаз, графит), В, Si. SiO2, SiC,P(черн), Р(крас), BN. B4С
Cв-ва: высокая тверд и прочность, высокие tплав, нерастворим, в узлах-атомы Кристалл. Решетки-
Молекулярная-тип связи-ковалент; вещ-ва- неор: соединения НеМе(искл Si/C), С60, Р4(белый), I2, лед(H2O), сера(S8- ромбич, моноклин.); орг:все вещ-ва не ионного стр, CH4, CH3COOH, CH3-NH2, HCOH
Св-ва: небольшая твердость и прочность, летучесть, низкая tплав, в узлах решетки-молекулы
Атомная-тип связи-ковалент; вещ-ва- C(алмаз, графит), В, Si. SiO2, SiC,P(черн), Р(крас), BN. B4С
Cв-ва: высокая тверд и прочность, высокие tплав, нерастворим, в узлах-атомы
|
| РЕШЕТКИ
| Ионная-тип связи-ионн; вещ-ва- все соли аммония, и тд
Св-ва: прочность и тверд ниже, чем у атом, высокие tплав, слабая летучесть, расплавы и растворы проводят эл ток, хорошо растворим в поляр растворителях, хрупкость, в узлах-ионы
Металлическая- тип связи-метал; вещ-ва-Ме и сплавы Ме
Св-ва: высокая теплопровод и электропровод, пластичность, ковкость, мет.блеск, непрозрачность
Донорно-акцепторный механизм- СО, HNO3, NH4
Водородная связь-H2O, HF, NH3(нужен атом H соединенный с О, F, N)
Длина связи- 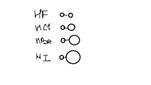 Высшая валентность=№группы, низшая=8-№группы
Высшая валентность=№группы, низшая=8-№группы
|
| Оксиды
| | Оксиды- несолеобразующиеNO/N2O/SiO/CO; солеобразующие: основные(СО +1,+2,+3,+4); амфотерные(СО +2,+3,+4) BeO/ZnO/SnO/PbO, Cr2O3/Fe2O3/Al2O3, SnO2/PbO2/MnO2/TiO2; кислотные(СО +5 и выше) неМе: Сl2O7/ SiO2/SO3; Ме в СО>+5: Mn2O7/CrO3
NO2 распадается на HNO2 и HNO3
Взаимодействие обычных оксидов:
1. С H2O ЩМ/ЩЗМ оксиды и кислотные оксиды (Кроме амфотерных оксидов и SiO3) (LiO2/Na2O/K2O/Rb2O/Cs2O/CaO/SrO/BaO)
2. С оксидами(нерастворим+СO2, Al2O3+CO2=не идет)
3. С гидроксидами
4. С кислородом
Взаимодействие несолеобр. оксидов:
1.NO+C=N2+CO
NO+P=N2+P2O5
2. N2O=N2+O2
N2O+S=N2+SO2
3. CO+Fe3O4=FE+CO2
CO+H2=CH3OH
CO+H2=CH4+H2O
CO+Cl2=COCl2
Взаимодействие пероксидов(H2O2) и надпероксидов(KO2)
1. С H2O
2. с кислотами
3. разложение KO2=K2O2+O2
Св-ва основ. оксидов
1. Водородотермия (ЭХР после Mn)
CuO+H2=Cu+H2O
Fe2O3+H2=FeO+Fe2O3+H2O
2. Алюминотермия (правее Аl)
HgO+Al=Al2O3+Hg
3. Восстановление СО
FeO+CO=Fe+CO2
4. Восстановление С
Fe2O3+C=Fe+CO2/CO
| | Оксиды 2
| | Специфические св-ва
1. 2HgO=2Hg+O2
2. CuO+NH3=Cu+N2+H2O
CuO+Cu=Cu2O
CuO+ H2=Cu+H2O
CuO+ 2HCl=CuCl2+H2O
Св-ва кислот. оксидов
1. с солями(вытеснение более летучего из соли)
Na2CO3+SiO3=Na2SiO3+CO2
Специфические св-ва
1. СO2
CO2+Mg=MgO+C
CO2+2Na2O2=2Na2CO3+O2
2. NO2
NO2+H2O=HNO3+HNO2
NO2+KOH=KNO2+KNO3+H2O
NO2+H2O+O2=HNO3
3.SiO2
SiO2+HF=SiF4+H2O
SiO2+C=SiO+CO
SiO2+Mg=Si+MgO
Св-ва амфотер. оксидов
1. c солями(вытеснение более летуч из соли)
Na2CO3+Al2O3=NaAlO3+CO2
2. водородотермия
Fe2O3+H2=Fe+H2O
3.алюминотермия
PbO+Al=Al2O3+Pb
4. восстановление С
Fe2O3+C=Fe+CO/CO2
5.восстановление CO
Fe2O3+CO=Fe+CO2
|
| РЕАКЦИИ С H2O
| | Zn+H2O=ZnO+H2
Fe+H2O=Fe3O4+H2
Na3N+H2O=NaOH+NH3
Na3P+H2O=PH3+NaOH
Na4F+H2O=SiH4+NaOH
CaC2+H2O=Ca(OH)2+C2H2
Al4C3+H2O=Al(OH)3+CH4
Na2S+H2O= NaOH+H2S
NaH+ H2O=NaOH+H2
PCl5+H2O=HCl+H3PO4
PCl3+H2O=HCl+H3PO3
SOCl2+H2O=2HCl+SO2
| | Тривиальные названия
| | Na3{AlF6}-криолит
SiO2-кремнезём, кварц
FeS2-пирит, железный колчедан
CaSO4*2H2O-гипс
CaC2-4карбил кальция
Al4C3-карбид Аl Al2O3-глинозем
KOH-едкий калий
NaOH- едкий натр, каустическая сода
H2O2-перикись водорода
CuSO4*5H2O-медный купорос
Cu2S-медный купорос
NaNO3-натриевая селитра
KNO3-калиевая селитра
NH4NO3-амиачная селитра
NH4Cl-нашатырь
FeCl3 хлорное железо FeCl2-хлористое
PbS-свинцовый блеск ZnS-цинковая обманка
CaCO3-мел, мрамор, известняк
CaOCl2-хлористая известь
NaHCO3-пищевая сода
Na2SO4*10H2O-глауберова соль
N2O-веселящий газ
NO2-бурый газ
| SO2-сернистый газ
SO3-серный
CO-угарныйгаз
Fe3O4-железная окалина
NH3*H2O-нашатырный спирт
BaSO4-барит
CaCO3*MgCO3-доломит
CO2-углекислый газ
SiC-карборунд
PH3-фосфин
SiH4-силан
NH3-аммиак
KClO3-бертолетова соль, хлорат калия
Cu2(OH)2CO3-малахит
CaO-негашёная известь
Ca(OH)2- гашеная известь
Прозрач водн. Раств Ca(OH)2-известковая вода
Взвесь тв. Са(OH)2 в его в водн раст-известковое молоко
K2CO3-поташ
Na2CO3-кальцинированная сода
Na2CO3*10H2O-кристаллическая сода
MgO-жженная магнезия
| |
| Осадки
| | KMnO4-розовый
MnO2-бурый
K2MnO4-темно-зеленый раствор
Mn-бледно-розовый раст
Mn(OH)2-бело-розовый
Cr2O7-оранжевый раствор
CrO4-желтый раствор
Cr2+-голубой раств
Сr3+-зеленый раств
Сr2O3-зеленый порошок
CrO3-красный порошок
{Cr(OH)3}3+-зеленый раствор
Fe3+-желтый раствор
Fe(OH)3-бурый осадок
Fe(OH)2-серо-зеленый
Сr(OH)3-cеро-зеленый осадок
| Cu2O-красный порошок
CuO- черный осадок
СuS-черный осадок
Сu2+-голубой раствор
Cu(OH)2-голубой осадок
AgCl-творожисто белый
AgBr-светло-желтый
AgI-желтый осадок
Ag2O-коричневый осадок
Ag2S-черный осадок
NO2-бурый газ
NO-бесцветный газ
Cl2-желто-зеленый газ
Br2-красно-бурая жидкость
I2-фиолетово-черные кристаллы с мет блеском
S-желтый порошок
| | | ОВР
| | C бихроматом
K2Cr2O7+3H2S+4H2SO4=Cr2(SO4)3+3S+K2SO4+7H2O
K2Cr2O7+3NaNO2+4H2SO4=3NaNO3+ Cr2(SO4)3+ K2SO4+4H2O
K2Cr2O7+6KI+7H2SO4=3I2+ Cr2(SO4)3+ 4K2SO4+7H2O
K2Cr2O7+2Al+7H2SO4=Al2(SO4)3+ Cr2(SO4)3+ K2SO4+7H2O
K2Cr2O7+14HCl=3Cl2+2CrCl3+2KCl+7H2O
K2Cr2O7+3NaNO2+4H2SO4=3naNO3+ Cr2(SO4)3+ K2SO4+4H2O
K2Cr2O7+3NaSO3+4H2O=2Cr(OH)3+3Na2SO4+2KOH
K2Cr2O7+3KNO2+8HNO3=5KNO3+2Cr(NO3)3+4H2O
K2Cr2O7+3SO2+H2SO4= Cr2(SO4)3+ K2SO4+H2O
K2Cr2O7+14HBr=2CrBr3+3Br2+2KBr+7H2O
K2Cr2O7+6FeSO4+7H2SO4=Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O
С оксидами
SO2+2KMnO4+4KOH=2K2MnO4+K2SO4+2H2O
3P2O3+2HClO3+9H2O=6H3PO4+2HCl
Cr2O3+3KNO3+4KOH=2K2CrO4+3KNO2+2H2O
3NO2+ H2O=NO+2HNO3
P2O3+6KOH+2NO2=2NO+2K3PO4+3H2O
SO2+2CuCl2+2H2O=2CuCl+HCl+H2SO4
3P2O3+2H2Cr2O7+H2O=2H3PO4+4CrPO4
3SO2+K2Cr2O7+H2SO4=K2SO4+Cr2(SO4)3+H2O
3P2O3+4HNO3+7H2O=6H3PO4+4NO
2NO+3KClO+2KOH=2KNO3+3KCl+H2O
Al2O3+3C+3Cl2=2AlCl3+CO
Cr2O3+3NaNO3+2Na2CO3=2NaCrO4+NaNO2+2CO2
SO2+2FeCl3+2H2O=2FeCl2+H2SO4+2HCl
MnO2+2KBr+2H2SO4=MnSO4+Br2+K2SO4+2H2O
3SiO2+5C+Ca3(PO4)2=2P+5CO+3CaSiO3
Cr2O3+3NaClO+4NaOH=2Na2CrO4+3NaCl+2H2O
MnO2+4HCl=MnCl2+Cl2+2H2O
Cr2O3+KClO+4NaOH=KCl+2Na2CrO4+2H2O
Cr2O3+2H2O2+4KOH=2K2CrO4+5H2O
Cr2O3+KClO3+4KOH=2K2CrO4+KCl+2H2O
|
| ОВР
| | С простыми веществами
4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O
Cr2(SO4)3+3Br2+16NaOH=6NaBr+2NaCrO4+3Na2SO4+8H2O
Cu+2FeCl3=CuCl2+2FeCl2
I2+K2SO3+2KOH=2KI+K2SO4+H2O
6P+5HClO3+9H2O=5HCl+6H3PO4
3P+5HNO3+2H2O=3H3PO4+5NO
I2+10HNO3=2HIO3+10NO2+4H2O
4Mg+5H2SO4=4MgSO4+H2S+4H2O
3Cl2+2Cr(OH)3+10KOH=2K2CrO4+6KCl+8H2O
4Zn+KNO3+7KOH=NH3+4K2ZnO2+2H2O
3Br2+2Fe(OH)3+10KOH=2K2FeO4+6KBr+8H2O
B+HNO3+4HF=NO+HBF4+2H2O
5Zn+2KMnO4+8H2SO4=5ZnSO4+2MnSO4+K2SO4+8H2O
3Br2+2NaCrO2+8NaOH=2Na2CrO4+6NaBr+4H2O
3Si+4HNO3+18HF=3H2SiF6+4NO+8H2O
Si+2KOH+H2O=K2SiO3+2H2
B+3HNO3=H3BO3+3NO2
3Br2+8NH3=N2+6NH4Br
P4+3KOH+3H2O=PH3+KH2PO4
Al2O3+3C+3Cl2=2AlCl3+CO
2P+5KNO3(расплав)=5KNO2+P2O5
I2+5Cl2+6H2O=2HIO3+10HCl
8Zn+5H2S2O7=8ZnSO4+2H2S+3H2O
8Al+3KNO3+5KOH+18H2O=3NH3+8K{Al(OH)4}
P4+20HNO3=4H3PO4+20NO2+4H2O
2Al+K2Cr2O7+7H2SO4=Al2(SO4)3+Cr2(SO4)3+K2SO4+7H2O
4Cl2+H2S+4H2O= H2SO4+8HCl
5C+Ca3(PO4)2+3SiO2=2P+5CO+3CaSiO3
Br2+2KOH=KBr+KBrO+H2O
Br2+Na2SO3+H2O=Na2SO4+2HBr
S+6HNO3=H2SO4+6NO2+2H2O
|
| РАСЧЕТЫ
| | 1тн=1000кг 1м3=1000дм3=1000л
1кг=1000гр 1см3=1мл
1г=1000мг 1дм3=1л=1000мл
V=m/p; p=m/V; m=p*V
Число авогадро (Na=6*10^23)
p(H2O)=1г/мл
n=m/M; m=n*M; n=V/Vm; V=Vm*n
| | ОВР
| | Разное
Al2S3+30HNO3=2Al(NO3)3+3H2SO4+24NO2+12H2O
6FeSO4+2HNO3+3H2SO4=3Fe2(SO4)3+2NO+4H2O
FeCl2+4HNO3=Fe(NO3)3+2HCl+NO2+H2O
AlP+11HNO3=H3PO4+8NO2+Al(NO3)3+4H2O
6FeSO4+KClO3+3H2SO4=3Fe2(SO4)3+KCl+3H2O
3MnSO4+2KClO3+12KOH=3K2MnO4+2KCl+3K2SO4+6H2O
2NaNO2+2NaI+2H2SO4=2NO+I2+2Na2SO4+2H2O
8KI+5H2SO4=4I2+H2S+4K2SO4+4H2O
3PH3+4HClO3=3H3PO4+4HCl
2NH3+3KClO3=N2+3KCl+3H2O
Ca(ClO)2+4HCl=CaCl2+2Cl2+2H2O
3H2S+HClO3=3S+HCl+3H2O
Fe2(SO4)3+2KI=2FeSO4+I2+K2SO4
3As2S3+28HNO3+4H2O=6H3AsO4+28NO+9H2SO4
NaClO+2KI+H2SO4=I2+NaCl+K2SO4+H2O
2KNO3+6KI+4H2SO4=2NO+3I2+4K2SO4+4H2O
3NaNO2+Na2Cr2O7+8HNO3=5NaNO3+2Cr(NO3)3+4H2O
PH3+8AgNO3+4H2O=8Ag+H3PO4+8HNO3
FeS+12HNO3=Fe(NO3)3+H2SO4+9NO2+5H2O
KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O
Fe2(SO4)3+Na2SO3+H2O=2FeSO4+Na2SO4+H2SO4
5Na2SO3+2KIO3+H2SO4=I2+K2SO4+5Na2SO4+H2O
2CrBr3+3H2O2+10NaOH=2Na2CrO4+6NaBr+8H2O
2CuI+4H2SO4=2CuSO4+I2+2SO2+4H2O
H2S+H2SO4=S+SO2+2H2O
2FeCl3+3Na2S=2FeS+S+6NaCl
Na2S+8NaNO3+9H2SO4=10NaHSO4+8NO2+4H2O
2NaI+H2O2+H2SO4=Na2SO4+I2+2H2O
2HMnO4+5H2S+2H2SO4=5S+2MnSO4+8H2O
2Cr(SO4)3+3H2O2+10NaOH=2Na2CrO4+3Na2SO4+8H2O
| | ОВР
| | Разное
Na2Cr2O7+6NaI+7H2SO4=Cr2(SO4 )3+3I2+4Na2SO4+7H2O
H2S+8HNO3=H2SO4+8NO2+4H2O
Na2Cr2O7+3H2S+4H2SO4=Cr2(SO4)3+3S+Na2SO4+7H2O
2Na2CrO4+6NaBr+8H2SO4=Cr2(SO4)3+3Br2+5Na2SO4+8H2O
3K2S+4H2SO4=4S+3K2SO4+4H2O
PH3+8HNO3=H3PO4+8NO2+4H2O
Ag2S+10HNO3=2AgNO3+H2SO4+8NO2+4H2O
PH3+8H2SO4+H3PO4+4SO2+4H2O
NH4NO2+MnO2+H2SO4=MnSO4+NH4NO3+H2O
2NaMnO4+3Na2S+4H2O=2MnO2+3I2+8KOH
2CrCl3+3KClO+10KOH=2K2CrO4+9KCl+5H2O
| | | УГЛЕРОД
| КРЕМНИЙ
| | O2
| 2С+O2(нед)=2CO
C+O2(изб)=CO2
| Si+O2=SiO2
| | H2
| C+2H2=CH4
| НЕ РЕАГИРУЕТ!
| | ГАЛОГЕНЫ
| Только с F!
C+2F2=CF4
| Без t: Si+2F2=SiF4
С t: Si+2Cl2=SiCl4
| | НеМе
| C+2S=CS2
| Si+S=SiS2
| | Ме(ЩМ/ЩЗМ/Al/Mg/Fe)
| Ca+2C=CaC2
| Ca+Si=Ca2Si
| | ОКСИДЫ Ме
| 9C+2Al2O3=Al4C3+6CO
ZnO+C=CO+Zn
| При t: 2MgO+Si=2Mg+SiO2
Избыток Si:
MgO+Si=Mg2Si+SiO2
| | ОКСИДЫ НеМе
| C+CO2=2CO
3C+SiO2=SiC+2CO
| SiO2+Si=2SiO
| | ВОДА
| С+H2O=CO+H2
| Si+2H2O=SiO2+2H2
| | ЩЕЛОЧИ
| НЕ РЕАГИРУЕТ!
| При t: Si+2NaOH+H2O=Na2SiO3+2H2
| | КИСЛОТЫ-ОКИСЛ
| C+2H2SO4(k)=CO2+2SO2+2H2O
| Si+HNO3 -НЕ РЕАГИРУЕТ
3Si+4HNO3+18HF=3H2{SiF6}+4NO+8H2O
|
| ОВР
| | C перманганатом калия
2KMnO4+3MnSO4+ 2H2O=5MnO2+K2SO4+2H2SO4
2KMnO4+16HCl=2MnCl2+5Cl2+8H2O+2KCl
2KMnO4+5NaNO3+3H2SO4=2MnSO4+5NaNO3+ K2SO4+3H2O
2KMnO4+10FeSO4+8 H2SO4=5Fe2(SO4)+ 2MnSO4+ K2SO4+8H2O
2KMnO4+5H2S+3H2SO4=5S+2MnSO4+ K2SO4+8H2O
2KMnO4+5Na2SO3+3H2SO4=MnSO4+5Na2SO4+ K2SO4+3H2O
2KMnO4+SO2+4KOH= K2SO4+2H2O+2K2MnO4
6KMnO4+Cr2(SO4)3+16KOH=2K2CrO4+6K2MnO4+3K2SO4+8H2O
2KMnO4+KI+H2O=2MnO2+KIO3+2KOH
4KMnO4+6H2SO4+5HCOH=5CO2+2K2SO4+4MnSO4+11H2O
2KMnO4+5KNO2+ H2O=3 KNO3+2MnO2+2KOH
KMnO4+8HCl=MnCl2+2Cl2+4H2O+2KCl
2KMnO4+10KBr+8H2SO4=2MnSO4+5Br2+6K2SO4+8H2O
2KMnO4+2NH3=2MnO2+N2+2KOH+2H2O
2KMnO4+3Na2SO3+H2O=3Na2SO4+2MnO2+2KOH
6KMnO4+2NH3+6KOH=N2+6K2MnO4+6H2O
2KMnO4+5Zn+8H2SO4=5ZnSO4+2MnSO4+K2SO4+8H2O
8KMnO4+5PH3+12H2SO4=5H3PO4+8 MnSO4+4K2SO4+12H2O
8KMnO4+5AsH3+12H2SO4=5H3AsO4+8MnSO4+4K2SO4+12H2O
2KMnO4(тв)+2NH3=N2+2MnO2+2KOH+2H2O
2KMnO4+5H2O2+3H2SO4=5O2+2MnSO4+K2SO4+8H2O
2KMnO4+Na2SO3+2KOH=2K2MnO4+Na2SO4+H2O
2KMnO4+KNO2+2KOH=2K2MnO4+KNO3+H2O
| | Основания/Амфотер гидроксиды 2
| | 9. С НеМе
-с галогенами
На холоде: Cl2+KOH=KCl+KClO+H2O
При t: Cl2+KOH=KCl+KClO3+H2O
-с серой
S+KOH=K2SO3+K2S+H2O
-с фосфором
P+KOH+H2O=KH2PO4+PH3
-с кремнием
Si+KOH+H2O=K2SiO3+H2
2. Нераств основания хим св-ва
1. Не диссоциируют
2. С кислотами (сильная кислота!)
3. С кислот оксидами сильных кислот
Cu(OH)2+SO3=CuSO4+H2O
4. Разложение
Mg(OH)2=MgO+H2O
Специфические реакции
Cu(OH)2+4NH3=Cu(NH3)2(OH)2
Cr(OH)2+O2+H2O=Cr(OH)3
Fe(OH)2+ O2+H2O=Fe(OH)3
2Fe(OH)2+H2O2=2Fe(OH)
|
| Основания/Амфотер гидроксиды
| |
| Кислая ph<7
| Нейтральная ph=7
| Щелочная ph>7
| | лакмус
| Красный
| фиолет
| синий
| | метилоранж
| Красный
| оранж
| Желтый
| | фенолфталеин
| бесцветн
| бесцвет
| Малиновый
| |
1. Щелочи хим св-ва
|

 Кристалл. Решетки-
Молекулярная-тип связи-ковалент; вещ-ва- неор: соединения НеМе(искл Si/C), С60, Р4(белый), I2, лед(H2O), сера(S8- ромбич, моноклин.); орг:все вещ-ва не ионного стр, CH4, CH3COOH, CH3-NH2, HCOH
Св-ва: небольшая твердость и прочность, летучесть, низкая tплав, в узлах решетки-молекулы
Атомная-тип связи-ковалент; вещ-ва- C(алмаз, графит), В, Si. SiO2, SiC,P(черн), Р(крас), BN. B4С
Cв-ва: высокая тверд и прочность, высокие tплав, нерастворим, в узлах-атомы
Кристалл. Решетки-
Молекулярная-тип связи-ковалент; вещ-ва- неор: соединения НеМе(искл Si/C), С60, Р4(белый), I2, лед(H2O), сера(S8- ромбич, моноклин.); орг:все вещ-ва не ионного стр, CH4, CH3COOH, CH3-NH2, HCOH
Св-ва: небольшая твердость и прочность, летучесть, низкая tплав, в узлах решетки-молекулы
Атомная-тип связи-ковалент; вещ-ва- C(алмаз, графит), В, Si. SiO2, SiC,P(черн), Р(крас), BN. B4С
Cв-ва: высокая тверд и прочность, высокие tплав, нерастворим, в узлах-атомы
 Высшая валентность=№группы, низшая=8-№группы
Высшая валентность=№группы, низшая=8-№группы