
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Средняя длина свободного пробега молекулы
Средняя длина свободного пробега молекулы
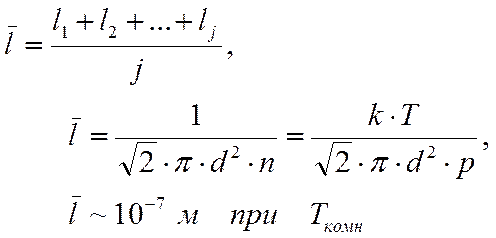
Оценим среднюю длину свободного пробега молекул воздуха. При нормальных условиях температура воздуха порядка комнатной, положим её равной
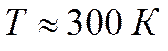 ,
,
а давление равно
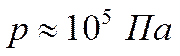 .
.
Тогда
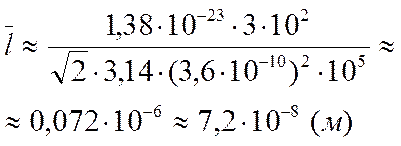 .
.
Средняя длина свободного пробега позволяет определить среднюю арифметическую скорость молекулы
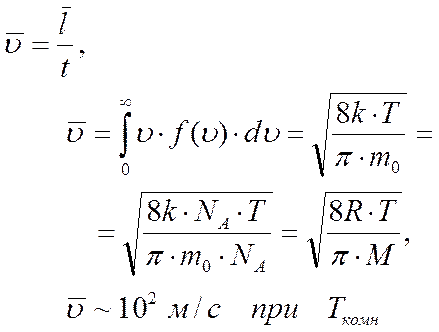
где f(u) – плотность вероятности (или функцией Максвелла), позволяющая вычислить среднюю арифметическую скорость.
Молекулы вещества при одной той же температуре движутся с разными скоростями. Распределение молекул по скоростям или кинетическим энергиям называется распределением Максвелла. Функция Максвелла (функция распределения молекул по скоростям) имеет вид (рис.):
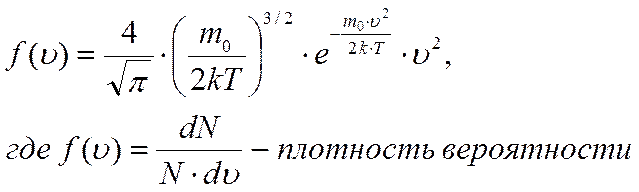
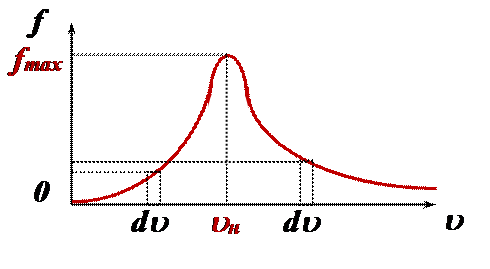 |
Оно показывает, какая доля молекул от общего их числа (т. е. вероятность) движется со скоростями в заданном интервале значений скоростей:
1) доля медленных молекул мала
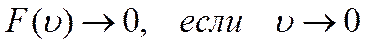
2) доля быстрых молекул мала
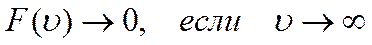
3) большинство молекул движется с наивероятнейшей скоростью
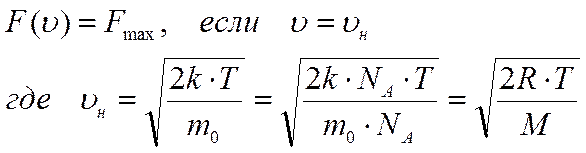
Распределение Максвелла:
- справедливо для равновесного состояния газа (с постоянной температурой), т. е. при отсутствии явлений переноса;
- не учитывает действие внешних потенциальных полей (поле силы тяжести).
В действительности же, полем силы тяжести нельзя пренебрегать. Оно влияет на концентрацию молекул в зависимости от удаления от поверхности Земли. Это влияние описывает распределение Больцмана – распределение молекул по потенциальным энергиям (рис.):
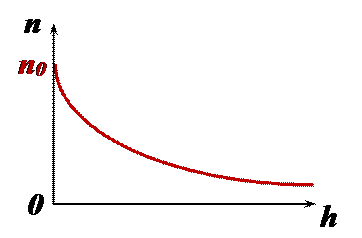
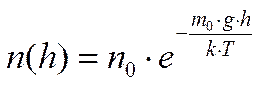
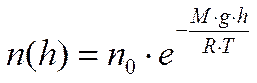
Поскольку
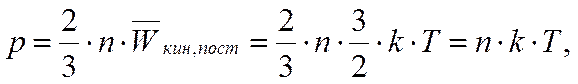
то справедлива и барометрическая формула
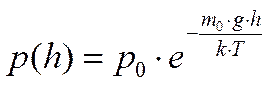
или
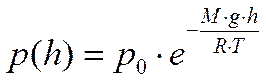
Распределение Больцмана и барометрическая формула выполняются:
- для равновесного состояния газа (с постоянной температурой), т. е. при отсутствии явлений переноса,
- для нижнего слоя атмосферы (тропосферы), имеющего толщину 10 - 11 км, поскольку в пределах этого слоя можно пренебречь зависимостью изменением ускорения свободного падения от высоты.
Вследствие закона сохранения энергии, оба распределения можно объединить в общее, которое называется распределением Максвелла – Больцмана, также справедливое для равновесного состояния газа.
Любая движущаяся молекула имеет среднюю кинетическую энергия молекулы. В случае только поступательного движения она равна:
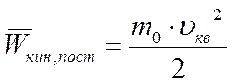
Эта энергия определяется по величине средней квадратичной скорости молекулы:
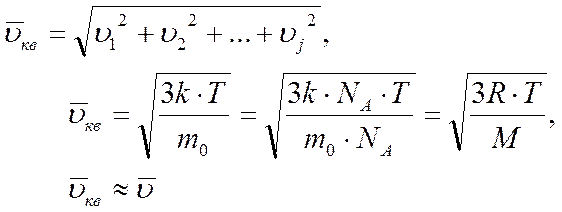
Эту скорость можно найти, в свою очередь, из основного уравнения МКТ. Основным уравнением молекулярно-кинетической теории строения вещества называют взаимосвязь макро- и микропараметров.
В частности, дляидеального газаосновное уравнение МКТ устанавливает количественное соотношение между давлением газа на стенки сосуда (макропараметр) и средней квадратичной скоростью поступательного движения молекулы (средней кинетической энергией молекулы) в качестве микропараметра:
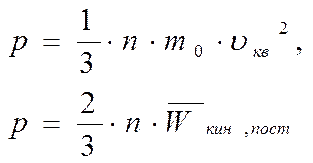

Молекулы газа в общем случае (реальный газ) могут двигаться не только поступательно, но и вращаться, а также существует колебательное движение атомов в молекуле. Поэтому число степеней свободы (возможных движений) равно
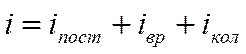
Теорема о равнораспределении средней кинетической энергии по степеням свободы: на каждую степень свободы приходится средняя кинетическая энергия, равная
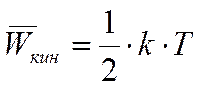
(k – постоянная Больцмана). Энергия молекулы, имеющей все степени свободы, равна
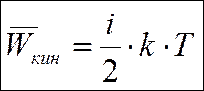
Частные случаи (рис. 4):
если молекула газа одноатомная, то
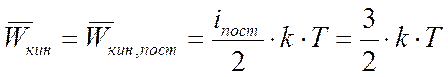 ,
,
1) если молекула газа «жёсткая» двухатомная, то
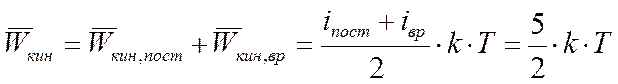
2) если молекула газа «жёсткая» трёх- и многоатомная, то
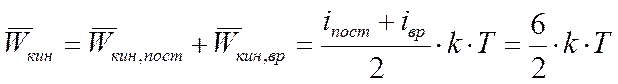
Из теоремы о равнорапределении энергии следует, что термодинамическая температура служит мерой кинетической энергии.
При охлаждении вещества сначала «замораживаются» поступательные степени свободы – газ переходит в жидкость, уменьшается число «кочующих» молекул, увеличивается – «осёдлых».
При дальнейшем охлаждении «замораживаются» вращательные степени свободы – жидкость превращается в твёрдое тело, частицы которого преимущественно колеблются около положений равновесия.
В пределе – при абсолютном нуле температуры – движение молекул прекращается с точки зрения классической физики.
На такой трактовке температуры была построена теоретическая шкала Кельвина – термодинамическая шкала:
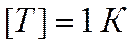
Практически применяют эмпирическую шкалу Цельсия:
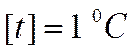
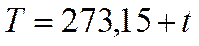
Однако даже при «абсолютном» нуле термодинамической температуры остаётся внутриатомное, внутриядерное и др. движения, описываемые квантовой физикой, и выводы классической физики на основе МКТ теряют прежний физический смысл.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|