
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ПРИРОДНО-КЛИМАТИЧЕСКИЕ УСЛОВИЯ
Раздел 1.
ПРИРОДНО-КЛИМАТИЧЕСКИЕ УСЛОВИЯ
1.2. Воздух
1.1.2. Воздух
Воздух (газ) обладает:
- малыми плотностью, вязкостью (внутренним трением) и теплопроводностью,
- значительной сжимаемостью,
- большой скоростью диффузии,
- способностью занимать любой объём, который им предоставлен,
- отсутствием структуры (наличием лишь хаотически «кочующих» частиц).
Физическая модель газа: "идеальный газ" – газ при температуре порядка комнатной (~300 К) и давлении порядка атмосферного (~105 Па), состоящий из одноатомных молекул, которые можно считать невзаимодействующими материальными точками;
Масса частицы очень мала
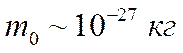
Поэтому используют величину молярной массы, т. е. массы одного моля вещества. Она пропорциональна сумме относительных масс атомов в молекуле (указаны в таблице Менделеева):
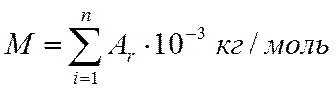
Количество вещества равно отношению числа частиц к числу Авогадро
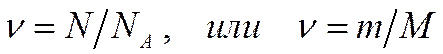
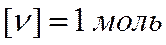
где m - масса вещества, равная сумме масс частиц (молекул, атомов).
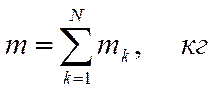
В одном моле содержится число Авогадро частиц.
Если частицы считать «упругими шариками», то их размер описывают величиной эффективныйдиаметр, т. е. реальный диаметр совместно с частью пространства, которое при столкновении частиц недоступно из-за сил отталкивания. Иначе, эффективный диаметр - это минимальное расстояние, на которое могут сблизиться центры частиц при столкновении (рис.)
 |
Значения величины d приводятся в справочниках (табл. 1).
Табл. 1
Эффективный диаметр молекул
| Газ | d, нм | Газ | d, нм | Газ | d, нм |
| Азот | 0,37 | Кислород | 0,356 | Неон | 0,354 |
| Аргон | 0,36 | Криптон | 0,314 | Окись углерода | 0,370 |
| Водород | 0,27 | Ксенон | 0,40 | Углекислый газ | 0,454 |
| Гелий | 0,215 | Метан | 0,444 | Хлор | 0,544 |
Воздух представляет собой газовую смесь в основном молекул азота (70 %) и кислорода (20 %), а также воды, углекислого газа и возможных инородных примесных частиц. На основе данных табл. 1 можно считать, что эффективный диаметр молекул воздуха приблизительно равен
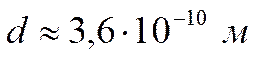 .
.
Для других молекул порядок величины d оказывается таким же:
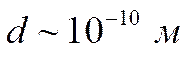 .
.
Частицы взаимодействую друг с другом силами притяжения и отталкивания. Их называют силами Ван-дер-Ваальса. Эти силы существенно зависят от расстояния между частицами:
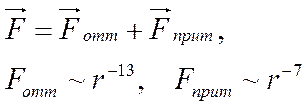
 |
Рассмотрим силы между частицами газа (рис.).
• На далёких расстояниях между частицами силы притяжения и отталкивания пренебрежимо малы, и частицы движутся «свободно» (равномерно, без ускорений)
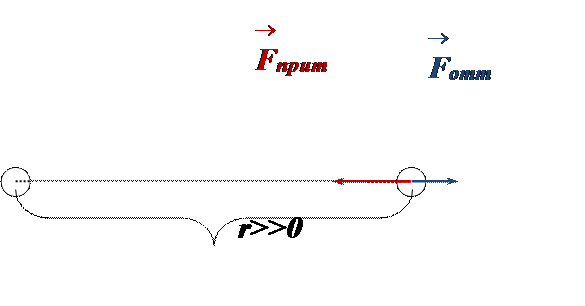
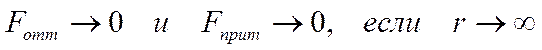 .
.
• При сближении частиц силы Ван-дер-Ваальса возрастают, при этом притяжение преобладает над отталкиванием:
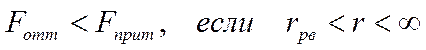 .
.
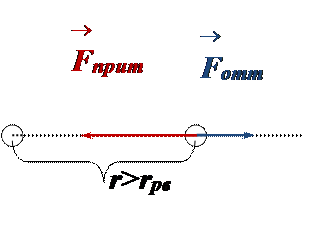 |
• При дальнейшем сближении силы отталкивания существенно возрастают, компенсируя силы притяжения (энергия взаимодействия частиц минимальная):
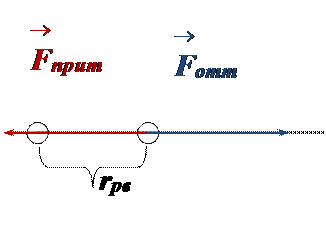
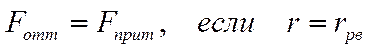 .
.
• На малых расстояниях между частицами силы отталкивания преобладают над силами притяжения, и происходит столкновение частиц – они не могут сблизиться на расстояние, меньшее эффективного диаметра
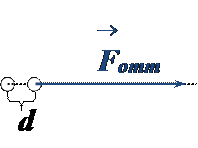
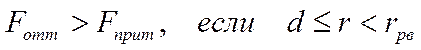 .
.
Частицы совершают тепловое движение.
Тепловое движение – это непрерывное хаотическое движение частиц, которые сталкиваются друг с другом случайным образом.
Во время столкновения силы отталкивания заставляют частицы «разлетаться», при этом у каждой частицы изменяются (рис. 3):
• модуль и направление скорости (по закону сохранения импульса),
• кинетическая энергия,
• пройденный путь до следующего столкновения.
• 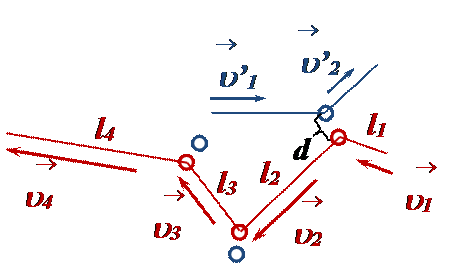 направление траектории (в течение некоторого времени наблюдения она приобретает вид ломаной линии из отрезков разной длины).
направление траектории (в течение некоторого времени наблюдения она приобретает вид ломаной линии из отрезков разной длины).
После столкновения силы Ван-дер-Ваальса быстро убывают, и движение молекул можно считать равномерным, «свободным».
Случайность столкновений (вероятностный процесс) означает, что длина свободного пробега (пути) между столкновениями, скорость и кинетическая энергия любой молекулы являются случайными величинами.
Поэтому физический смысл имеют средние значения этих величин.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|