
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Примеры решения задач. При анализе 0,7205 г сплава после соответствующей обработки получена гравиметрическая форма Fe2O3 массой 0.5228г. Вычислите массовую долю (%) железа в образце.. Рассчитайте навеску трилона Б для приготовления 250 мл раствора, если с
Примеры решения задач
1. При анализе 0,7205 г сплава после соответствующей обработки получена гравиметрическая форма Fe2O3 массой 0.5228г. Вычислите массовую долю (%) железа в образце.
Решение:
1)Гравиметрический фактор: F Fe /Fe2O3 = 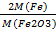 =
= 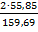 =0,6994
=0,6994
2)Массовая доля железа в образце:
w(Fe)= 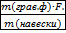 ∙100% =
∙100% = 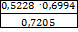 ·100%=50,75%
·100%=50,75%
Ответ: w(Fe)=50,75%
2. Рассчитайте навеску трилона Б для приготовления 250 мл раствора, если с(1/2Na2H2Y)=0,04 моль/л. (М(1/2Na2H2Y)=186,15 г/моль).
Решение:
Расчет навески:
m(Na2H2Y)=с(1/2Na2H2Y) · M(1/2Na2H2Y) · V(колбы) = 0,04·186,15 ·0,250= 1,8615 г
Ответ: m(Na2H2Y)=1,8615 г.
3. Вычислите молярную концентрацию эквивалента и титр раствора трилона Б, если на титрование 200 мл раствора MgSO4 с молярной концентрацией эквивалента 0,1 моль/л израсходовано 400 мл раствора трилона Б. (М(1/2Na2H2Y)=186,15 г/моль).
Решение:
1) Вычисляем молярную концентрацию трилона Б:
с(1/2Na2H2Y) = 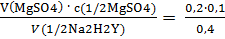 = 0,05 моль/л
= 0,05 моль/л
2) Вычисляем титр раствора трилона Б:
Т(1/2Na2H2Y)= 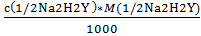 =
= 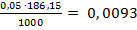 г/мл
г/мл
Ответ: Т(1/2Na2H2Y)= 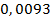 моль/л
моль/л
4. Определить титр и нормальность раствора, в 300 мл которого содержится 0,690 г K2CO3.
| Дано: g= 0,690 г V =300 мл T-? N-? | Решение: Т = g/V=0,69/300= 0,0023 Mэ (K2CO3)=1/2*(39*2+12+16*3)=69 N= T*1000/Mэ= 0,0023*1000/69=0,033 |
5. На титрование 10 мл раствора НСI израсходовано 15 мл 0,120 н раствора NaOH. Определите нормальную концентрацию эквивалента раствора НСI.
| Дано: Vк= 10 мл Nщ = 15 мл Vщ = 0,12 моль/л Nк -? | Решение: Vк/Vщ=Nщ/Nк ; Nк = Vщ ∙ Nщ/ Vк= 15*0,12/10=0,18 моль/л |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|