
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Хроническая ишемическая болезнь сердца 3 страница
На электрокардиограмме электрическая ось сердца отклонена вправо, зубец /"увеличен и расщеплен.
На фонокардиограмме регистрируют громкий I тон, диастолический шум над верхушкой сердца, акцент II тона над легочной артерией, митральный щелчок.
Характерными эхокардиографическими особенностями порока являются однонаправленное диастолическое движение створок митрального клапана, снижение скорости раннего диастолического закрытия передней створки левого предсердно-желудочкового клапана, снижение общей экскурсии клапана, уменьшение диастолического расхождения его створок и увеличение размеров полости левого предсердия. При ультразвуковом сканировании определяют атриовентрикулярное отверстие ("в торец"), кальциноз створок и их подвижность; вычисляют площадь отверстия и оба диаметра его.
При рентгенологическом исследовании сердца в переднезадней проекции видно выбухание второй дуги левого контура сердца за счет увеличения легочной артерии. По правому контуру определяют увеличение тени левого предсердия, которое может выходить за контуры правого предсердия.
В зависимости от степени сужения атриовентрикулярного отверстия различают следующие стадии заболевания.
Стадия I — бессимптомная; площадь отверстия составляет 2—2,5 см2, клинические признаки заболевания отсутствуют.
Стадия II — площадь отверстия 1,5—2 см2; при физической нагрузке появляется одышка.
Стадия III — площадь отверстия 1 — 1,5 см2; отмечается одышка в покое; при обычной физической активности одышка нарастает, присоединяются такие осложнения, как мерцательная аритмия, образование тромбов в предсердии, артериальные эмболии, фиброз легких.
Стадия IV — стадия терминальной несостоятельности; площадь отверстия менее 1 см2. Отмечаются признаки недостаточности кровообращения в покое и при малейшей физической нагрузке.
Стадия V — необратимая; у больного имеются тяжелые дистрофические изменения в паренхиматозных органах и миокарде.
Течение заболевания зависит от степени сужения левого атриовентрикулярного отверстия. Значительное ухудшение наступает при развитии осложнений: мерцательной аритмии, грубого фиброза и кальциноза клапана, образования тромбов в левом предсердии с эпизодами артериальной эмболии, легочной гипертензии и атеросклероза легочных артерий с присоединением относительной или органической недостаточности правого предсердно-же-лудочкового клапана. Смерть наступает от прогрессирующей сердечной недостаточности, отека легких, истощения.
Лечение. Выбор метода лечения стеноза левого атриовентрикулярного отверстия определяется тяжестью состояния больных, степенью нарушения гемодинамики, стадией развития заболевания.
В I стадии заболевания больному операция не показана. Во II стадии операция дает наилучшие результаты, предотвращая прогрессирование процесса (выполняют катетерную баллонную вальвулопластику левого пред-сердно-желудочкового клапана или закрытую комиссуротомию). В III стадии оперативное лечение является необходимым, хотя сроки, при которых операция наиболее эффективна, уже пропущены; лекарственная терапия дает временный положительный эффект. В IV стадии еще возможно проведение операции, однако риск ее значительно возрастает; при лекарственной терапии наблюдается незначительный эффект. В V стадии заболевания проводят лишь симптоматическое лечение.
При отсутствии выраженных фиброзных изменений створок и кальциноза клапана у больных с синусовым ритмом производят закрытую митральную комиссуротомию. Пальцем или специальным инструментом (комиссу-ротомом, дилататором) разделяют спайки по комиссуре и устраняют под-клапанные сращения. При левостороннем доступе к сердцу палец для разделения створок вводят через ушко левого предсердия, предварительно наложив кисетный шов на его основание. В случае необходимости для расширения митрального отверстия в левый желудочек вводят дилататор через бессосудистый участок его верхушки. При правостороннем доступе палец и инструмент вводят через межпредсердную борозду. Если в процессе операции выявлен тромб в левом предсердии, обширный кальциноз клапана, установлена неэффективность попытки закрытой комиссуротомии или возникает недостаточность клапана после дилатации митрального отверстия, то переходят к открытой коррекции клапана в условиях искусственного кровообращения. При выраженных изменениях клапана, обусловленных каль-цинозом и сопутствующей регургитацией, показано его протезирование.
В некоторых клиниках производят баллонную дилатацию с помощью
баллончика, проведенного на катетере в левое атриовентрикулярное отверстие. Катетер с пластиковым баллончиком вводят в левое предсердие путем транссептальной пункции. Диаметр баллончика соответствует нормальному для данного пациента диаметру левого атриовентрикулярного отверстия. Баллончик устанавливают в отверстии и раздувают жидкостью под давлением до 5 атм. Осуществляется закрытая митральная комиссуротомия.
Пластическая операция на левом предсердно-желудочковом клапане проводится на открытом сердце в условиях кардиоплегии. Оперативное вмешательство предусматривает восстановление функций створок и подклапанных структур. При выраженных изменениях клапана, обусловленных кальцино-зом и сопутствующей регургитацией, выполняют его протезирование.
Наилучшие результаты комиссуротомия дает при проведении оперативного вмешательства во II—III стадиях, когда вторичные изменения во внутренних органах, связанные с недостаточностью кровообращения, имеют обратимый характер.
Все больные после оперативных вмешательств должны находиться под наблюдением ревматолога и получать сезонное противоревматическое лечение во избежание обострения процесса, рестеноза или недостаточности клапана, при появлении которых может возникнуть необходимость повторного оперативного вмешательства.
17.5.2. Недостаточность левого предсердно-желудочкового клапана (митральная недостаточность)
Причиной органической митральной недостаточности у 15 % больных является ревматизм.
Неполное смыкание створок левого предсердно-желудочкового клапана обусловливает обратный ток крови (регургитация) из левого желудочка в предсердие во время систолы. Величина регургитации определяет тяжесть митральной недостаточности. Левый желудочек должен постоянно выбрасывать большее количество крови, так как часть ее в систолу возвращается в левое предсердие и вновь поступает в левый желудочек. Порок длительное время компенсируется работой мощного левого желудочка, вызывая его гипертрофию и последующую дилатацию. Постепенно происходит гипертрофия и левого предсердия. Давление в полости левого предсердия ретроградно передается на легочные вены; повышается давление в легочной артерии, развивается гипертрофия правого желудочка.
Клиническая картина и диагностика. В стадии компенсации порока одышка, кашель менее выражены, чем при митральном стенозе. Кровохарканье наблюдается редко. Недостаточность кровообращения возникает в более поздние сроки. Больные могут переносить значительную физическую нагрузку, и заболевание часто выявляют случайно при профилактическом осмотре.
При снижении сократительной функции миокарда левого желудочка и повышении давления в малом круге кровообращения появляются жалобы на одышку при физической нагрузке и сердцебиение. Нарастающие застойные явления в малом круге кровообращения могут вызывать одышку в покое и приступы сердечной астмы. Клинические проявления болезни тесно связаны со степенью нарушения кровообращения, которая находится в прямой зависимости от объема регургитации крови из левого желудочка в левое предсердие, степени нарушения сократительной способности миокарда и выраженности легочной гипертензии.
Во время осмотра выявляют расширение области сердечного толчка на 3—4 см, смещение верхушечного толчка влево.
При аускультации определяют ослабление I тона, акцент II тона. Над легочной артерией он умеренно выражен и возникает при развитии застойных явлений в малом круге кровообращения. Часто у верхушки сердца выслушивают III тон. Наиболее характерным симптомом при митральной недостаточности является систолический шум.
При незначительно и умеренно выраженном пороке на электрокардиограмме наблюдают признаки гипертрофии левого предсердия и левого желудочка, на фонокардиограмме — значительное уменьшение амплитуды I тона. Систолический шум начинается сразу после I тона и занимает всю систолу или большую ее часть.
Изолированная митральная недостаточность на эхокардиограмме характеризуется дилатацией левых отделов сердца, избыточной экскурсией межжелудочковой перегородки, разнонаправленным диастолическим движением утолщенных створок левого предсердно-желудочкового клапана и заметным отсутствием их смыкания в систолу.
При рентгенологическом исследовании в переднезадней проекции выявляют закругление четвертой дуги по левому контуру сердца вследствие гипертрофии и дилатации левого желудочка. Кроме того, увеличение левого предсердия обусловливает выбухание третьей дуги. Увеличение левого предсердия особенно четко выявляется в первой косой или левой боковой проекции, где этот отдел сердца смещает контрастированный пищевод по дуге большого радиуса (более 6 см). При большом увеличении левого предсердия тень последнего может выступать за правый контур сердца в виде добавочной тени. В случаях выраженной митральной недостаточности можно наблюдать систолическое выбухание левого предсердия (симптом "коромысла").
Ультразвуковая допплерография или внутрисердечное исследование определяют объем регургитации из левого желудочка в левое предсердие, площадь левого атриовентрикулярного отверстия, давление в полостях сердца и легочной артерии. По количеству контрастированной крови, поступающей в момент систолы из левого желудочка в предсердие, различают четыре степени регургитации.
Увеличение размеров сердца, развитие мерцательной аритмии, приступы отека легких приводят к выраженной декомпенсации кровообращения, кахексии и смерти от острой сердечной недостаточности.
Лечение. Выбор метода лечения при недостаточности левого предсердно-желудочкового клапана определяется стадией развития болезни (см. "Стеноз левого атриовентрикулярного отверстия"). При I стадии хирургическое лечение не проводят. Операция показана преимущественно больным во II и III стадии. При IV стадии риск операции высокий, эффект менее стойкий. При V стадии в связи с необратимыми изменениями в сердце и паренхиматозных органах операция противопоказана.
У больных с неосложненными формами недостаточности левого предсердно-желудочкового клапана и при отсутствии выраженного кальциноза створок, резких изменений подклапанных структур операцию устранения порока выполняют в условиях искусственного кровообращения и кардио-плегии. Цель оперативного вмешательства — восстановление запирательной функции митрального клапана. Клапаносохраняющая операция заключается в суживании фиброзного кольца специальным опорным жестким кольцом. По показаниям применяют шовную вальвулопластику, аннулопласти-ку, восстановление подклапанных структур (укорочение хорд, за счет чего
достигают сопоставления створок клапана). При наличии кальциноза и фиброза в области клапана чаще всего производят протезирование клапана механическим или биологическим протезом.
После протезирования митрального клапана, так же как после митральной комиссуротомии, возможна достаточно полная реабилитация больного при условии раннего (II—IIIстадии) оперативного вмешательства, систематического наблюдения ревматологом и проведения лечения по показаниям.
17.5.3. Аортальные пороки сердца
Причинами возникновения аортальных пороков сердца (15—20 % всех приобретенных пороков сердца) могут быть ревматизм, бактериальный эндокардит, атеросклероз.
Наиболее часто встречаются ревматические поражения клапанов аорты, у мужчин в 3—5 раз чаще, чем у женщин. Створки клапана аорты подвергаются обызвествлению, нередко массивному, с переходом кальциноза на фиброзное кольцо клапана, стенку аорты, миокард левого желудочка, переднюю створку левого предсердно-желудочкового клапана.
Различают стеноз, недостаточность и комбинированные поражения, когда имеются одновременно стенозирование и недостаточность клапана аорты.
Аортальный стеноз— срастание створок клапана между собой, кальциноз и деформация створок, приводящие к сужению устья аорты, уменьшению выброса крови в нее, нарастающей перегрузке и гипертрофии левого желудочка.
Клиническая картина и диагностика. Больные жалуются на одышку, боли в области сердца, сердцебиение. При аускультации выслушивается систолический шум над устьем аорты, распространяющийся на сосуды шеи. На ЭКГ выявляются признаки гипертрофии левого желудочка. При рентгенологическом исследовании отмечаются характерные для стеноза признаки — аортальная конфигурация сердца за счет увеличения левого желудочка, иногда наблюдается постстенотическое расширение восходящей аорты. Одышка может носить пароксизмальный характер (приступы сердечной астмы) и завершаться развитием отека легких. При аортальных пороках смерть наступает иногда внезапно на фоне кажущегося благополучия.
Аортальная недостаточность— нарушение замыкательной функции аортального клапана вследствие рубцовой деформации створок или расширения фиброзного кольца основания аорты. В связи с недостаточностью клапана значительная часть крови в фазу диастолы возвращается из аорты в левый желудочек. Это приводит к уменьшению минутного объема кровообращения, коронарной недостаточности и объемной перегрузке левого желудочка. Недостаточность аортального клапана приводит к прогрессирующей дистрофии миокарда и быстрой декомпенсации.
Клиническая картина и диагностика. При осмотре больных обнаруживают разлитой приподымающий верхушечный толчок сердца, который смещен вниз и влево в шестом — седьмом межреберье по передней аксиллярной линии. При недостаточности клапана аорты наблюдают усиленную пульсацию артерий на шее, хорошо заметна каротидная пульсация, систолическое давление повышено, характерно снижение диастолического давления (нередко до нуля) и соответственно значительное увеличение пульсового давления.
На фонограмме выслушивают и регистрируют диастолический шум, который следует сразу за II тоном и может занимать всю диастолу. Этот шум,
обычно убывающий, распространяется вдоль левого края грудины, образован струей крови, возвращающейся из аорты в полость левого желудочка во время диастолы.
Рентгенологически выявляют увеличение размеров сердца за счет левого желудочка, восходящей аорты и ее дуги. Талия сердца хорошо выражена, сердце приобретает аортальную конфигурацию. Исследование с электронно-оптическим преобразователем позволяет увидеть отложение солей кальция в проекции клапана аорты.
Эхокардиографическое исследование помогает определить степень расширения аорты и левого желудочка, преобладание процессов гипертрофии или дилатации миокарда, оценить его сократимость, диагностировать обызвествление клапана и его распространение на соседние структуры сердца.
Катетеризацию полостей сердца и ангиографию применяют для уточнения степени стеноза или недостаточности и оценки состояния сократимости миокарда, выявления зон акинезии левого желудочка. По показаниям (стенокардия в анамнезе) выполняют коронарографию для выявления сопутствующих нарушений проходимости коронарных артерий. В настоящее время более точные данные об изменениях клапанов и гемодинамики дает цветная ультразвуковая допплеровская кардиография и магнитно-резонансное исследование.
При аортальных пороках прогрессирующая гипертрофия миокарда левого желудочка приводит к относительной коронарной недостаточности, стенокардии, очаговым рубцовым изменениям миокарда и смерти от острой левожелудочковой недостаточности.
Лечение. Оперативное лечение проводится в основном во II и III стадиях заболевания. В случае изолированного стеноза операция показана при градиенте давления между левым желудочком и аортой, превышающем 30 мм рт. ст., в случае недостаточности клапана аорты — при регургитации II степени.
Операцию производят в условиях искусственного кровообращения, хо-лодовой и фармакологической защиты миокарда. При аортальном стенозе, в случае незначительных изменений в створках клапана, возможна клапа-носохраняющая операция — разделение сращенных створок по комиссурам. В последние годы эту операцию производят редко, так как в большинстве случаев она переводит стеноз в тяжелую аортальную недостаточность. При обызвествлении створок, аортальной недостаточности, сочетании стеноза и недостаточности клапана показано иссечение его и протезирование. В настоящее время используют шаровые и дисковые искусственные клапаны аорты, биологические протезы из аортальных аллогенных и ксеногенных клапанов, сформированных из перикарда на опорных каркасах. Имплантированные протезы полностью устраняют имеющиеся нарушения внутрисер-дечной гемодинамики и способствуют нормализации работы сердца, уменьшению его размеров.
Наилучшие результаты после оперативного вмешательства получают при ранних операциях, произведенных до развития тяжелых дистрофических изменений в миокарде и других органах. После операций по поводу ревматических пороков сердца больные должны находиться под наблюдением кардиоревматолога и получать сезонное противоревматическое лечение. Пациентам с искусственными клапанами необходимо постоянно назначать антикоагулянты непрямого действия, поддерживать протромбиновый индекс в пределах 50—70 %. После имплантации биологического протеза клапана антикоагулянтную терапию можно не проводить, рекомендуется принимать небольшие дозы аспирина (100—150 мг ежедневно).
При аортальных пороках нередко имеются сопутствующие нарушения проходимости венечных артерий, грозящие развитием инфаркта миокарда. Они подлежат хирургичегкой коррекции — одновременному аортокоронар-ному шунтированию стенозированных венечных артерий.
17.6. Инфекционный эндокардит и абсцессы сердца
Возбудителями инфекционного эндокардита обычно являются зеленящий стрептококк (50—70 %), стафилококки (10—30 %), энтерококки и др., включая грамотрицательные бактерии (синегнойная палочка, клебсиелла, кишечная палочка, грибы кандида), встречается смешанная флора. Причиной инфекционного эндокардита может быть преходящая бактериемия, которая появляется после травмы, экстракции зуба (почти в 50 %), урологические инструментальные исследования мочевого пузыря, внутривенное введение наркотиков инфицированными шприцами.
Инфекция чаще поражает клапаны сердца, эндокард, миокард. В очагах инфекции иногда образуются полиповидные выросты, суживающие просвет клапана, инфицированные тромбы, способные перемещаться с током крови в другие части тела, вызывать тромбоэмболию и образование абсцессов и инфарктов в органах, в том числе в стенке сердца, инсультов. Инфекционный процесс часто в короткий срок разрушает сердечные клапаны, чаше всего — клапаны аорты (60—70 %) или оба клапана. Ранним симптомом принято считать появление систолического шума в точке Боткина. В дальнейшем, по мере разрушения клапана, появляется недостаточность аортального клапана с характерным диастолическим шумом в V точке. Лишь у 10 % наблюдается изолированное поражение митрального клапана с последующим развитием митральной недостаточности. Встречаются случаи перфорации митрального или аортального клапана.
Клиническая картина болезни складывается из локальных и общих симптомов, характерных для инфекционного процесса: слабость, ознобы с повышением температуры тела, боли в суставах. При объективном исследовании отмечают появление шумов в сердце или изменение их характера, увеличенную селезенку, анемию, лейкоцитоз, резкое повышение СОЭ, патологические изменения в моче. В типичных случаях сочетание лихорадки с ознобами, появлением шумов в сердце, увеличением селезенки и изменениями в моче дают основание для диагностики септического эндокардита. Диагноз уточняется с помощью специальных методов исследования сердца (ЭКГ, ультразвуковая допплерография, бактериологическое исследование крови).
Лечение. Основой терапии септического эндокардита является антибактериальная терапия современными препаратами и их сочетаниями с учетом чувствительности выделенного из крови возбудителя к антибиотикам.
В последние годы по жизненным показаниям применяют хирургическое лечение. Противопоказанием к операции являются необратимые изменения во внутренних органах, вызванные септическим эндокардитом и генерализованной инфекцией. Оперативное вмешательство производится на сухом сердце с использованием аппарата для искусственного кровообращения. Оперативный доступ — правосторонняя переднебоковая торакотомия в IV или V межреберьях с пересечением 1—2 хрящей верхних ребер. Основная задача вмешательства — ликвидировать очаги инфекции. Для этого используют: 1) механическую санацию — иссечение пораженных клапанов и пораженных внутрисердечных структур (вегетации на пристеночном эндокарде,
инфицированные тромбы, абсцессы, отложение кальция), 2) химическую санацию — обработку полостей сердца антибактериальными препаратами, 3) физическую санацию — обработку полостей сердца низкочастотным ультразвуком для воздействия на недоступные для иссечения очаги поражения. Используется также санирующий эффект искусственного кровообращения. Для этой цели в перфузат, используемый во время искусственного кровообращения, добавляют суточную дозу 2—3 антибиотиков с разным механизмом и спектром действия, большую дозу глюкокортикоидов, ингибиторов протеаз, глюкозу и инсулин, увеличивают максимально оксигенацию перфузата. Операция во всех отношениях тяжелая, послеоперационная летальность около 20 %.
17.7. Хроническая ишемическая болезнь сердца
Атеросклеротическое поражение венечных артерий является прогрессирующим заболеванием. На ранней стадии развития липиды инкорпорируются в интиме, образуя атеросклеротические бляшки, окруженные фиброзной тканью. Это сопровождается постепенным сужением и уменьшением просвета коронарных артерий, а следовательно, и снижением кровоснабжения миокарда. В ряде случаев фиброзная ткань содержит отложения кальция. В более поздней стадии наступает разрыв ткани над бляшкой, изъязвление ее. Над поврежденной бляшкой образуется тромбоцитарный сгусток, дающий начало тромбу, дальнейшему уменьшению просвета артерий, инфаркту миокарда. По мере сужения венечных артерий наступает несоответствие между потребностью миокарда в кислороде и возможностями его доставки. В связи с этим возникают приступы стенокардии.
По статистическим данным, около одной трети населения умирает от атеросклеротического заболевания коронарных артерий. В начале ишемиче-ской болезни сердца преобладает спазм венечных артерий, сопровождающийся ишемическими болями при физической нагрузке (стенокардия напряжения) или в покое (стенокардия покоя). В последующем очень часто возникает инфаркт миокарда.
Атеросклеротическое поражение венечных артерий может быть ограниченным или диффузным. Обтурация их просвета приводит к очаговой ишемии миокарда, которая может быть обратимой или необратимой (инфаркт миокарда). Важнейшим симптомом ишемии являются загрудинные боли, стенокардия.
Клиническая картина и диагностика. Больных беспокоят приступы загру-динных болей, которые прекращаются после приема нитроглицерина; нарушение ритма, приступы сердцебиения. Клинические проявления весьма вариабельны. Согласно классификации Нью-Йоркской сердечной ассоциации (NYHA), тяжесть загрудинных болей и течения хронической ишемиче-ской болезни сердца подразделяют на четыре класса. I класс — отчетливых симптомов болезни нет; II класс — появление стенокардии после тяжелой физической нагрузки; III класс — появление стенокардии после легкой физической нагрузки; IV класс — стенокардия в покое. Пациенты, отнесенные к I—II классу, не испытывают тяжких приступов стенокардии, болезнь не мешает им вести нормальный образ жизни (стабильная стенокардия). В случае нарастания класса болезни в течение короткого периода времени имеется основание говорить о прогрессирующей стенокардии, которая существенно ухудшает прогноз. В поздней стадии ишемия возникает в покое и становится рефрактерной к применяемому медикаментозному лечению (неста-
497
бильная стенокардия). Прогноз при этой стадии болезни существенно ухудшается, возникает опасность инфаркта или внезапной смерти. У значительной части больных болезнь развивается не по приведенным классам, а может сразу проявиться инфарктом или внезапной смертью. Иногда наблюдается бессимптомная ишемия миокарда, тогда болезнь распознается только в поздней стадии.
Важную информацию дает электрокардиограмма, полученная в покое и при дозированной физической нагрузке на велоэргометре. Анализ электрокардиограммы позволяет определить выраженность и локализацию (очаги) ишемии миокарда, степень нарушения проводимости, характер аритмии.
Большое значение имеет цветное ультразвуковое допплерографическое и эхокардиографическое исследование. Оно позволяет определить изменения сократительной способности миокарда. По характеру движений стенок желудочков сердца можно выявить очаг и распространенность ишемии миокарда по зонам гипокинезии, акинезии или дискинезии в зоне, снабжаемой суженной ветвью венечной артерии. Замедление скорости движения стенок желудочка при сокращении миокарда называют гипокинезией, отсутствие движения стенки желудочка — акинезией. При аневризме сердца в момент сокращения непораженного миокарда рубцово-измененный участок выпячивается (дискинезия). Эхокардиографическое исследование позволяет определить систолический, конечно-диастолический и остаточный объемы левого желудочка, фракции выброса, минутный объем и сердечный индекс и другие показатели гемодинамики. Наиболее точную информацию о состоянии коронарного кровообращения дает магнитно-резонасная томография.
Для уточнения степени и локализации сужения венечных артерий, состояния периферического и коллатерального кровообращения в сердечной мышце производят селективную коронарографию, в том числе кинорентгенографию. Это важно для определения локализации и протяженности сужения перед и во время операции.
Радионуклидные исследования позволяют уточнить обширность очага поражения миокарда по степени накопления нуклида в миокарде.
Прогрессирующее сегментарное сужение венечных артерий неизбежно приводит к инфаркту миокарда. Судьба больного зависит от обширности и локализации инфаркта, степени нарушения функции сердца и внутренних органов.
Лечение. Хирургическое лечение показано при стенозе главного ствола левой коронарной артерии на 75 %, при стенозе 2—3 ветвей артерии и клинических проявлениях по III—IV классу NYHA, снижении фракции выброса левого желудочка менее 50 %.
Неотложным показанием к операции реваскуляризации миокарда является нестабильная "предынфарктная ангина", не поддающаяся консервативному лечению, а также резко выраженный стеноз левой венечной артерии, стеноз проксимального участка передней межжелудочковой ветви левой венечной артерии, так как закупорка их сопровождается обширным инфарктом миокарда. При стабильной стенокардии, поддающейся медикаментозному лечению, операцию производят в плановом порядке. Результатом операции является восстановление коронарного кровообращения, у 80—90 % больных после операции исчезают явления стенокардии, резко снижается опасность возникновения инфаркта миокарда.
Основным способом хирургического лечения атеросклеротических поражений венечных артерий является аортокоронарное шунтирование (bypass — байпас). Операция заключается в создании одного или нескольких анасто-
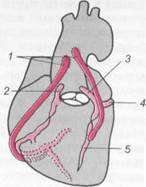 Рис. 17.6. Аортокоронарное шунтирование.
Рис. 17.6. Аортокоронарное шунтирование.
I — аортокоронарное шунтирование веной; 2 — правая коронарная артерия; 3 — левая коронарная артерия; 4 — огибающая ветвь (ramus cir-cumflexus); 5 — межжелудочковая ветвь (ramus interventricularus).
мозов между восходящей аортой и венечной артерией и ее ветвями дистальнее места окклюзии (рис. 17.6). В качестве шунта используют участок вены голени (v. saphena magna). В 1964 г. В. И. Ко-лесов впервые сделал анастомоз между внутренней грудной и коронарной артерией ниже ее сужения (коронарно-маммарный анастомоз). Эта операция при определенных показаниях производится в ряде учреждений. В настоящее время мобилизованные участки артерий (a. thoracica interna, a. epigastrica и др.) нередко используются для ангиопластики. По ряду показателей ангиопластика с применением артерии превосходит аортокоронарное шунтирование с применением сегмента вены. Предпосылками для успешной реваскуляризации миокарда являются: 1) стеноз венечных артерий (50 % и более) при хорошей проходимости их периферических отделов; 2) достаточный диаметр (не менее 1 мм) периферического участка венечных артерий; 3) сохранение сократительной способности миокарда ("живой" миокард) дистальнее стеноза артерий.
В последние годы с развитием эндоваскулярной рентгенохирургии для лечения сужений венечных сосудов стали применять их дилатацию с помощью специальных зондов с баллонами, которые вводят в просвет артерии. Наполняя баллон контрастным веществом, добиваются растяжения суженного сегмента просвета артерии и восстановления ее проходимости. Достигнутый при дилатации успех можно закрепить установкой стента.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|