
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Практические занятия № 27-28.. Тема: «Получение и свойства оксида хрома (III), гидроксида хрома (III). Свойства хроматов и дихроматов; исследование окислительных свойств хроматов».. I. Теоретическая часть.
Практические занятия № 27-28.
Тема: «Получение и свойства оксида хрома (III), гидроксида хрома (III). Свойства хроматов и дихроматов; исследование окислительных свойств хроматов».
Цели занятия:
- обобщить и систематизировать знания общей характеристики элементов
- VIВ группы, исходя из положения в периодической системе, с точки зрения теории строения атома, степени окисления, получения и исследования химических свойств.
- исследовать особенности свойств соединений хрома: амфотерный характер гидроксида хрома (III), окислительные свойства соединений хрома(VI).
- приобрести навыки выполнения опытов, характеризующих химические свойства соединений хрома.
- совершенствовать навыки:
- составления уравнений окислительно - восстановительных реакций;
- получения и исследования амфотерных свойств гидроксидов .
I. Теоретическая часть.
Побочная подгруппа VI группы представлена хромом, молибденом, вольфрамом и сиборгием.
Конфигурация валентных электронов у d-элементов Сг и Мо-(п- 1 )d5ne1, у W — 5d46s2, у Sg — 6d47s2.
Максимальная ковалентность равна шести, максимальная степень окисления +6. От хрома к вольфраму радиусы атомов возрастают, хотя и незначительно. Энергия ионизации также растет в результате проявления эффекта d- f - сжатия, поэтому активность металлов от хрома к вольфраму падает.
Соединения хрома, молибдена и вольфрама. Для хрома наиболее характерны соединения со степенями окисления + 2, + 3 и + 6.
Соединения хрома(II) получают в лаборатории из соединений хрома (III) действием сильного восстановителя в кислотной среде:
HCI
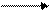 2CrCI3 + Zn 2СгСI2 + ZnCI2.
2CrCI3 + Zn 2СгСI2 + ZnCI2.
Оксид хрома(II) СгО — твердое вещество ярко-красного цвета, имеет хорошо выраженный основный характер, поэтому взаимодействует с кислотами, образуя соли хрома(II), которые превращаются в соли хрома(III):
СгО + 2НСI = СгСI2 + Н2O;
4СrСI2 + O2 + НСI = 4СгСI3 + 2Н2O.
Аналогично и сам СгО легко окисляется на воздухе при нагревании:
4СrO + O2 = 2С r2O3.
Оксид хрома(II) образуется при окислении амальгамы хрома кислородом воздуха:
2Cr (амальгама) + O2 =2CrO
Гидроксид хрома(II) Сг(ОН)2 — вещество желтого цвета, плохо растворимое в воде. Он имеет ярко выраженный основный характер, а потому взаимодействует с кислотами:
Cr(OH)2 + H2SO4 = CrSO4 + 2Н2O.
Как и оксид, гидроксид хрома(II) легко окисляется в гидроксид хрома(III):
4Сr (ОН)2 + O2 + 2Н2O = 4Сг(ОН)3.
Соли хрома(II) в растворе окрашены в ярко-голубой цвет. Все они также являются сильными восстановителями. При доступе воздуха они легко переходят в соединения хрома(III).
Оксид хрома(III) Сг2O3 — порошок темно-зеленого цвета, нерастворимый в воде. Он имеет амфотерный характер, однако в кислотах и щелочах растворяется плохо. Поэтому для реакции с щелочами его сплавляют с ними:
t
Cr2O3 + 2КОН = 2КСгO2 + Н2O.
С концентрированными растворами щелочей и кислот он взаимодействует с трудом:
t
Cr2O3 + 6NaOH + ЗН2O = 2Na3[Cr(OH)6];
t
Cr2O3 + 6НСI = 2СгСI3 + ЗН2O.
 Гидроксид хрома(III) Сг(ОН)3 получают при действии щелочей на растворы солей хрома(III). Он образует серо-зеленый осадок.
Гидроксид хрома(III) Сг(ОН)3 получают при действии щелочей на растворы солей хрома(III). Он образует серо-зеленый осадок.
СгСI3 + 3NaOH = Cr(OH)3 + 3NaCI.
Щелочь надо брать в недостатке, так как полученный гидроксид, в отличие от соответствующего оксида, легко взаимодействует не только с кислотами, но и с щелочами, т. е. проявляет амфотерные свойства:
Cr(OH)3 + 3HNO3 = Cr(NO3)3 + 3H2O;
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6].
 Соли хрома(III) легко подвергаются гидролизу, причем при добавлении карбонатов взаимный гидролиз усиливается и образуется осадок Сг(ОН)3:
Соли хрома(III) легко подвергаются гидролизу, причем при добавлении карбонатов взаимный гидролиз усиливается и образуется осадок Сг(ОН)3:
Cr2(SO4)3 + 3Na2CO3 + 3H2O = 2Сг(ОН)3 + 3Na2SO4 + ЗСO2
Сульфат хрома(III) вместе с сульфатами калия, аммония или рубидия может кристаллизоваться в виде хромовых квасцов, например KCr(SO4)2 • 12Н2O.
Квасцы применяют в кожевенном производстве для дубления кож.
Соединения хрома +3 устойчивы и проявляют очень слабые и восстановительные, и окислительные свойства. В кислотной среде хром +3 восстанавливается до хрома +2 сильными восстановителями, а в щелочной среде Сг3+ может окисляться до хрома +6:
2Na[Cr(OH)4] + 3Br2 + 8NaOH = 2Na2Cr04 + 6NaBr + 8Н2O.
При этом зеленая окраска тетрагидроксохромата(III) натрия переходит в лимонно-желтую окраску хромата натрия.
Оксид хрома(VI) СгO3 — темно-красное кристаллическое вещество, хорошо растворимое в воде. При растворении в воде он образует хромовые кислоты. Наиболее простой по составу является хромовая кислота Н2СгO4. При добавлении оксида хрома(VI) или при увеличении кислотности среды хромовая кислота способна полимеризоваться, образуя дихромовую Н2Сг2O7, а затем трихромовую Н2Сг3О10 и другие полимерные кислоты:
2CrO2-4+ 2Н+ = Сг2O2-7 + Н2O.
В щелочной среде полимеры разрушаются. Например, из дихроматов образуются хроматы:
Сг2O2-7 + 2OН- = 2СгО2-4+ Н2O.
Хромовые кислоты — сильные электролиты.
Все соединения хрома +6 проявляют свойства сильных окислителей. Особенно сильным окислителем является оксид хрома(VI). Он энергично взаимодействует с органическими веществами:
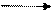 С2Н5ОН + 4СгO3 2СO2 + 2Сг2O3 + ЗН2O.
С2Н5ОН + 4СгO3 2СO2 + 2Сг2O3 + ЗН2O.
Хроматы и дихроматы также являются сильными окислителями, особенно в кислотной среде. При этом они превращаются в соединения хрома +3.
Cr2O2-7 + 14Н+ + 6ё = 2Сг3+ + 7Н2O.
При добавлении раствора сульфита натрия к подкисленному раствору дихромата калия оранжевая окраска раствора изменяется на зеленую, характерную для соединений хрома(III):
К2Сг2O7 + 3Na2SO3 + 4H2SO4 =
= Cr2(SO4)3 + 3Na2SO4 + K2SO4 + 4H2O.
Дихроматы калия и натрия применяют для дубления кож, в качестве протравы при крашении и печатании тканей, как окислители в производстве красителей, как компоненты состава спичек, в качестве ингибиторов коррозии металлов и сплавов, а также в качестве окислителей в гальванических элементах.
Для молибдена и вольфрама наиболее характерны соединения со степенью окисления +6. Они образуют высшие оксиды МоО3 и WO3, которым соответствуют кислоты Н2МоО4 и H2WO4. Сила кислот убывает от хрома к вольфраму, как и в других подгруппах периодической системы Д. И. Менделеева.
Контрольные вопросы и задачи:
1. Написать электронные формулы атомов хрома и молибдена. Объяснить, почему в основном состоянии хром и молибден имеют электронные конфигурации (n-1) d5ns1, а не (n-1) d4ns2.
2. Определить степень окисления хрома в соединениях: Cr2O3, BaCrO4, CaCr2O7
3. Написать в молекулярной и ионной форме уравнения реакций взаимодействия гидроксида хрома (III):
А) с раствором серной кислоты;
Б) с раствором гидроксида натрия
4. Какие продукты практически получаются при гидролизе сульфата и сульфида хрома (III) в разбавленных водных растворах при комнатной температуре. Написать уравнения соответствующих реакций. Что следует добавить в раствор сульфата хрома, чтобы ослабить гидролиз этой соли?
5. Почему при взаимодействии растворов Cr2 (SO4)3 и (NH4)2S в осадок выпадает гидроксид хрома (III)? Написать уравнение реакции.
6. Как получить из оксида хрома (III):
а) хромит калия; б) хромат калия
7. Указать, какие ионы существуют в водных растворах солей хрома (III) и хрома (VI): а) при рН < 7; б) при рН > 7. Привести примеры соответствующих соединений и уравнения их диссоциации.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|