
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Механизм действия буфера.
Фосфатнаябуферная система представляет собой сопряженную кислотно-основную пару, состоящую из иона Н2РО4– (донор протонов) и иона НРО42– (акцептор протонов)
Во внеклеточной жидкости, в том числе в крови, соотношение [НРО42–]: [Н2РО4–] составляет 4: 1. Величина рКН2РО4– равна 6, 86.
Буферное действие фосфатной системы основано на возможности связывания водородных ионов ионами НРО42– с образованием Н2РО4– (Н+ + + НРО42– —> Н2РО4–), а также ионов ОН– с ионами Н2РО4– (ОН– + + Н2 Р О4– —> HPO42–+ H2O). Органические фосфаты также обладают буферными свойствами, но мощность их слабее, чем неорганического фосфатного буфера.
Механизм действия буфера.
1. При поступлении в кровь кислых продуктов Н+ связываются НРО4 2- из Na2HPO4. Избыток удаляется почками. Na2HPO4 ↔ Na2 + HPO4 2- Н+ + HPO4 2- = Н2PO4
2. При поступлении в кровь оснований избыток ОН- нейтрализуется Н+ из NaH2PO4, образуется вода. NaH2PO4 ↔ Na2HPO4 Действие фосфатного буфера контролируется выделительной функцией почек. При ее нарушении происходит задержка кислых фосфатов в организме.
Фосфатная буферная система способна поддерживать постоянство рН в интервале 6, 2-8, 2 и обеспечивает значительную долю буферной емкости крови.
Для фосфатной буферной системы уравнение Гендерсона-Гассельбаха выглядит так:
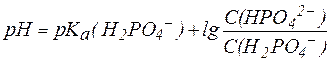 .
.
Подставив физиологическое значение 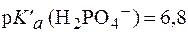 и значение рН крови в норме, равное 7, 4, получим:
и значение рН крови в норме, равное 7, 4, получим:
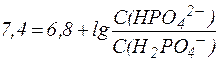 .
.
Отсюда:
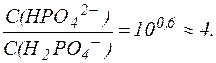


|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|