
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
степень окисления +3. степень окисления +5. степень окисления +7
ОПРЕДЕЛЕНИЕ
Галогены (от греч. halos - соль и genes - образующий) - элементы главной подгруппы VII группы периодической системы: фтор, хлор, бром, йод, астат.
С возрастанием порядкового номера элементов увеличиваются радиусы атомов, уменьшается электроотрицательность, ослабевают неметаллические свойства (увеличиваются металлические свойства); галогены - сильные окислители, окислительная способность элементов уменьшается с увеличением атомной массы.
В основном состоянии (невозбужденном) атомы галогенов имеют электронную конфигурацию:
ns2np5
Имея на внешнем уровне 7 электронов, атомы галогенов стремятся присоединить еще один электрон для достижения устойчивой конфигурации внешнего уровня (" правило октета" ).
 При этом на внешнем уровне находится один неспаренный электрон, валентность = I. Например, HBrI, HClIO. При этом галогены могут проявлять две степени окисления +1 и -1 :
При этом на внешнем уровне находится один неспаренный электрон, валентность = I. Например, HBrI, HClIO. При этом галогены могут проявлять две степени окисления +1 и -1 :
Hal0− e¯ → Hal+
Hal0+e¯ → Hal−
В возбужденном состоянии происходит " распаривание" валентных электронов:
ns2np4nd1
валентность = III,
степень окисления +3
ns2np3nd2
валентность = V,
степень окисления +5
ns1np3nd3
валентность = VII,
степень окисления +7
Запомнить! Фтор является самым электроотрицательным, поэтому может проявлять единственную степень окисления -1. Атом фтора, элемента второго периода, не имеет d-орбиталей, поэтому не переходит в возбужденное состояние и проявляет только валентность I.
Все вышесказанное можно обобщить в таблицу:
| № | Конфигурация валентого уровня | Возможные степени окисления | Валентность | Изменение свойств ↓ | |
| F | 2s22p5 | -1, 0 | I | Радиус увеличивается Электроотрицательность(ЭО) уменьшается Окислительные свойства уменьшаются | |
| Cl | 3s23p5 | -1, 0, +1, +3, +5, +7 | I, III, V, VII | ||
| Br | 4s24p5 | ||||
| I | 5s25p5 |
В качестве примеров рассмотрим структурные формулы некоторых соединений хлора:


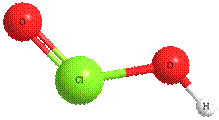
соляная кислота HCl оксид хлора(I) Cl2O хлористая кислота HClO2
ст. ок. =-1 ст. ок. =+1 ст. ок. =+3
валентность=I валентность=I валентность=III
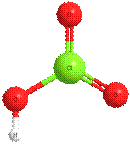

хлорноватая кислота HClO3 оксид хлора(VII) Cl2O7
ст. ок. =+5 ст. ок. =+7
валентность=V валентность=VII
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|