
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Таблица №3: «Изопроцессы в газах» (П.27)
Идеальный газ – это газ, взаимодействия между молекулами которого пренебрежимо малы.
Газовые законы – количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра.
Изопроцессы – процессы, протекающие при неизменном значении одного из параметров.
Связь абсолютной температуры Т с температурой по шкале Цельсия t: Т= t+273
| Процесс | Название закона | Постоянный параметр | Связь между другими параметрами | График изопроцесса | Формулировка закона |
| 1. Изотермический - процесс, происходящий с газом данной массы при постоянной температуре.. | Закон Бойля – Мариотта (1666) | m – const T – const | pV- const или р ~ 1 V или p1V1= p2V2 | 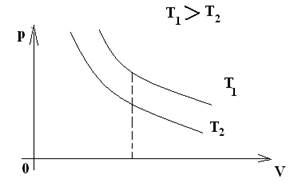 Изотерма
Изотерма
| Для газа данной массы произведение давления газа на его объем постоянно, если температура газа не меняется. |
| 2. Изобарный – процесс, происходящий с газом данной массы при постоянном давлении. | Закон Гей-Люссака (1802) | m – const р – const | V= V0(1+α V t) V~Т или V1 = V2 Т1 Т2 или V -const Т | 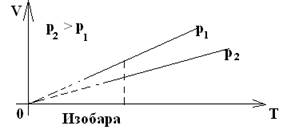
| Для газа данной массы отношение объема к температуре постоянно, если давление газа не меняется. |
| 3. Изохорный - процесс, происходящий с газом данной массы при постоянном объеме. | Закон Шарля (1787) | m – const V – const | p= p0(1+α p t) р~Т или р1 = р2 Т1 Т2 или р – const Т | 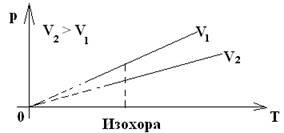
| Для газа данной массы отношение давления к температуре постоянно, если объем газа не меняется. |
Уравнение Клапейрона: для газа данной массы: р V - const
Т
Следствия закона Авогадро: р V = кN, р=nкТ, где к- постоянная Больцмана, к = 1, 38*10-23 Дж/К
Т
Уравнение состояния газа: Уравнение Менделеева - Клапейрона: рV = m RТ, где R=8, 31Дж/(моль*К) - универсальная газовая постоянная М
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|