
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Получение оснований. Химические свойства. Амфотерный оксид. Амфотерное основание. Кислота
Получение оснований
- Растворимых оснований:
1. Взаимодействием щелочных и щелочноземельных металлов с водой
2Na + 2HOH à 2NaOH + H2↑
Ca + 2HOH à Ca(OH)2 + H2↑
2. Взаимодействием оксидов щелочных и щелочноземельных металлов с водой
Na2O + H2O à 2NaOH (Na2O · H2O)
BaO + H2O à Ba(OH)2 (BaO · H2O)
- Нерастворимых оснований:
1. Взаимодействием щелочей с растворимыми солями металлов
2NaOH + CuSO4 à Cu(OH)2↓ + Na2SO4
2KOH + ZnCl2 à Zn(OH)2↓ + 2KCl
Химические свойства
Общие свойства оснований объясняются наличием в их растворах анионов OH-, которые образуются в результате электролитической диссоциации молекул оснований:
Me(OH)y ↔ Mey+ + yOH-
1. Водные растворы щелочей изменяют окраску индикаторов
|
Индикатор | Цвет индикатора в среде | ||
| Щелочной (pH > 7) | Нейтральной (pH = 7) | Кислой (pH < 7) | |
| Универсальная индикаторная бумага | Синий | Желтый | Красный |
| Лакмус | Синий | Фиолетовый | Красный |
| Фенолфталеин | Малиновый | Бесцветный | Бесцветный |
| Метиловый оранжевый | Желтый | Оранжевый | Розовый |
2. Взаимодействуют с кислотами с образованием соли и воды
NaOH + HCl à NaCl + HOH
Cu(OH)2 + H2SO4 à CuSO4 + 2HOH
3. Взаимодействуют с кислотными оксидами с образованием соли и воды
2NaOH + SO2 à Na2SO3 + H2O
Ca(OH)2 + CO2 à CaCO3 + H2O
4. Растворы щелочей взаимодействуют с растворами солей при образовании нерастворимого основания или нерастворимой соли
2NaOH + CuSO4à Cu(OH)2↓ + H2O
Ba(OH)2 + Na2SO4 à BaSO4↓ + 2NaOH
5. Нерастворимые основания при нагревании разлагаются на основной оксид и воду
to
Cu(OH)2 à CuO + H2O
6. Растворы щелочей взаимодействуют металлами, которые образуют амфотерные оксиды и гидроксиды:
Zn + 2NaOH à Na2ZnO2 + H2↑
цинкат натрия
2Al + 2KOH + 6H2O à 2K[Al(OH)4] + 3H2↑
тетрагидроксоалюминат калия
7. Растворы щелочей взаимодействуют амфотерными оксидами:
ZnO + 2NaOH à Na2ZnO2 + H2O
цинкат натрия
Al2O3 + 2KOH à 2KAlO2 + H2O
алюминат калия
8. Щелочи взаимодействуют амфотерными гидроксидами:
a. в расплаве
Al(OH)3 + KOH à KAlO2 + 2H2O
алюминат калия
б. в растворе
Al(OH)3 + KOH à K[Al(OH)4]
9. Щелочи взаимодействуют с неметаллами:
2NaOH + Cl20 à NaCl-1 + NaCl+1O + H2O
Ме
+O2
| амфМе
+O2 Амфотерный оксид
Амфотерное основание | неМе
+O2
+H2O Кислота | |||||||||||||||||||||||||||||||||
|
Соли | |||||||||||||||||||||||||||||||||||
| НЕМЕТАЛЛ | НЕМЕТАЛЛ | |||
 ТИПИЧНЫЙ МЕТАЛЛ
«АМФОТЕРНЫЙ» МЕТАЛЛ» ТИПИЧНЫЙ МЕТАЛЛ
«АМФОТЕРНЫЙ» МЕТАЛЛ»
| МЕТАЛЛ | ||||
 ОСНОВНОЙ ОКСИД
АМФОТЕРНЫЙ ОКСИД
КИСЛОТНЫЙ ОКСИД ОСНОВНОЙ ОКСИД
АМФОТЕРНЫЙ ОКСИД
КИСЛОТНЫЙ ОКСИД
| ОКСИД | ||||
 ОСНОВНОЙ (ОСНОВАНИЕ)
АМФОТЕРНЫЙ ГИДРОКСИД
КИСЛОТНЫЙ (КИСЛОТА) ОСНОВНОЙ (ОСНОВАНИЕ)
АМФОТЕРНЫЙ ГИДРОКСИД
КИСЛОТНЫЙ (КИСЛОТА)
| ГИДРОКСИД | ||||
| СОЛЬ | СОЛЬ |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|
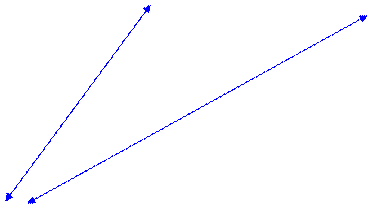

 Основной оксид
Основной оксид  +H2O
+H2O (-H2O)
(-H2O) Основание
Основание 

 +H2O
+H2O Кислотный оксид
Кислотный оксид 


 ОСНОВАНИЕ
ОСНОВАНИЕ