
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ЭКЗАМЕНАЦИОННЫЕ ЗАДАНИЯ ПО ХИМИИ
1. Осуществите превращения:
Cr → Cr2O3 → Cr2(SO4)3 → Cr(OH)3 → CrCl3
↓
Cr(NO3)3
2. Осуществите превращения:
Si → SiO2 → Na2SiO3 → H2SiO3
↓
SiH4
3. Методом электронного баланса расставить коэффициенты:
KMnO4 + Na2SO3 + KOH = K2MnO4 + Na2SO4 + H2O
4. С какими из перечисленных веществ будет вступать в реакцию cоляная кислота? Напишите уравнения соответствующих реакций. Pt, Fe, MgO, NaCl, KOH.
5. Определите, как изменится скорость химической реакции при изменении температуры от 0° С до 30° С, если ɤ =2.
6. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) CuSO4 и Н2S; б) ВаСO3 и НNO3; в) FeCl3 и КOH.
7. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
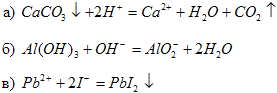
8. Выпишите формулы оксидов, кислот, оснований и солей из предложенного списка веществ:
Na, Na2O2, Na2CO3, NaNO3, Ca, CaO, Ca(OH)2, Ca(H2PO4)2, Ca3(PO4)2, NH3, (NH4)2SO4, NO, NO2, HNO3, NaNO3, H2S, S, SO2, NaHSO3, NaBr, Cl2, KClO3.
9. Дайте характеристику химической реакции, расставьте коэффициенты:
Na + H2O = H2 + NaOH + Q
тв ж г ж
10. Напишите уравнения реакций взаимодействия 2-метилбутена-2 и следующих веществ: хлор, бромоводород, водород, вода.
11. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Br2, свет КОН, спирт НBr Na
СН3 – СН2 – СН(СН3) – СН3 Х1 Х2 Х1 Х3 → СО2
12. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
С6Н12О6→ С2Н5ОН→ CH3-CHO→ CH3-COOH→ ClCH2-COOH → NH2CH2 -COOH
13. Напишите уравнения реакций взаимодействия 2-метилбутаналя и следующих веществ: оксид серебра, гидроксид меди, водород.
14. Составьте уравнения реакций, которые надо провести для осуществления следующих превращений: Cu → Cu(NO3)2 → Cu(OH)2 → CuCl2.
15. Вычислите массу хлорида натрия и воды, необходимых для приготовления 500 г раствора, в котором массовая доля NaCl 5%.
16. Вычислите по термохимическому уравнению реакции количество теплоты, выделяющейся при сгорании 1 кг серы.
S + O2 = SO2 + 297 кДж
17. Какую массу Na2CO3 необходимо взять для приготовления 20 мл раствора с молярной концентрацией 0, 1 моль/л?
18. Вычислите объем хлора, который потребуется для реакции с водородом объемом
22, 4 л.
19. Вычислите объем водорода, выделившегося при взаимодействии метанола (СН3ОН) с натрием массой 9, 2 г.
20. Какое вещество и сколько его выпадает в осадок при взаимодействии 50 г 20%-ного раствора FeCl3 с раствором КОН?
21. Какой объем кислорода потребуется для полного сгорания 0, 056 л водорода?
22. Укажите вид химической связи в молекулах веществ: HNO3, Cr2O3, Na2SiO3, K2MnO4, SiO2, H2, Na, СО2, SO3. Определите степень окисления элементов.
23. Сколько грамм метана (СН4) необходимо сжечь для получения 5 моль углекислого газа?
24. 200 г этилового спирта (С2Н5ОН), содержащего 4% примесей, нагрели с концентрированной серной кислотой. Какой объем этилена (С2Н4) образовался при этом?
25. Вычислите массу KCl, необходимую для приготовления раствора объемом 25 мл с молярной концентрацией 0. 2 моль/л.
26. Какова масса Н2, выделившегося при взаимодействии цинка с раствором соляной кислоты массой 50 г, массовая доля HCl в котором 10%?
27. Методом электронного баланса расставить коэффициенты:
KMnO4 + Na2SO3 + Н2О = MnO2 + Na2SO4 + КОН
28. Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
Fe → FeO → FeCl2 → Fe(OH)2 → FeSO4
↓
Fe(NO3)2
29. Какой объем сероводорода образуется при взаимодействии 39 г сульфида железа (II), содержащего 20% примесей, с избытком соляной кислоты?
30. Вычислите массовую долю вещества в растворе азотной кислоты, если известно, что 100 г этого раствора полностью прореагировали с 8 г гидроксида натрия.
31. Найдите молекулярную формулу вещества, содержащего 85, 71% углерода и 14, 29% водорода, если относительная плотность паров этого вещества по воздуху 1, 448.
32. Установите формулу неорганического соединения, содержащего 20% магния, 53, 33% кислорода и 26, 67% серы.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|