
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Практическая работа №2. Ход работы
Практическая работа №2
Тема Получение, собирание и распознавание газов (аммиак, углекислый газ) Цель: научиться получать и распознавать газы (аммиак, углекислый газ); ознакомиться со свойствами водного раствора аммиака и свойствами углекислого газа. Оборудование: лабораторный штатив, пробирки, пробка с газоотводной трубкой, ступка, ложки для сыпучих веществ, спиртовка, спички, стакан с водой, прибор для получения метана и углекислого газа. Реактивы: кристаллический гидроксид кальция, кристаллический хлорид аммония, лаксмусовая бумага, мрамор(мел), хлороводородная кислота, известковая вода.
С правилами техники безопасности ознакомлен(а) и обязуюсь их выполнять (подпись)
Ход работы
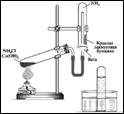 Опыт 1. Получение аммиака и исследование егосвойств Получаем аммиак нагреванием смеси гидроксида кальция и хлорида аммония в пробирке. Собираем аммиак в пробирку, перевёрнутую вверх дном. К пробирке с аммиаком подносим лакмусовую бумагу. Наблюдаем изменение её цвета. Написать соответствующее уравнение реакции. 1. Окислительно-восстановительные свойства аммиака. На основе электронного баланса написать уравнение реакции, определить окислитель и восстановитель: горение аммиак. Какие вещества образуются в процессе горения аммиака?
Опыт 1. Получение аммиака и исследование егосвойств Получаем аммиак нагреванием смеси гидроксида кальция и хлорида аммония в пробирке. Собираем аммиак в пробирку, перевёрнутую вверх дном. К пробирке с аммиаком подносим лакмусовую бумагу. Наблюдаем изменение её цвета. Написать соответствующее уравнение реакции. 1. Окислительно-восстановительные свойства аммиака. На основе электронного баланса написать уравнение реакции, определить окислитель и восстановитель: горение аммиак. Какие вещества образуются в процессе горения аммиака?
Опыт 2. Получение углекислого газа и исследование его свойств Получаем 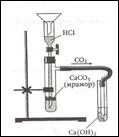 углекислый газ соединением мрамора с хлороводородной кислотой. Собираем прибор для получения углекислого газа и собираем его в пробирку методом вытеснения воздуха. Для определения углекислого газа пользуемся горящей лучиной. Что происходит с лучиной в атмосфере углекислого газа? Написать соответствующее уравнение реакции. 1. Кислотно-основных свойства водного раствора оксида углерода (IV). Взаимодействие известковой водой. В стакан с водным раствором СО2 добавляем лакмус. Конец газоотводной трубки помещаем в пробирку с известковой водой и пропускаем через нее углекислый газ. Продолжаем пропускать углекислый газ через мутную смесь до полного осветления раствора. В какой цвет окрасился лакмус? Запишите уравнение реакции взаимодействия оксида углерода (IV) с водой.
углекислый газ соединением мрамора с хлороводородной кислотой. Собираем прибор для получения углекислого газа и собираем его в пробирку методом вытеснения воздуха. Для определения углекислого газа пользуемся горящей лучиной. Что происходит с лучиной в атмосфере углекислого газа? Написать соответствующее уравнение реакции. 1. Кислотно-основных свойства водного раствора оксида углерода (IV). Взаимодействие известковой водой. В стакан с водным раствором СО2 добавляем лакмус. Конец газоотводной трубки помещаем в пробирку с известковой водой и пропускаем через нее углекислый газ. Продолжаем пропускать углекислый газ через мутную смесь до полного осветления раствора. В какой цвет окрасился лакмус? Запишите уравнение реакции взаимодействия оксида углерода (IV) с водой.
Вывод.
Дополнительный материал:
NH3 – аммиак; Са(ОН)2 – гидроксид кальция; NH4Cl – хлорид аммония; СаCl2 – хлорид кальция;
СаСО3 – мрамор(мел); HCl – хлороводородная кислота; СаCl2 – хлорид кальция;
H2 СО3– угольная кислота; СО2 – оксид углерода(IV)
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|