
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Министерство науки и высшего образования Российской Федерации
Министерство науки и высшего образования Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
высшего образования
«Российский химико-технологический университет
имени Д. И. Менделеева»
| Направление подготовки 05. 03. 06 Экология и природопользование | Институт химии и проблем устойчивого развития Кафедра ЮНЕСКО «Зеленая химия для устойчивого развития» |
ОТЧЕТ
о прохождении производственной практики:
научно – исследовательская работа
Методы полимеризации элементного фосфора
| Место проведения практики | РХТУ имени Д. И. Менделеева |
| Период проведения практики | февраль-май, 2022 |
| Оценка _________________________ Основные замечания _________________________ |
| Зав. кафедрой ЮНЕСКО «Зеленая химия для устойчивого развития» д. х. н., профессор | Н. П. Тарасова |
| Руководитель практики | |
| к. х. н., доцент кафедры ЮНЕСКО «Зеленая химия для устойчивого развития» | А. А. Занин |
| Студент гр. ПР-41 | Е. М. Костин |
Москва, 2022
Содержание:
Введение……………………………………………………………. …………….. 4
1. Литературный обзор………………………... …………. ………………………. 5
1. 1 Простое вещество………………………….. …………. ……………………... 4
1. 2. Физические свойства.. …………………. ……. ….. ………………………….. 7
1. 2. 1 Белый фосфор…………………………... ……….... ……………………. …. 7
1. 2. 2Красный фосфор…………………………………... …………. ……………. 8
1. 2. 3 Черный фосфор………………………………... ……………………………8
1. 3 Способы получения красного фосфора……….. ………………......... …. …. 10
1. 3. 1 Радиационные способы. ………………………………... …………………10
1. 3. 2 Другие способы получения……………………………….... ……………. 16
1. 4 Недостатки способов получения красного фосфора………………………19
1. 5 Химические свойства……………………………………………………….. 20
1. 5. 1 Кислоты………………………………………….. ……………………... …22
1. 5. 2 Полимерные кислоты…………………………….. ………. ………………24
1. 5. 3 Фосфорорганические полимеры……………………... ……... …………... 26
1. 6Применение фосфора………………………………... ……. ……………….. 27
1. 7 Круговорот фосфора в природе……………... ……………. ………………. 28
1. 8 Производство соединенийфосфора…………………………….. …………30
1. 8. 1 Производство фосфорных удобрений……………………………………30
1. 8. 2 Производство фосфорной кислоты………………………………………. 32
1. 9. Технология переработки отходов фосфора и фосфорной кислоты……... 36
Вывод...................................................................................................................... 43
Список литературы………………………………………………………………44
Введение
Данная научно-исследовательская работа напрямую связана с 12-ой целью устойчивого развития: обеспечение перехода к рациональным моделям потребления и производства. К 2050 году количество людей в мире, принадлежащих к среднему классу, вырастет на 2-3 миллиарда. С одной стороны, это хорошие новости для благополучия отдельных людей, но это приведет и к увеличению спроса на различную продукцию, на производство которой нужны и без того ограниченные природные ресурсы. Если мы не примем меры для изменения моделей потребления и производства, то нанесём непоправимый ущерб планете. Уже сегодня спрос на природные ресурсы превышает возможности нашей планеты по их восстановлению: ежегодно мы используем ресурсы, для восстановления которых требуется 1, 75 планеты Земля. Такой путь ставит под угрозу нынешнее и будущее развитие нашейэкономики. Поскольку человечество шагнуло очень далеко вперед в развитии, это так же затронуло и природные аспекты: ухудшение состояния окружающей среды, нарушение экосистем, истощение природных ресурсов.
Полимеризация фосфора - процесс, имеющий сложность операций для реализации, требующий высоких затрат энергии, денег, а также необходимостью строго соблюдать технику безопасности по работе с фосфором и охрану труда. Токсичность и взрывоопасность белогофосфоратак же создает проблемы для дальнейших преобразований.
Целью данной работы является составление литературного обзора по теме исследования.
Для достижения данной цели необходимо выполнить следующие задачи:
1) Проанализировать научную литературу по свойствам различных аллотропных модификаций элементной фосфора;
2) Проанализировать научную литературу по способам применения полимерной фосфора;
3) Проанализировать научную литературу по способам получения полимерной фосфора.
1. Литературный обзор
1. 1Простое вещество
Белый фосфор впервые был получен немецким алхимиком Хеннингом Брандтом в 1669 году. Является нестабильным, воскообразным, летучим веществом. При температуре 250− 300°C и без доступа воздухафосфор способен превращаться в красный фосфор, а при температуре ~200°C идавлении более 1200 МПа красный фосфор превращается в черный фосфор, который является еще более темным и плотным веществом, с металлическим блеском. Является р-элементом. Электронная формула 1s22s2p63s2p3. Имеет степени окисления -3, 0, +3, +5.

Рис. 1 Заполнение квантовых ячеек фосфора
Таблица 1
| Важнейшие характеристики | Фосфор |
| Атомная масса, г/моль | 30. 973762 |
| Радиус атома, пм | |
| Радиус иона, пм | 35(+5е); 212(-3е) |
| Энергия ионизации, кДж/моль | 1011, 2 |
| Плотность, г/см3 | 1, 82 (белый фосфор); 2, 4 (красный фосфор); 2, 69 (черный фосфор) |
| Структура решетки | кубическая |
| Параметры решетки, Å | 18, 800 |
| Молярная теплоемкость, Дж/(моль*К) | 21, 6 |
| Теплопроводность, Вт/(м*К) | 0, 236 при Т=300К |
1. 2Физические свойства
Таблица 2
| Тип фосфора | Плотность, г/см3 | Температура плавления, К | Температура кипения, К | Тип проводимости |
| Белый фосфор | 1, 8 | 317, 25 | 553, 15 | Диэлектрик |
| Красный фосфор | 2, 2 | 858, 15 – 883, 15 | - | Диэлектрик |
| Черный фосфор | 2, 7 | 823, 15 | - | Полупроводник |
1. 2. 1 Белый фосфор
Белый фосфор хранят в воде и при темноте (на свету может превратиться в красный фосфор). Очень мягкий, мягче, чем воск.
Формула белого фосфора – Р4. При комнатной температуре диссоциирует на 2Р2. Имеет тетраэдрическое строение молекул. Данное строение обуславливает легкоплавкость, высокую летучесть и хорошую растворимость в неполярных растворах. Длина связи = 221 пм, угол Р-Р-Р равен 600, что объясняет высокую реакционную способность.

Рис. 2 Строение молекулы Р4
Является очень ядовитым веществом. Фосфор способен попадать в организм через кожу и через вдыхаемые пары. При долгом воздействии белого фосфора на организм происходит хроническое отравление, сопровождающееся разрушением костей. Попадание фосфора на кожу оставляет тяжелый химический ожог.
Фосфор является аналогом азота, но наличие у фосфора есть d-орбитали делает соединения фосфора непохожими на соединения азота. Главным различием является образование донорно-акцепторных π -связей между фосфором и донорами электронных пар. Поэтому, при переходе от азота к фосфору прочность связи Э-Н уменьшается засчет увеличения радиуса атома, а Э-О увеличивается:
d(N-H) = 100. 8 пм d(N-O) ~ 126 пм
d(P-H) = 142 пм d(P-O) ~ 146 пм
Разность между длинами связей Э-О меньше, чем Э-Н вследствие донорно-акцепторного взаимодействия. Это так же подтверждают данные об эффективных зарядах:

Рис. 4 эффективные заряды азота и фосфора
Образование донорно-акцепторных связей объясняет интенсивное взаимодействие с кислородом, устойчивость и многообразие кислородосодержащих форм.
1. 2. 2 Красный фосфор
Красный фосфор является темно-красным, малолетучим, аморфным, кристаллическим веществом. Свойства красного фосфора зависят от способа получения красного фосфора. При температуре 4230С возгоняется до белого фосфора. На воздухе несамовозгорается, однако его легко поджечь. Красный фосфор не растворим во многих растворителях. Данный факт позволяет утверждать о его принадлежности к неорганическим полимерам. Классическое описание свойств красного фосфора приводит Д. Корбридж. По Корбриджу, красный фосфор -это множество форм фосфора, которые окрашены в красный цвет различной интенсивности. По устойчивости и активности красный фосфор находится между белой и черной формами.
1. 2. 3 Черный фосфор
Чёрный фосфор является наиболеетермодинамически и химически стабильной версиейэлементарного фосфора. Впервые был открыт американским физиком П. У. Бриджменомв 1914. Для проведения синтеза чёрного фосфора Бриджмен применил давление в 2⋅ 109 Па и температуру ~200 °С.

Рис. 5 кристаллическая решетка черного фосфора
Чёрный фосфор - чёрное вещество с металлическим блеском. Очень похож на графит, наощупь жирен, является полупроводником. Поджечь чёрный фосфор можно, только предварительно сильно раскалив в атмосфере чистого кислорода до 400 °С. Т плавления = 1000 °С под давлением 1, 8⋅ 106 Па.
Стекловидный серый фосфор – одна из форм черного фосфора. Выделяется как побочный продукт при получениичерного фосфора. Имеет темно-серый цвет, тяжелый, хрупкий, имеет изломы. Способен воспламеняться от удара. Не проводит электрического тока.
1. 3 Способы получения красного фосфора
1. 3. 1 Радиационные способы
Для радиационного синтеза фосфора используется белый фосфор - ГОСТ 898-75 ЧПО «Фосфор», элементную серу - ГОСТ 127-76. Белый фосфор очищают в растворе бихромата калия в серной кислоте при температуре ~50оC, затем промываем много раз дистиллированной водой. Готовим раствор серы и фосфора в бензоле, помещаем в ампулы и облучаем на установке МРХ - у – 100 при комнатной температуре. После облучения вскрываем ампулы и отфильтровываем осадок. Поглощенную дозу рассчитываем по ферросульфатной дозиметрической шкале. Полученные продукты исследуем путем элементного анализа, ЯМР-спектроскопии, 31Р-спектроскопии, МЛДИ-масс-спектроскопии. В результате получается нерастворимый ни в одном полярном или неполярном растворителе, а также в высокомолекулярных минеральных и синтетических маслах. Процесс состоит из стадии инициирования и стадии обрыва цепи. [12]
При помощи радиационно-индуцированного способа можно получить полимерный фосфор, модифицированный растворителем. Для этого используется растворы бензола, диоксана и тритиевой воды (Н2О, ТНО, Т2О). Тритиевая вода была получена путем восстановления оксида палладия в тритиевой атмосфере. N-нитрозодиметиламин (NDMA) (99%, AcrosOrganics, США) и ацетонитрил (чистый для анализа, Химмед, Россия) использовались в качестве поглотителей промежуточных активных частиц, образующихся в реакционных системах под действием β –излучения трития и способныхинициировать полимеризацию белого фосфора. Исследовали растворы белого фосфора в бензоле (с =0, 122 моль/л) и диоксане (с = 0, 085 моль/л). Общая концентрация введенной тритиевой воды в растворах белого фосфора в бензоле и диоксане составляла 0, 04 моль/л (2, 8 × 10-3 моль фр. ) (как известно, диоксан бесконечно смешивается с водой). Начальная активность реакционных систем после введения тритиевой воды варьировалась от 100 до10000 Ки/л. Растворы хранили в темноте, чтобы избежать фотохимического инициирования полимеризации белого фосфора. Радиационно-химические изменения отслеживались в течение пяти месяцев. Результаты были сопоставлены с аналогичными системами без тритиевой воды.
В растворах белого фосфора, содержащих тритиевую воду, появлялся ультрамикродисперсный осадок; его цвет менялся со светло-желтого на оранжевый, а интенсивность цвета со временем была пропорциональна начальной активности раствора. Ранее при изучении γ -индуцированной полимеризации P4 в бензоле мы показали, что этот осадок представляет собой фосфорсодержащий полимер (PCP), нерастворимый в этих системах. Содержание органического компонента (фрагментов растворителя) в ПХФ колеблется в пределах 1-9 мас. %.
Полимеризация фосфора происходит в основном по терадикальному механизму с квадратичным обрывом цепи. В интервале температур 293-348 К из-за низкой растворимости неорганического мономера P4 и нерастворимости полимера происходит короткоцепочечный процесс с получением продукта состава R(P4) Nh, где n =4-6. R • - это радикальные фрагменты, которые образуются при радиолизе растворителя. Каждый из атомов фосфора в PCP имеет одиночную электронную пару и является нуклеофилом. Электрофильный ион гидрония может быть принят атомом фосфора в цепи с образованием ковалентной связи. Электростатическое взаимодействие иона гидрония с окружающими его молекулами воды приводит к образованию сольватационной оболочки с числом молекул ns, равным четырем или пяти. Радиус r оболочки можно оценить по формуле ed / ε r2 ≈ kT, где e - заряд иона, d = 1, 84 D - дипольный момент молекулы воды, ε - ее диэлектрическая проницаемость, k - постоянная Больцмана, а T - температура. Таким образом, где r0 - радиус молекулы воды. Следовательно, молекула полимера (P4 ) n с n ≈ 4-6 может принимать два или три иона гидрония и 10-15 молекул воды. Если в процессе преобладает тритирование полимера из-за прекращения цепи, можно ожидать соотношение примерно 4-6 [32]
Интересной особенностью процесса является то, что носители β –излучения (атомы 3 Н) полностью не включены в полимер. После удаления растворителя (бензола, диоксида углерода) почти вся активность (99, 9%) концентрируется в осадке.
За это явление могут быть ответственны два процесса:
(I) Атомы трития вовлечены в процессы прекращения радикальной цепи (что маловероятно):

Рис. 6 Превращения фосфора
(II) Ионы гидрония принимаются одиночными электронными парами атомов фосфора в цепи молекулы PCP по схеме

Рис. 7 РСР схема
Наблюдаемый тритий β – Скорость -индуцированной полимеризации оказалась заметно ниже, чем скорость γ -индуцированной полимеризации, даже с учетом 17%-ной разницы в показаниях дозиметра Фрике. Мы полагаем, что это явление объясняется особенностями строения системы бензол–вода вблизи точки насыщения водой. Имеющиеся радиационно-химические данные и квантово-химические расчеты позволяют сделать вывод, что в этом диапазоне концентраций воды в бензоле молекулы воды, включая молекулы воды трития, образуют наноразмерные агломераты, способные захватывать и сольватировать свободные от квази электроны. На физико–химической стадии радиолиза взаимодействие β -излучения с водой может привести к образованию как ионных, так и радикальных частиц. Как упоминалось выше, γ -индуцированная полимеризация белого фосфора в бензоле протекает по радикальному механизму. Чтобы выяснить природу активных частиц, инициирующих полимеризацию в трехкомпонентном бензольном растворе фосфора, удаление радикалов. Добавляли NDMA (c = 0, 2 ммоль/л) или ацетонитрил-поглотитель протонов и электронов (c = 0, 2 ммоль/л). В качестве контроля использовали раствор фосфора в бензоле. В течение 14 дней после введения одинаковых количеств тритиевой воды в эти системы осадок ПХФ был обнаружен в системе с ацетонитрилом и в контрольном растворе, тогда как в системе с NDMA осадка не наблюдалось. Эти данные позволяют утверждать, что инициирование реакции β –излучением тритиевой воды (0, 04 моль/л) не изменяет преимущественно радикальный механизм радиационно-химической полимеризации белого фосфора. [33]
Влияние мощности дозы на полимеризацию белого фосфора изучали в диоксане при концентрации = 0, 085 моль/л и активности трития 10 000 Ки/л и в бензоле при с = 0, 122 моль/л и активности трития 4200, 1000 и 100 Ки/л. Течение реакции контролировалось турбидиметрически. В системе ТHO–P4–диоксан желтый осадок появлялся в течение восьми дней после начала реакции. В системах ТHO–P4–бензол, где мощность дозы была ниже, выпадение осадков начиналось с задержкой в несколько дней; время начала выпадения осадков изменялось в противоположность мощности дозы (таблица). Зависимость между временем начала выпадения осадков t и мощностью дозы A (активность трития) хорошо аппроксимируется уравнением t ≈ 900. Это уравнение, а также рисунок, демонстрируют, что время начала выпадения осадков обратно пропорционально квадратному корню из мощности дозы, что свидетельствует в пользу квадратичного прекращения цепочки. Данные в таблице соответствуют зависимости скорости радиационно-химической полимеризации от скорости дозирования в степени 0, 5. Согласно данным турбидиметрии, время, необходимое раствору для достижения той же мутности, вызванной образованием частиц ПХФ, индуцированных β –излучением трития, в 50 раз короче, чем для γ -излучения. Таким образом, наше исследование внутреннего β –облучения растворов белого фосфора в бензоле и диоксане показало, что образование ПХФ протекает по радикальному механизму и менее интенсивно, чем при γ -индуцированной полимеризации. Мы полагаем, что значительно более низкая эффективность (по сравнению с γ -инициированием) полимеризации c4 обусловлена образованием наноразмерных водных агрегатов и особенностями радиолиза тритиевой воды. Это можно объяснить тем фактом, что аддукты белого фосфора с Н• неактивны и не способны инициировать цепные процессы. Мы обнаружили, что после удаления растворителя 99, 9% β –активности остается в осадке ПХФ, что может быть связано со связыванием ионов трития и водорода в процессах обрыва радикальной цепи. [34]
С помощью методов зеленой химии можно так же получить полимерный фосфор. В этом исследовании были использованы следующие ионные жидкости:
1) 1-бутил-3-метилимидазолий трифторметансульфонат, 1-бутил-3-метилимидазолий тетрафторборат, 1-бутил-3-метилимидазолий гексафторфосфат, 1-этил-3-метилимидазолий бис(трифторметилсульфонил)имидж, 1-бутил-1-метилпирролидиний бис(трифторметилсульфонил)имидж, 1-гексил-3-метилимидазолий три(пентафторэтил)трифторфосфат.
2) фосфониевыеионные жидкости:
триэтил-октилфосфоний бис(трифторметилсульфонил)имидж, триэтилдодецилфосфоний бис(трифторметилсульфонил)имидж, 3–n-бутилметилфосфоний бис(трифторметилсульфонил) имидж, 3-n-бутилоктилфосфоний бис(трифторметилсульфонил)имидж, 3-n-бутилдодецилфосфоний бис(трифторметилсульфонил)имидж, 3-n-бутилоктилфосфония тетрафторборат, 3-n-бутилдодецилфосфония тетрафторборат, 3-n-бутилметилфосфония ди-метилфосфат.
Белый фосфор очищали в соответствии с модифицированной процедурой. Растворители (бензол и ДМСО) очищали с использованием стандартных процедур. Полимеризацию белого фосфора проводили в ампулах в инертной атмосфере. Ампулы с растворами облучали γ -излучением 60Co (мощность дозы D•= 0, 59 Гр/с). Температура полимеризации составляла 298 К. После облучения ампулы вскрывали и осадок отфильтровывали. Остаточную концентрацию фосфора в растворе определяли методом титриметрии (со спиртобензольным раствором йода, взятым в избытке). Поглощенная доза рассчитывалась с использованием дозиметрической системы сульфата железа. Продукты реакции были охарактеризованы с помощью элементного анализа, ИК-спектроскопии и рентгеноструктурного анализа (дифрактометр DRON-3M). Микрофотографии были сделаны с помощью сканирующего электронного микроскопа. Кажущиеся константы скорости реакции (K) полимеризации белого фосфора были рассчитаны на основе кинетических данных об остаточной концентрации элементарного фосфора в реакционной смеси после облучения. [30]
1. 3. 2Другие способы получения
Способ получения аморфного красного фосфора при высокотемпературном нагревании белого фосфоразаключается в том, что процесс ведут в присутствии добавок, выбранных из группы: графит, оксид магния. Главными задачами ставятся:
1. исключениемногостадийности процесса,
2. снижение количеств образующихся отходов получения целевого продукта со стабильными свойствами.
Главной проблемой данного опыта является сравнительно невысокая стабильность к внешним воздействиям. В присутствии паров воды могут образовыватьсяфосфин и некоторые другие фосфорные кислоты. Для синтеза в качестве исходного реагента используется элементный фосфор. Для улучшения характеристик красный фосфор выполняют следующие операции – дробление и модификация поверхности. Одной из особенностей известных процессов получения красного фосфора при высокотемпературном переделе белого фосфора является образование плотной трехмерной структуры. Плотностьобразцов достигает 2200-2400 кг/м3, а температура самовоспламенения превышает 523 К. Для опыта наиболее удобным может оказаться фосфор, обладающий повышенной реакционной способностью и имеющий плотность ~1200-2000 кг/м3. Наиболее простым являетсяследующий способ: 5-10 мас. -% эмульсию белого фосфора в воде в присутствии эмульгатора подвергают воздействию ионизирующего излучения до поглощенной дозы 2 МГр. Полученные образцы аморфного красного фосфораимеют трехмерное строение, сравнительно высокую плотностьи температуру самовоспламенения. Так же, одной из задач ставилось получение аморфного красного фосфора с двухкамерной структурой. Поставленная задача решается с помощью получения аморфного красного фосфора в дисперсионной среде дозе 0, 5-1, 5 МГр. Отделяется образец с помощью селективного экстрагирования непрореагировавшего белого фосфора и сушкой продукта. В качестве дисперсионной среды используют смесь воды с следующими органическими растворителями: бензол, CCl4, CHCl3. [3]
Способ стабилизированного красного фосфора заключается в том, что белый фосфор конвертируется в красный при нагревании и последующей стабилизацией порошкообразного красного фосфора неорганическими солями. Главной отличительной особенностью является упрощение получения красного фосфора с последующим сохранением качеств продукта. Получение порошкообразного красного фосфора ведут нагреванием белого фосфора в передельной вращающейся мельнице при температуре 250-350оС в течение 40-50 ч. По окончании полученный красный фосфор выгружается. Для стабилизации полученного образца используют соединения металлов II, III групп. После стабилизации продукт фильтруется и сушится. Главными недостатками данного способа являются:
1. многостадийностьпроцесса
2. длительность процесса
3. Высокая стоимость продукта.
Главной целью изобретения является упрощение процесса и сохранение качества красного фосфора. Сущность способа заключается в следующем: для стабилизирующего эффекта необходимо нанести смесь на поверхность красного фосфора. По окончании процесса конверсии белого фосфора в красный стабилизатор преимущественно оказывается в зоне реакции окисления красного фосфора. Способ осуществляется следующим образом:
1. В мельницу загружают белый фосфор и стабилизирующую добавку.
2. Мельницу герметично закрывают и при скорости вращения 10-20 об/мин и температуре 250-350оС ведут процесс в течение 30-50 ч.
3. По окончании процесса мельница охлаждается, и продукт выгружается.
Стабилизация образующегося красного фосфора происходит за счетхимических реакций, которые происходят на поверхности соединений титана и олова. Таким образом, в предлагаемом способе возможно получить порошкообразный красный фосфор без потери качества.
Главным преимуществом способа состоит в следующем:
1. исключении стадии, включающей перемешивание суспензии в реакторе
2. Исключение небезопасных в пожарном отношении операций
3. Высокое качество полученного продукта. [5]
Способ изготовления состава флегматизированного красного фосфора включает флегматизацию красного фосфора при перемешивании его с гидроксидом магния или алюминия, графитом и поливиниловым спиртом в среде азота при 400 об/мин мешалки в течение 3 минут. Гранулирование при 1200-1400 об/мин мешалки в течение 1, 5-2 минут с добавкой второй половины графита и выгрузку готового гранулированного флегматизированного красного фосфора в течение 1 минуты. Главными отличительными чертами данного способа являются скорость и безопасность. Красный фосфор применяется в военном деле как в отечественной, так и зарубежной технике в аэрозолеобразующих составах. Главные недостатки данного способа:
1. Длительная сушка
2. Продолжительность технологического цикла изготовления состава
3. Необходимость операции ворошения и гранулирования
4. Исходя из п. 3, опасность изготовления.
Суть способа заключается в последовательной загрузке компонентов состава с добавлением растворителя и периодическим его перемешиванием и грануляцией. Данный способ производста красного фосфора используется в спичечном производстве, металлургии, получение фосфорной кислоты, а так же удобрений. [10]
1. 4 Недостатки способов получения красного фосфора
1. Красный фосфор, полученный методом высокотемпературного передела, обладает сравнительно невысокой стабильностью к различным внешним воздействиям. В пример можно привести то, в присутствии паров воды фосфорные кислоты и фосфин. [3]
2. Процесс может характеризоваться: периодичностью, длительностью, большими экономическими затратами и потерями тепла. Так же, можно в минусы записать следующее: громоздкая аппаратура, вредность условий труда, пожароопасность. [4]
3. Стоимость продукта может оказаться более высокой в следствии многостадийности и длительности процесса. [5]
4. Процессы получения красного фосфора, основанные на термической полимеризации белого фосфора, требуют значительных энергозатрат при высокой пожароопасности и сложности аппаратурного оформления, контроля и управления реакцией.
5. Возможно гранулирование фосфора через сито, что также повышает опасность изготовления состава.
1. 5 Химический свойства
Фосфиды — соединения, в которых фосфор проявляет отрицательную степень окисления.
Простое вещество реагирует с концентрированным раствором щелочи, образуется фосфини гипофосфит натрия:
Р4 + 3NaOH + 3H2O = PH3 + 3NaH2PO2 (1)
Фосфин также образуется с помощью гидролиза фосфида кальция:
Ca3P2 + 6H2O = 2PH3 + 3Ca(OH)2 (2)
Многие фосфиды так же можно получить с помощью прямой реакции, пример:
3Na + P(крас. ) = Na3P (3)
Ca + P = Ca3P2 (4)
Mg + p = Mg3P2 (5)
Или:
BCl3 + AlP = BP + AlCl3 (6)
Фосфидыявляются неустойчивыми соединениями, которые очень легко гидролизуютсяcобразованием гидроксида металла и фосфина, а в случае кислоты – образованием соли и фосфина:
Na3P + 3H2O = PH3 + 3NaOH (7)
Na3P + 3HСl = PH3 + 3NaCl (8)
При недостатке кислорода образовывается ядовитый фосфористый ангидрид Р4О6, а при избытке кислорода образуется фосфорный ангидрид Р4О10.

Рис. 6 Строение оксидов фосфора
Фосфористый ангидрид Р4О6является легкоплавким веществом. При температуре 2500С распадается:
Р4О6=(Р2О4)n + P красный, n = 2-6 (9)
Фосфорный ангидрид Р4О10 – белый порошок, очень гидроскопичен, является самым сильным осушателем. Имеет 3 формы:
-α -модификация имеет отдельные молекулы Р4О10, возгоняется при температуре 3500С, при нагревании переходит в β -модификацию.
- β -модификация имеет слои тетраэдров из 10 циклов РО4, при длительном нагревании переходит в γ -модификацию.
- γ -модификация имеет трехмерную структуру, состоящую из 6 циклов РО4.
1. 5. 1 Кислоты:
Фосфорноватистая кислотаH3PO2 не имеет своего ангидрита. Получают ее следующим путем:
2P4белый + 3Ba(OH)2 + 6H2O = PH3 + 3Ba(H2PO2)2 (10)
3Ba(H2PO2)2 + H2SO4 = BaSO4 + 2H3PO2 (11)

Рис. 7 Строение фосфорноватистой кислоты
Является сильной кислотой, Ка = 8, 5*10-2 . Данная кислота и ее соли, гипофосфиты, являются сильными восстановителями.
Ортофосфористая кислотаH3PO3 представляет собою кристаллическое вещество. Получается с помощью следующих реакций:
P4O6 + 6H2O(холодная) = 4H3PO3 (12)
PCl3 + 3H2O = H3PO3 + 3HCl (13)
Является кислотой средней силы, К1 = 8*10-3 К2 = 2, 6*10-7. Кислота и ее соли – сильный восстановитель. При нагревании диспропорционирует:
4H3PO3 = H3PO4 + PH3 (14)
Ортофосфорная кислота H3PO4 – кристаллическое вещество, имеет строение тетраэдра. Получают с помощью с помощью фосфорита:
Ca3(PO4)2 + 3H2SO4 = 3CaSO4 + 2H3PO4 (15)
или с помощью гидролиза P4O10:
P4O10 + 6H2O = 4H3PO4 (16)
Ортофосфорная кислота – кислота средней силы, К1 = 7, 1⋅ 10-3, K2= 6, 2⋅ 10-8, K3 = 5, 0⋅ 10-13. Способна образовывать однозамещенные (дигидрофосфаты) соли, двухзамещенные (гидрофосфаты) соли и трехзамещенные (фосфаты) соли. Представляет собою бесцветное кристаллическое вещество. Расплавленная ортофосфорная кислота обладают большой вязкостью. Обуславливается это образованием межмолекулярных водородных связей:

Рис. 8 Межмолекулярные связи ортофосфорной кислоты
Так же известны две надкислоты фосфора: H4P2O8и H3PO5
Пероксимонофосфорная кислота H3PO5 получается путем взаимодействия P2O5с перекисью водорода:
P2O5 + 2H2O2 + H2O = 2H3PO5 (17)
Имеет следующее строение:

Рис. 9Пероксимонофосфорная кислота
Представляет собой бесцветную вязкую жидкость. Он стабилизирован внутримолекулярной водородной связью. Соединение представляет собой трипротонную кислоту с константами кислотной диссоциации pKa1 = 1, 1, pKa2 = 5, 5 и pKa3 = 12, 8. В водных растворах он медленно гидролизуется до перекиси водорода и фосфорной кислоты.
H3PO5 + H2O ⟶ H3PO4 + H2O2 (18)
Пероксидифосфорная кислота H4P2O8 получается путем взаимодействия взаимодействияH4P2O7 с перекисью водорода:
H4P2O7 + H2O2 = H4P2O8 + H2O (19)
Имеет следующее строение:

Рис. 10Пероксидифосфорная кислота
Данная кислота в водном растворе при нагревании способна диспропорционировать на:
H4P2O8 + H2O = H3PO5 + H3PO5 (20)
1. 5. 2 Полимерные кислоты
Путем нагревания ортофосфорной кислоты H3PO4 при температуре 2600Сполучается пирофосфорная кислотаH4P2O7:
2H3PO4= H4P2O7+ Н2О (21)

Рис. 11 Пирофосфорная кислота
Пирофосфорная кислота при температуре 3000С превращается в метафосфорную кислоту:
H4P2O7= (НРО3)n (22)
Пирофосфорная кислота - сильная кислота. Константы диссоциации соответственно равны: К1 = 3*10-2 К2 = 4*10-3 К3 = 2*10-7 К4 = 5*10-5
Метафосфорная кислота представляет собою циклическое вещество. Степень полимеризации n≥ 3. Это бесцветное, стекловидное вещество, которое хорошо растворяется в воде:
НРО3 + H2O = H3PO4 (23)
Является ядовитым, негорючим, нелетучим веществом.
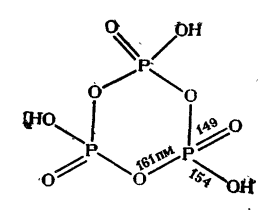
Рис. 12 Строение триметафосфорной кислоты
1. 5. 3 Фосфорорганические полимеры
Карбоцепные фосфорорганические полимеры получают радикальной полимеризацией илисополимеризацией фосфорсодержащих мономеров, например бис-(b-хлорэтил) винилфосфоната (винифоса).

Для получения карбоцепных фосфорорганических полимеров используют также полимераналогичные превращения. Пример: взаимодействие P4S10 с полиэтиленом, диалкилфосфитов с каучуком, PCl3 с полистиролом
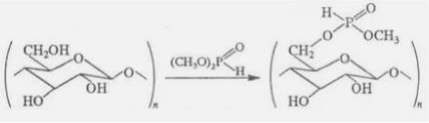
Фосфорилированием целлюлозы, других полисахаридов, белков и других получаютгетероцепные фосфорорганические полимеры с атомами P в боковой цепи. Гетероцепные фосфорорганические полимеры с атомом P в основной цепи (полиэфиры, полиамиды, полиуретаны и другие) получают главным образом поликонденсацией. Полиэфиры (полифосфиты, полифосфониты, полифосфонаты, полифосфаты) обычносинтезируют по схеме:

где: X - алкил, арил, алкоксил, ароксил; Y - кислород, сера или неподеленная электронная пара; Z –хлор илиалкоксил; R –алкилен илиарилен. Фосфорорганические полимеры – термо- и звукоизоляционные материалы, являются селективными ионообменниками. Используются каклиганды в металлокомплексных катализаторах, стабилизаторы полимеров или для создания негорючих тканей.
1. 6 Применение фосфора
· Белый фосфор
Некоторые армии стран мира используют фосфор в качестве боеприпасов. Применение фосфора в качестве боеприпасов началось с Первой Мировой войны.
Фосфор используется в металлургии для фосфатирования поверхности стальных изделий с целью увеличения коррозионной стойкости.
Полученная фосфорная кислота из фосфора применяется при производств стирального порошка из триполифосфата натрия.
Белый фосфор активно применяют в промышленности для лечения таких болезней как: болезнь Педжета, нарушение обмена кальция, остеопороз, гетерогенная оссификация, опухолевый остеолиз.
· Красный фосфор
Красный фосфор практически не токсичен и гораздо безопаснее в работе и хранении, чем белый фосфор. Поэтому в промышленности используется для производства фосфидов, фосфорсодержащих удобрений и соответствующих кислот.
Красный фосфор, применяется для изготовления спичек. Он входит в состав тёрочной поверхности, которую наносят на коробок. Также его используют в смазках, топливе и в производстве ламп накаливания.
В лабораторной практике красный фосфор используется в качестве адсорбента.
Красный фосфор применяется в лампах накаливания в качестве газопоглотителя.
· Черный фосфор
Черный фосфор, на данный момент, не применяется на практике. Но ученые нашли ему применение в качестве полупроводника.
Корейские ученые нашли применение черного фосфора в качестве КМОП-технологии (комплементарная структура металл-оксид-полупроводник). КМОП— набор полупроводниковых технологий построения интегральных микросхем и соответствующая ей схемотехника микросхем.
1. 7 Круговорот фосфора в природе
Фосфор входит число важных элементов и соединений биосферы. Фосфор является составляющей частью нуклеиновых кислот и других веществ, которые вносит вклад в энергетических обменных процессах. Дефицит фосфора в организме приводит к снижению продуктивности. Все вещества в окружающей средес содержанием фосфоралибомалорастворимы, либо не растворяются вовсе. Наиболее устойчивыми компонентами считаются ортофосфаты магния и кальция. В некоторых растворах они преобразуются в дигидрофосфаты. В результат из неорганических фосфатов появляются органические фосфорсодержащие соединения.

Рис. 13 Схема круговорота фосфора в природе
В окружающей среде фосфор содержится в некоторых горных породах, залегающих в недрах Земли. Круговорот подразделяется на два этапа:
1. наземный – начинается, когда породы, содержащие Р, выходят на поверхность, где происходит их выветривание;
2. водный – элемент попадает в море, часть поглощается представителями фитопланктона, который, в свою очередь, поедается морскими птицами и выводится наружу вместе с их продуктами жизнедеятельности.
Часть экскрементов птиц, в которых содержится фосфор, попадают на сушу или смываются обратно в море. Также в водную среду фосфор попадает посредством разложения тел морских животных. Некоторая часть скелетов рыб оседает на дне морей, накапливается и превращается в осадочные породы.
Чрезмерное насыщение водоемов фосфором приводит к таким последствиям:
1. увеличение количества растений в акваториях;
2. цветение рек, морей и других водоемов;
3. эвтрофикация.
Те вещества, которые содержат фосфор и находятся на суше, поступают в почву. Корни растений поглощают фосфор вместе с другими элементами. Когда растения отмирают, фосфор обратно возвращается в почву. В тех почвах, где есть высокое содержание фосфора, образуются апатиты и фосфориты. В круговорот фосфора отдельный вклад делают люди. Антропогенный вклад в круговорот заключается в использовании фосфорных удобрений и бытовой химии с содержаниемфосфора.
Круговорот фосфора в природеявляетсядлительным процессом. В ходе его протекания элемент попадает в воду и землю, насыщает животных и растения, а также в некотором количестве попадает в организм человека.
1. 8 Производство фосфора
1. 8. 1 Производство фосфорных удобрений
Сырье для производства фосфора является одним из важных факторов для его получения. Чем чище сырье, тем выше себестоимость и выше выход продукта. Сырьем для производства фосфора служат следующие руды: апатиты и фосфориты. Сырьем для получения удобрений являются руды, которые содержат фосфориты Са3(РО4)2 и апатиты: фторапатит Са3(РО4)2*CaF и хлорапатит Са3(РО4)2*СаСl2.
Фосфорные руды - осадочные породы, которые сцементированы фосфатами кальция.
Апатиты – это породы вулканического происхождения, имеют крупнозернистую структуру. Апатиты, помимо фтор-или гидроксилапатита, содержат другие минералы. Поэтому для ихпроизводства используют апатитовый концентрат для обогащения руды, который содержит примерно 40% P2O5. Выход продукта составляет примерно 20% от массы апатитовонефелиновой руды.
Фосфориты - порода осадочного происхождения, которая содержит фосфор. Фосфор в данной породе представлен в виде фторапатита и иных примесей. Содержание P2O5после обогащения примерно равно 20-30% P2O5.
Самое крупное в мире месторождение апатитов находится в России на Кольском полуострове. В этом месторождении апатиты залегают вместе с нефелином (Na, K)2O*Al2O3*2SiO2*2H2O и другими минералами. Апатитонефелиновую породу разделяют флотацией на апатитовый концентрат, содержащий 39-41% P2O5. Самое крупное фосфоритное месторождение находится в Казахстане.
Часть сырья, состоящего из фосфатов, используется непосредственно как удобрение в виде тонкоразмолотой муки (фосфоритная мука). В этом и состоит основная задача технологии фосфорных удобрений. В производстве фосфорных удобрений стремятся получить возможно большую часть фосфора в виде монокальцийфосфатаCa(H2PO4)2.
Отходы производства фосфорсодержащих соединений являютсянаиболее многотоннажными отходами химического промышленного комплекса. Наибольший весприходится на производство фосфорных удобрений.
Минеральные удобрения по химическому составу делятся на 2 типа: простые и комплексные. Простые удобрения содержат только один действующий элемент - фосфор. Комплексные удобрения содержат два и более основных действующих веществ. Помимо действующих элементов, удобрения также могут содержать микроэлементы (бор, медь, цинк, марганец), пестициды, добавки для роста и т. д.
Простые фосфорные удобрения состоят из соли кальция и фосфорной кислоты. Главное отличие от калийных и азотных удобрений заключается в том, что фосфорные удобрения обладают различной растворимостью, которая зависит от природы соли. Поэтомуфосфорные удобрения подразделяют на следующие группы:
· водорастворимые удобрения. Данные удобрения состоят из растворимых в воде соединений: двойной суперфосфат и фосфат аммония.
· растворимые в органических кислотах или усвояемые удобрения.
· нерастворимые удобрения
По способам производства фосфорсодержащие удобрения подразделяются на:
· сложные. Данные удобрения получают в результате химической переработки сырья в единичном технологическом цикле
· сложно-смешанные. Данные удобрения производят мокрым способом - смешением порошкообразных готовых удобрений с жидкими и/или газообразными реагентами
· смешанные.
1. 8. 1 Производство фосфорной кислоты
Фосфорная кислота – вещество, имеющее формулу H3PO4, представляющее собой кислоту средней силы (Ка1 = 7. 11*10-3). Имеет кристаллическую форму, температура плавления t = 42. 5oC. Фосфорная кислота активно используется человеком. Применение находит в:
· Производство удобрений
· Пищевая промышленность (добавка Е338 используется в качестве регулятора кислотности)
· Деревообрабатывающая промышленность
· Производство стройматериалов
· Фармацевтическая промышленность и медицина
· Авиапромышленность
· Бытовая химия
· Нефтехимия
· Противопожарная промышленность.
На данный момент существует 2 способа производства фосфорной кислоты, а именно термический и экстракционный методы производства.
Термический способ представляет собой 4 этапа производства фосфорной кислоты:
1. Восстановление в электропечи при высокой температуре. В данной реакции используется оксид кремния и углерод. Происходит следующая реакция:
Са3(РО4)2 + 5С + 2SiO2 = P2 + 5CO + Ca3Si2O7
2. Окисление сжатым воздухом элементного фосфора до его ангидрида Р2О5:
2P2+ 5О2 = 2P2О5
3. Взаимодействие фосфорного ангидрида с водой с образованием газообразной фосфорной кислоты:
P2О5 + 3Н2О = 2Н3РО4
4. Превращение газообразной фосфорный кислоты в жидкую с помощью конденсации. В качестве хладагнета используется вода.

Рис 11. Технологическая схема производства фосфорной кислоты термическим методом.
Термический способ имеет один значительный плюс, а именно то, что с помощью него можно производить кислоту даже из самого бедного сырья, но данный способ очень энергозатратен, поэтому практически не применяется.
Экстрактивный способ представляет собой вытеснение фосфорной кислоты из фосфатов сильными кислотами. Данный метод не требует предварительного выделения фосфора из сырья. В качестве сильной кислоты используется серная кислота.

Рисунок 4. Технологическая схема производства фосфорной кислоты экстрактивным методом.
Процесс производства экстракционной ортофосфорной кислоты (ЭОФК) происходит в баковом экстракторе по следующей упрощенной формуле:
Ca5F(PO4)3 + 5H2SO4 = 5CaSO4 + 3Н3РО4 + HF.
Основной процесс происходит в баках экстракции, куда подаются дозированные сырье, серная кислота и оборотная часть ЭОФК для разбавления концентрата-пульпы (в смешанном растворе серной и фосфорной кислот процесс идет активнее, повышается % выхода ЭОФК). Дозирование имеет важное значение для активности химических процессов, повышения выхода ЭОФК. Для измельченного сырья применяют весовые дозаторы, для серной кислоты — щелевые. В первом баке достигается однородность пульпы и изотермичность процесса, а во втором — дозревание пульпы до свойств, перспективных для последующей фильтрации ЭОФК и отделения примесей на лотках карусельной фильтрации. Для оводнения сульфата кальция, поддержания необходимой текучести пульпы и вывода остаточного ЭОФК из нерастворимого осадка в систему подается вода.
Полученная ЭОФК имеет низкую концентрацию и небольшое количество примесей сырья, её необходимо упаривать. Из-за более низкой себестоимости экстракционный способ рентабельнее термического. Недостаток способа — наличие небольшого количества примесей гипса, соединений фтора, окислов железа и алюминия.
1. 9. Технология переработки отходов фосфора и фосфорной кислоты
Отходы производства фосфора, фосфорной кислоты и фосфорных удобрений являются наиболее многотоннажными отходами химического промышленного комплекса. Наибольший удельный вес в фосфорной промышленности приходится на производство фосфорных удобрений -- суперфосфата.
Сырьем для получения этих продуктов являются руды, содержащие в своем составе фосфориты Са3(Р04)2 и апатиты -- фтор-апатит Са3(Р04)2*CaF, и хлорапатит Са3(Р04)2*СаС12. Кроме основных минералов, эти руды содержат в своем составе минералы-примеси, в следовых количествах уран, торий, ванадий. Фосфорные руды представляют собой осадочные породы, сцементированные фосфатами кальция.
При добыче фосфорных руд огромные массы вскрытых пород, представляющие собой пески, глины, сланцы с примесями серы и фосфора, поступают в отвалы и практически не используются. Исходя из состава их можно использовать для производства пористых заполнителей (аглопорита) и как добавки к сырью при производстве керамических изделий.
При обогащении фосфорных руд образуется большое количество твердых отходов в виде хвостов флотации, масса которых может достигать 70-75% массы исходной руды. Апатитовые руды относятся к легкообогащаемым породам, фосфоритовые - к труднообогащаемым и требуют применения большого количества реагентов. В отходах остается значительное количество фосфатов. Для уменьшения отходности целесообразно труднообогащаемые руды перерабатывать с применением селективного выщелачивания сырья разбавленными кислотами или кислотосодержащими отходами. В апатитовых отходах могут содержаться редкоземельные элементы и радионуклиды, а в фосфоритовых -- канцерогенные органические примеси от флотареагентов. Хвосты флотации могут использоваться как добавки к сырью при производстве керамических строительных материалов. В целях экологической безопасности необходимо контролировать содержание в отходах радионуклидов и при повышенной их концентрации предусматривать мероприятия для захоронения отходов. Обогащенные апатитовые и фосфоритовые концентраты перерабатывают электротермическим или экстракционным методами.
Термическую переработку фосфорного концентрата проводят в электропечах при температуре 1300--1500°С при помощи углерода (кокса) с введением в шихту кремнезема в качестве флюса, в результате чего образуется фосфор и шлаковый расплав. Шлак сливают из печей в огненно-жидком состоянии и гранулируют мокрым способом. На 1 т фосфора приходится 10-12 т шлака. Химический состав фосфорных шлаков близок к составу доменных. Суммарное содержание в них оксида кальция и кремнезема достигает 95% при их соотношении 0, 9--1, 1. Однако из-за наличия в фосфорных шлаках Р205 и CaF2 (до 3% каждого), пониженного количества А12Оэ (до 4%) они обладают низкой гидравлической активностью по сравнению с доменными. Гранулированный шлак имеет пористую структуру, истинная плотность его составляет 2800 кг/м3, плотность куска -- 1220 кг/м3, по зерновому составу он соответствует мелко- или среднезернистым пескам.
Возможности использования фосфорных шлаков в производстве строительных материалов не менее широкие, чем металлургических и топливных. Гранулированные фосфорные шлаки используются в цементной промышленности как добавки к сырью до 8--10% взамен глинистого компонента. Это обеспечивает экономию топлива. Фосфорные шлаки применяются как добавки при измельчении цементного клинкера в производстве портландцемента и шлакопортландцемента. Схватывается фосфорно-шлаковый цемент медленнее и прочность его в ранние сроки ниже, однако в возрасте 3-5 месяцев она становится выше, чем цемента на основе доменных шлаков. Фосфорные шлаки используют также в производстве шлакощелочных цементов. Характерной особенностью фосфорно-шлаковых цементов всех типов является повышенная сульфатостойкость.
Из фосфорно-шлаковых расплавов получают литой щебень по технологии металлургических процессов.
Из них получают также шлаковую пемзу, вату, литые изделия в виде плитки для полов, брусчатки, а также шлакоситаллы. Фосфорные шлакоситаллы имеют меньшую себестоимость, чем си- таллы на основе доменных шлаков. Установлена возможность применения фосфорных шлаков в качестве добавки к сырью при производстве керамических изделий и фасадной плитки.
При экстракционном способе переработки апатитовых и фосфоритовых концентратов получают экстракционную фосфорную кислоту и фосфорные удобрения -- суперфосфат, а в качестве твердого отхода -- сульфат кальция (фосфогипс). В зависимости от условий получения фосфорной кислоты отходы образуются в виде дигидрата Ca2S04 * 2Н20, полугидрата Ca2S04 * 0, 5Н20 или безводного сульфата кальция. Эти отходы представляют собой серый мелкокристаллический комкующийся порошок влажностью 25-40%. В них содержатся непрореагировавшие фосфаты, соединения фтора, стронция, неотмытая фосфорная кислота, органические вещества, соединения редкоземельных элементов, урана. Основную массу образующегося фосфогипса сбрасывают в отвалы, в которых скопились миллионы тонн фосфогипса.
Сравнение состава фосфогипса с природным гипсовым сырьем показало, что фосфогипс является потенциально качественным сырьем для производства различных вяжущих.
При его использовании требуется дополнительная очистка от примесей. Объемы образующегося фосфогипса превышают потребности в специально добываемом гипсовом сырье.
Разработаны и опробованы технологии получения гипсовых вяжущих из фосфогипса. Для снижения содержания примесей и нейтрализации его промывают, затем сушат, обжигают и измельчают. По такой технологии получают высокопрочный гипс, отвечающий требованиям стандарта. Фосфогипсовые вяжущие могут быть использованы как добавки к цементам для регулирования сроков схватывания. Из фосфогипсовых вяжущих можно получать перегородочные плиты, блоки, гипсопесчаный кирпич, декоративные акустические плиты. На основе фосфогипсовых вяжущих возможно получение декоративного материала -- искусственного мрамора. Вяжущие для таких материалов получают путем обжига сырьевой смеси, состоящей из фосфогипса, кремнефтористых солей, оксида кальция. Фосфогипс может служить сырьем для производства цемента с одновременным получением серной кислоты. Сущность этого метода заключается в разложении сульфата кальция в восстановительной среде.
Отходы производства калийных удобрений образуются при переработке калийных руд, основным минералом которых является сильвинит -- смесь сильвина КС1 и галитаNaCl. Калийные удобрения в основном используют в виде хлорида калия. Калийные руды перерабатывают различными методами. Наиболее распространенными являются метод раздельной кристаллизации из растворов и метод обогащения породы флотацией. При переработке и обогащении сырья в калийной промышленности образуются многотоннажные твердые галитовые отходы, которые поступают в отвалы. На 1 т КС1 образуется 3--4 т отходов. Кроме основного компонента NaCl (до 90%), они содержат КС1, CaS04, MgCl2, Вг и нерастворимые вещества. Вблизи калийных предприятий накопились солевые отвалы, которые вызывают засоление почв, повышение минерализации поверхностных и подземных вод. В целях улучшения экологической обстановки следует отказаться от хранения солевых отходов на земной поверхности и постепенно перейти на их складирование в выработанных пространствах, а также совершенствовать технологию горных работ путем сокращения выемки из шахт галита и пустой породы (селективная добыча калийных руд).
Галитовые отходы можно использовать для получения поваренной соли, как сырье в содовом, хлорном производствах, что из-за транспортных расходов целесообразно только для предприятий, расположенных вблизи разрабатываемых калийных месторождений. Перспективным направлением является также внедрение методов комплексного использования сырья: путем извлечения побочных компонентов -- магния, брома, использования отходов для получения кормовой и технической соли и других продуктов.
Бурное развитие промышленного производства и рост народонаселения в значительной степени меняют характер взаимодействия человека с окружающей средой. В основе жизни лежит круговорот элементов, который для человека выражается в обмене веществ с природой. Земля, воздух, вода загрязняются промышленными и бытовыми отходами, сокращаются леса и запасы пригодных для сельского хозяйства земель, исчезают многие виды животных и растений. Под воздействием человека среда изменяется настолько быстро, что веками складывавшиеся в природе равновесия не успевают восстанавливаться, и она неконтролируемо начинает откликаться на эти воздействия. В результате всего этого серьезно ужесточаются условия жизни людей. Жизнеобеспечение человечества все в большей степени решается методами химической технологии. Обеспечение населения пищевыми продуктами осуществляется по двум основным направлениям: применение продуктов химической промышленности для увеличения продуктивности сельского хозяйства и производством искусственной и синтетической пищи.
Увеличение продуктивности сельскохозяйственного производства становится возможным при соответствующем развитии промышленности высокоэффективных минеральных удобрений, средств борьбы с вредителями сельского хозяйства и создании производства стимуляторов роста растений.
Минеральные удобрения должны содержать максимальное количество питательного вещества, то есть быть по возможности безбалластными; иметь широкий спектр действия, то есть содержать важнейшие питательные вещества, в том числе и микроэлементы; иметь хорошую структуру, что облегчает их хранение и использование; должны легко усваиваться растениями; должны улучшать структуру почв, в которую они вносятся. [18] В состав веществ необходимых для жизнедеятельности растений, входят 30 основных элементов. Свыше 90% сухой массы растений составляют углерод, водород и кислород, в значительных количествах они усваивают азот, фосфор, калий, кальций, магний, серу и железо. Фосфор входит в состав белковых веществ. Среднее содержание фосфора в сухом зерне составляет 0, 7-1, 0%, а в сухой соломе 0, 2-0, 35%. Фосфор ускоряет развитие и созревание растений, повышает урожайность и улучшает качество сельско-хозяйственной продукции: повышается содержание сахара в овощах и корнеплодах, крахмала в картофеле. Растения усваивают растворимые соли фосфорной кислоты. Недостаток фосфора не восполняется естественным путем и его можно ликвидировать только внесением удобрений. []
Однако, для более полного описания продукта (двойного суперфосфата), необходимо привести различные классификации минеральных удобрений.
По химическому составу минеральные удобрения, в частности фосфорсодержащие, подразделяются на простые и комплексные. Простые удобрения - фосфорные - содержат один действующий элемент (действующее вещество) - фосфор. Комплексные удобрения содержат два и более основных действующих веществ (азот, фосфор и калий). Фосфорсодержащие удобрения могут содержать не только основные действующие вещества, но и микроэлементы (бор, медь, цинк, марганец), ростовые вещества, добавки пестицидов.
Простые фосфорные удобрения, это кальциевые соли фосфорной (ортофосфорной) кислоты различного состава. В отличие от калийных и азотных удобрений фосфорные удобрения обладают различной растворимостью, которая зависит от природы соли. Поэтому, по растворимости и усвояемости растениями фосфорсодержащие удобрения подразделяются на группы:
· водорастворимые удобрения, в которых большая часть фосфорных соединений растворима в воде - суперфосфат простой и двойной, фосфаты аммония и др.;
· растворимые в органических кислотах или усвояемые (еще их называют цитратнорастворимыми удобрениями, так как в них содержатся соединения фосфора, растворимые в аммиачном растворе лимоннокислого аммония (цитрата аммония) - дикальцийфосфат и др. );
· нерастворимые или растворимые только в сильных минеральных кислотах (лимоннорастворимые удобрения, нерастворимые в воде и аммиачном растворе цитрата аммония, но растворимые в 2%-ном растворе лимонной кислоты - томасшлак, частично фосфоритная мука).
По способам производства фосфорсодержащие удобрения подразделяются на:
· сложные, которые получают в едином технологическом цикле, в результате химической переработки сырья;
· сложно-смешанные гранулированные удобрения производят мокрым способом- смешением порошкообразных готовых удобрений с введением в процессе смешения жидких реагентов (аммиакатов, различных кислот, азот- и фосфорсодержащих растворов), а также газообразного аммиака, пара и воды;
· смешанные удобрения изготовляют механическим смешением различных готовых удобрений, порошкообразных или гранулированных. [18]
Таким образом, двойной суперфосфат - это водорастворимое простое фосфорное удобрение, получаемое разложением природных фосфатов фосфорной кислотой. Он представляет собой гигроскопичный продукт серого цвета и выпускается в гранулированном виде (относится к сложным удобрениям в классификации по способу производства). В отличие от простого суперфосфата не содержит балласта - сульфата кальция и, поэтому, обладая той же агрохимической активностью, имеет большую концентрацию фосфорсодержащего компонента. Двойной суперфосфат содержит 45-51% общей P2O5, в том числе, 42-49% в усвояемой форме в виде водоратсворимых соединений (H3PO4)2; Ca(H2PO4)2; Mg(H2PO4) и цитратнорастворимых соединений (CaHPO4; MgHPO4; фосфаты железа).
Вывод:
1.
Список литературы:
1. М. Х. Карапетянц, С. И. Дракин. Общая и неорганическая химия: учебное пособие/М. Х. Карапетянц, С. И. Дракин. – Москва, 1981. – 632с.
2. Высокомолекулярные соединения, Серия А, 1996, том №38, №9, с. 1467-1471. – Режим доступа: https: //cyberleninka. ru/article/n/polimerizatsiya-elementnogo-fosfora-v-nevodnyh-rastvorah/viewer
3. Патент РФ №2096317, МПК C01B25/023. Способ получения аморфного красного фосфора / Тарасова Н. П., Сметанников Ю. В.; Российский химико-технологический университет им. Д. И. Менделеева.; Заявл. 14. 12. 1994, Опубл. 10. 07. 1997
4. Патент РФ №2093461, МПК C01B25/023. Способ получения красного фосфора /Тарасова Н. П., Сметанников Ю. В., Костиков В. В., Кочетов И. Н., Маркевич А. Н., Чистяков В. Н.; Российский химико-технологический университет им. Д. И. Менделеева.; Заявл. 08. 06. 1993 Опубл. 20. 10. 1997
5. Патент РФ №2050316, МПК C01B25/023. Способ получения стабилизированного красного фосфора /Астахова Г. В., Каморский С. Н., Козлов С. В., Королев В. В., Назаров В. В., Сидоров А. А.; Научно-исследовательский институт по удобрениям и инсектофунгицидам им. Я. В. Самойлова.; Заявл. 14. 05. 1990 Опубл. 20. 12. 1995
6. Гефтер Е. Л., Фосфорорганические мономеры и полимеры/ Гефтер Е. Л. -M., 1960. – 287с.
7. Л. Ф. Кожина, Е. В. Чернозубова Фосфор и его соединения: учебно-методическое пособие. - 2015, 35с. – Режим доступа: http: //elibrary. sgu. ru/uch_lit/1239. pdf
8. Кузнецов, В. В. Химия р-элементов. Элементы 15 группы [Текст]: учебник / В. В. Кузнецов; РХТУ им. Д. И. Менделеева). - 2-е изд., перераб. - М. : РХТУ им. Д. И. Менделеева, 2019. - 312 с. : ил. ; 18, 1 усл. печ. л. - Библиогр.: с. 308-312.
9. Лавров И. А. Особенности синтеза полимерных форм фосфора В Растворах: Дис. … кандидата химических наук: 02. 00. 01Лавров И. А. М. Рос. хим. -технол. ун-т им. Д. И. Менделеева. – М., 2005. – 138 с.
10. Патент РФ №2093461, МПК C01B25/023. Состав флегматизированного красного фосфора и способ его изготовления / Баринов Артем Валерианович, Баринов Валериан Федорович, Сорокина Вера Александровна, Шаинян Галина Рубеновна.; Заявитель и патентообладательБаринов Артем Валерианович, Шаинян Галина Рубеновна.; Заявл. 21. 04. 2008Опубл. 10. 01. 2010
11. Ровкина Н. М., Ляпков А. А. Лабораторный практикум по химии и технологии полимеров. Часть 1. Основные методы получения полимеров: Учебное пособие / Н. М. Ровкина, А. А. Ляпков – Томск: Изд-во Томского политехнического университета, 2007 – 132 с
12. Вестник БТГУ им В. Г. Шухова, 2007, №1. – Режим доступа: https: //cyberleninka. ru/article/n/sintez-fosforserosoderzhaschih-polimerov-radiatsionno-himicheskim-metodom
13. Ван Везер Дж., Фосфор и его соединения / Ин. лит., 1962 г. 2. Корбридж Д., Фосфор. Основы химии, биохимии, технологии / Издательство «Мир», Москва, 1982 г., 680 с. 3.
14. В. А. Ершов Технология производства фосфора [Текст]: Теорет. основы пр-ва: Конспект лекций. - Ленинград: ЛТИ, 1978. - 89 с. : ил.; 20 см
15. Drawe H., Henglein A., Airey P., Free radical Chemistry of Phosphorus: y- Irradiation of P4 in Bromoform / Habn-Meitner-Institut fur Kernforschung Berlin, SektorStrahlenchemie, Berlin-Wannsee, 1968. 57.
16. Основы химической технологии: Учебник для студентов вузов / Мухленов И. П., Горштейн А. Е., Тумаркина Е. С., Тамбовцева В. Д. Под ред. Мухленова И. П. 3-е изд., перераб. и доп. М.: Высш. школа. 1983 335с.: ил.
17. Печковский В. В., Тетеревков А. И, Дзюба Е. Д. Технология неорганических веществ. Введение в специальность. Под ред. В. В. Печковского. Мн.: " Вышэйш. школа". 1977. 264с.: ил.
18. Кочетков В. Н. Фосфорсодержащие удобрения. Справочник. М.: Химия. 1982. 400с.: ил.
19. Соколов Р. С. Химическая технология: Учеб. пособие для студ. высш. учеб. заведений: в 2 т. М.: Гуманит. изд. центр ВЛАДОС. 2000. Т1. 368с.
20. Найдено неожиданное применение черному фосфору // Indicator URL: https: //indicator. ru/physics/chernyy-fosfor-06-07-2017. htm
21. Черный фосфор оказался мощным средством от грибков и бактерий // Naked science URL: https: //naked-science. ru/article/biology/chernyj-fosfor-okazalsya-moshhnym-sredstvom-ot-gribkov-i-bakterij
22. Ученые нашли способ использования черного фосфора в CMOS-технологиях // Dailytechinfo URL: https: //dailytechinfo. org/electronics/7313-uchenye-nashli-sposob-ispolzovaniya-chernogo-fosfora-v-cmos-tehnologiyah. html
23. Black Phosphorus Takes a Step Toward CMOS // IEEE Spectrum URL: https: //spectrum. ieee. org/black-phosphorus-offers-attractive-alternative-to-silicon-in-transistors#toggle-gdpr
24. Применение и правила хранения красного фосфора // Prime Chemical Group URL: https: //pcgroup. ru/blog/primenenie-i-pravila-hraneniya-krasnogo-fosfora/
27. Л. С. Багдасарян Серийная гамма-установка МРХ-y-100 в ГДР // Атомная энергия.. - 1969. - №6. - С. 573-574. http: //elib. biblioatom. ru/text/atomnaya-energiya_t26-6_1969/go, 88
28. N. P. Tarasova, Yu. V. Smetannikov, A. S. Viselov, V. P. Shevchenko, V. M. Byakov Polymerization of white phosphorus induced by internal β --3H radiation // PHYSICAL CHEMISTRY. - 2008. – №6
29. N. P. Tarasova Radiation-Induced Synthesis of Polymers on the Basis of Elemental Phosphorus // Phosphorus, Sulfur, and Silicon and the Related Elements. - 2008. - №183
30. N. P. Tarasova, Yu. V. Smetannikov, A. S. Vilesov, A. A. Zanin Role of reaction media in " green" radiation-induced polymerization of white phosphorus // Pure and Applied Chemistry. - 2009. - №11. - С. 2115-2122.
31. N. P. Tarasova, Yu. V. Smetannikov, A. S. Vilesov, A. A. Zanin Advanced approaches in radiation-chemical synthesis of phosphorus-containing polymers // Comptes Rendus Chimie. - 2010. – №13
32. P. Airey, H. Drawe, A. Henglein Z. Naturforschg, 23 (1968), p. 916
33. N. P. Tarasova, Y. V. Smetannikov, I. V. Permyakov Doklady Chem., 380 (2001), p. 258
34. N. P. Tarasova, Y. V. Smetannikov, I. M. Artemkina, I. A. Lavrov, M. A. Sinayskii, V. I. Ermakov
Doklady Chem., 410 (2006), p. 189
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|