
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Циклоалканы 1 страница
П. А. Жуков, И. Н. Жукова, Л. М. Смирнова
СБОРНИК ЗАДАЧ
ПО ОРГАНИЧЕСКОЙ ХИМИИ
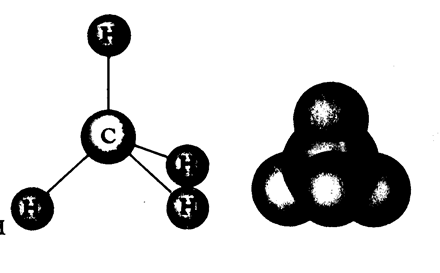
Предисловие.
В сборнике содержится более 650 задач по органической химии различного уровня сложности, предназначенных для учащихся 10-11 классов, охватывающие весь курс органической химии средней школы. Весь материал изложен в 15 главах. Для удобства подбора задач по какому-либо определенному вопросу, в начале задачника указаны подтемы, номера которых указаны в скобках рядом с номерами задач.
В сборнике помимо задач среднего уровня, включены и задачи повышенной сложности, часть из которых предлагались на химических олимпиадах в С. -Петербурге в разные годы.
Сборник может быть полезен как учителю при отборе задач к урокам и факультативным занятиям, так и учащимся при подготовке к экзаменам в Вузы.
| 1. | Строение, изомеры, гомологи. | ||||
| 2. | Химические свойства | ||||
| 3. | Вывод молекулярной формулы. | ||||
| 4. | Расчеты по уравнениям (дан или реагент, или продукт реакции) | ||||
| 5. | Расчеты по уравнениям (на избыток-недостаток) | ||||
| 6. | Расчеты по уравнениям (на выход продукта реакции или на примеси) | ||||
| 7. | Задачи на смеси. | ||||
| 8. | Термохимические расчеты | ||||
| I |
Алканы | ||||
|
1-1 (1) | Какие из нижеприведенных формул принадлежат алканам: C4H8, C5H12, C6H14, C8H18, C9H18, C10H22, C11H24, C12H24, C13H26, C15H30, C16H34. | ||||
|
1-2 (1) | Напишите структурные формулы всех возможных изомерных алканов состава: а) C5H12; б) C6H14; в) C7H16; г) C8H18. Назовите эти вещества по международной номенклатуре. Укажите первичные, вторичные, третичные и четвертичные атомы углерода. | ||||
|
1-3 (1) | Напишите структурные формулы всех возможных изомерных алканов состава C9H20, в которых главная цепь состоит а) из семи атомов углерода, б) из шести атомов углерода, в) из пяти атомов углерода. Назовите эти вещества по международной номенклатуре. Укажите первичные, вторичные, третичные и четвертичные атомы углерода. | ||||
|
1-4 (1) | Сколько изомеров может иметь соединение состава: а) C3H6Cl2; б) C4H9Cl? Назовите их. | ||||
|
1-5 (1) | Напишите структурные формулы следующих веществ: а) 2, 2-диметил-3-этилгексан; б) 2, 2, 3-триметилгептан; в) 2-метил-4-пропил-3-этилоктан; г) 2, 2, 3-триметил-3-изопропилоктан; д) 2-метил-4-третбутилоктан; е) 2, 2, 3, 4-тетраметил-4-изопропил-3, 7-диэтилнонан; ж) 2, 2, 6-триметил-4-пропил-3, 5-диэтилгептан. | ||||
|
1-6 (1) | Какой из перечисленных углеводородов с нормальной цепью (C4H10, C3H8, C7H16, C5H12, C8H18) будет иметь самую высокую температуру кипения? | ||||
|
1-7 (1) | Какое соединение: CO, CH4, C3H8, C2H6, C4H10, дает наибольший тепловой эффект при сгорании одного литра в избытке воздуха? | ||||
|
1-8 (2) | Напишите уравнения реакций, характеризующих химические свойства: а) пропана; б) метилпропана; в) н-бутана; г) 2, 3-диметилбутана. Укажите условия протекания реакций и назовите продукты реакций. | ||||
|
1-9 (2) | Напишите уравнения реакций получения из метана следующих веществ: а) этан; б) пропан; в) 2, 3-диметилбутан. | ||||
|
1-10 (2) | Напишите уравнения реакций Вюрца для следующих вещества: а) бромэтан; б) 2-хлорпропан; в) 1-йод-2-метилбутан; г) 1-бром-2, 2-диметилпропан. Назовите полученные вещества. | ||||
|
1-11 (2) | Напишите уравнения реакций Вюрца для следующих смесей: а) хлорметан и 2-хлорпропан; б) 2-бром-2-метилпропан и 2-бромбутан; в) 1-йод-2-метилпентан и 2-йод-2-метилбутан; г) 2-бром-2, 4-диметил-гексан и 1-бром-2-метилбутан. Назовите полученные вещества. | ||||
|
1-12 (2) | Напишите уравнения реакций Вюрца, при помощи которых получаются следующие вещества: а) гексан; б) 2, 3-диметилбутан в) 2-метилбутан; г) 2, 4-диметилпентан; д) диметилпропан; е) 2, 2, 3, 3-тетраметилбутан. Назовите исходные вещества. | ||||
|
1-13 (2) | Напишите уравнения реакций декарбоксилировании (Дюма) следующих солей: а) C2H5-COONa; б) CH3-COONa; в) (CH3)2-СH-COONa; г) C2H5-С(CH3)2-COONa. | ||||
|
1-14 (2) | Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: а) метан®этан®бутан®этан. б) пропан®гексан; в) пропан®2, 3-диметилбутан; в) метан®бутан®метилпропан; г) углерод ®метан®этан® нитроэтан; д) карбид алюминия ®2-бром-2, 3-диметилбутан. | ||||
|
1-15 (2) | Напишите уравнения реакций к следующей схеме. Назовите продукты реакций: а) Al4C3 б) C8H18®C4H10 в)C2H5COONa | ||||
|
1-16 (3) | Газообразный при н. у. предельный углеводород поместили в бомбу из тугоплавкого материала, который герметически закрыли, нагрели до 1500оС, а затем быстро охладили до исходной температуры, при этом давление в бомбе возросло в 5 раз. Какой углеводород был взят? | ||||
|
1-17 (3) | Какую структурную формулу может иметь изомер нонана, если при его бромировании получаются: а) один третичный монобромид, а при хлорировании – 4 монохлорида; б) два третичных монобромида, а при хлорировании – 5 монохлоридов? | ||||
|
1-18 (3) | Относительная плотность паров алкана по водороду равна 57. Выведите молекулярную формулу алкана. | ||||
|
1-19 (3) | Относительная плотность паров алкана по азоту равна 5, 07. Выведите молекулярную формулу алкана. | ||||
|
1-20 (3) | Газообразный углеводород имеет относительную плотность по кислороду 1, 375, а массовые доли углерода и водорода в нем составляют соответственно 81, 8% и 18, 2%. Какое это соединение? | ||||
|
1-21 (3) | Относительная плотность паров углеводорода по кислороду равна 2, 25. Массовая доля углерода в нем равна 83, 33%. Выведите молекулярную формулу этого углеводорода | ||||
|
1-22 (3) | Плотность углеводорода при нормальных условиях равна 1, 964 г/л. Массовая доля углерода в нем равна 81, 82%. Выведите молекулярную формулу этого углеводорода. | ||||
|
1-23 (3) | Относительная плотность паров органического соединения по водороду равна 22. При сжигании 4, 4 г этого вещества образуется 13, 2 г диоксида углерода и 7, 2 г воды. Выведите молекулярную формулу органического соединения. | ||||
|
1-24 (3) | Относительная плотность паров органического соединения по хлору равна 2. При сжигании 2, 84 г этого вещества образуется 4, 48 л оксида углерода (IV) (н. у. ) и 3, 96 г воды. Выведите молекулярную формулу этого соединения. | ||||
|
1-25 (3) | В некоторых условиях масса некоторого объема воздуха равна 0, 369 г, а масса такого же объема углеводорода – 0, 738 г. Определите формулу углеводорода, если известно, что при его пропускании через водный раствор брома изменения цвета раствора не происходит. | ||||
|
1-26 (3) | К 80 мл газообразного углеводорода добавили избыток кислорода (500 мл) и подожгли. После приведения паров к н. у. объем их составил 340 мл, а после пропускания через избыток раствора гидроксида натрия объем уменьшился до 100 мл. Определите молекулярную формулу углеводорода. | ||||
|
1-27 (3) | При сжигании 100 см3 предельного углеводорода образовалось 400 см3 углекислого газа. Определите молекулярную формулу углеводорода? | ||||
|
1-28 (3) | При сжигании хлоропроизводного предельного углеводорода образовалось 1, 344 л углекислого газа (н. у. ) и 1, 08 г воды, а из хлора, содержащегося в этой навеске исходного вещества, было получено 17, 22 г хлорида серебра. Плотность паров вещества по водороду 42, 5. Определите молекулярную формулу вещества? | ||||
|
1-29 (3) | 448 мл (н. у. ) газообразного предельного нециклического углеводорода сожгли и продукты реакции пропустили через избыток известковой воды, при этом образовалось 8 г осадка. Какой углеводород был взят? | ||||
|
1-30 (3) | При полном сгорании навески углеводорода масса углекислого газа оказалась втрое больше, чем масса исходной навески. Определите строение углеводорода. | ||||
|
1-31 (3) | При бромировании пропана было выделено вещество, содержащее 65% брома. Определите формулу этого вещества? | ||||
|
1-32 (3) | При хлорировании этана было выделено вещество, содержащее 84, 5% хлора. Что это за вещество? | ||||
|
1-33 (3) | Какой из изомеров октана дает наибольшее количество изомеров при радикальном монохлорировании? | ||||
|
1-34 (3) | Какой из изомеров октана дает наименьшее количество изомеров при радикальном монохлорировании? | ||||
|
1-35 (3) | Под действием электрического разряда метан превращается в ацетилен. Как изменится объем газовой фазы? | ||||
|
1-36 (4) | Найдите объем хлора (н. у. ), необходимый для получения из пропана 31, 4 г 2-хлорпропана. | ||||
|
1-37 (4) | Найдите массу воды, необходимой для получения метана из 1, 8 г карбида алюминия. | ||||
|
1-38 (4) | Найдите массу 10% раствора азотной кислоты, необходимой для получения 17, 8 г 2-нитропропана из пропана. | ||||
|
1-39 (4) | Найдите массу бутана, полученного синтезом Вюрца из 17, 92 л этана (н. у. ). | ||||
|
1-40 (4) | Какой объем кислорода (н. у. ) потребуется для сжигания метана, полученного действием воды на 432 г карбида алюминия. | ||||
|
1-41 (4) | Рассчитайте объем воздуха (j(O2)=20%), необходимый для сжигания смеси, состоящей из 0, 042 кг метана и 0, 048 м3 (н. у. ) этана. | ||||
|
1-42 (4) | Рассчитайте объем кислорода (н. у. ), необходимый для сжигания 5 моль бутана. | ||||
|
1-43 (4) | Вычислите объем кислорода, необходимый для сжигания смеси, состоящей из 8 моль метана, 8г этана и 8 л пропана (н. у. ). | ||||
|
1-44 (4) | Какая масса перманганата калия и какой объем соляной кислоты, в которой массовая доля HCl 40% (r=1, 20 г/мл), потребуются для получения хлорметана из 5, 6 л метана (н. у. )? | ||||
|
1-45 (3, 4) | Газ, образовавшийся при сжигании 3, 6 г некоторого вещества, сначала пропустили через поглотитель с оксидом фосфора (V), а затем через раствор гидроксида кальция. При этом масса первого поглотителя увеличилась на 5, 4 г, а во втором образовалось 5, 0 г карбоната кальция и 16, 2 г гидрокарбоната. Какое это вещество и сколько у него может быть изомеров? | ||||
|
1-46 (5) | 5, 6 л пропана смешали с 39, 2 л кислорода при н. у. и полученную смесь взорвали. Какие вещества будут в смеси после взрыва и каковы их массы. | ||||
|
1-47 (5) | Найдите массу углеводорода, полученного при нагревании 27 г 2-бромбутана с 8, 8 г калия. Назовите этот углеводород. | ||||
|
1-48 (5) | Какой объем углекислого газа (н. у. ) получится при сжигании 6 г этана в 8, 96 л кислорода (н. у. ). | ||||
|
1-49 (5, 6) | Найдите массу 2-нитропропана, полученного при действии 700 г 14% раствора азотной кислоты на 88 г пропана, если доля выхода продуктов реакции составляет 80% от теоретически возможного. | ||||
|
1-50 (5) | Какой объем при н. у. займут продукты реакции взаимодействия смеси 15, 6 г йодэтана и 14, 2 г йодметана с избытком металлического калия при нагревании? | ||||
|
1-51 (6) | При хлорировании метана объемом 112 л (н. у. ) получен дихлорметан массой 255 г. Найдите долю выхода продукта реакции. | ||||
|
1-52 (6) | Найдите массу технического карбида алюминия, содержащего 5% примесей, необходимого для получения 28 л метана (н. у. ), если доля выхода продуктов реакции составляет 80% от теоретически возможного. | ||||
|
1-53 (6) | Найдите массу бутана, полученного при крекинге 285 г октана, если доля выхода продуктов крекинга составляет 80% от теоретически возможного. | ||||
|
1-54 (6) | Какой объем этана необходим для получения синтезом Вюрца 16, 24 г бутана, если доля выхода продуктов реакции на первой и второй стадии синтеза равны соответственно 70% и 80% от теоретически возможного. | ||||
|
1-55 (6) | Из 10 л метана синтезом Вюрца получено 3, 2 л этана. Объемы измерены при н. у. Доли выхода продуктов на обеих стадиях синтеза равны. Найдите доли выхода продуктов реакции на каждой стадии. | ||||
|
1-56 (7) | Какой объем кислорода потребуется для сжигания 40 л смеси метана с этаном, плотность которой по водороду равна 13, 25? | ||||
|
1-57 (7) | Смесь пропана с азотом объемом 28 л (н. у. ) сожгли в кислороде и получили 132 г углекислого газа. Найдите объемную долю азота в исходной газовой смеси. | ||||
|
1-58 (7) | Какое количество 5% раствора едкого натра необходимо для поглощения газов, образующихся при полном сгорании 1, 68 л смеси пропана и бутана (н. у. ), содержащей 20 объемных % пропана? | ||||
|
1-59 (7) | Для сжигания 20 м3 смеси метана и пропана израсходовали 85 м3 кислорода. Определите объемный состав исходной смеси | ||||
|
1-60 (7) | Сожгли 6, 72 л смеси этана и бутана получили 17, 92 л углекислого газа (н. у. ). Определите состав исходной смеси. | ||||
|
1-61 (7) | При бромировании избытка изобутана бромом (на свету, при нагревании) получена реакционная смесь, плотность которой по гелию составляет 17, 05. Определите состав смеси. | ||||
|
1-62 (7) | При хлорировании большого избытка метана хлором получена реакционная смесь, плотность которой по водороду составляет 9, 7. Определите состав смеси, считая, что в метане замещается только один атом водорода. | ||||
|
1-63 (7) | При сгорании 31, 4 г смеси двух алканов, различающихся по составу на два атома углерода, было получено 49, 28 л (н. у. ) углекислого газа. Определите состав исходной смеси. | ||||
|
1-64 (7) | При сгорании 1, 66 г смеси двух алканов, отличающихся по составу на один атом углерода, получили 5, 06 г углекислого газа. Определить состав исходной смеси. | ||||
|
1-65 (7) | Продукты полного сгорания 3 л (н. у. ) смеси соседних гомологов алканов сначала пропустили через сухой хлорид кальция, а затем через избыток раствора гидроксида натрия. Масса сосуда с хлоридом кальция увеличилась на 6, 43 г, а сосуда с гидроксидом натрия на 9, 82 г. Какие углеводороды взяты и каковы их массовые доли в исходной смеси? | ||||
|
1-66 (7) | Сожгли 100 мл смеси водорода, кислорода и метана. Объем образовавшихся газов составил 35 мл. После пропускания через раствор щелочи объем уменьшился до 25 мл. Определить состав смеси. | ||||
|
1-67 (7) | При хлорировании 96 г предельного углеводорода образовалась смесь моно-, ди- и тригалогензамещенных углеводородов. Объемное соотношение образовавшихся галогенпроизводных в газовой фазе составляет 1: 2: 3, а плотность паров дихлорзамещенного по водороду при н. у. равна 42, 5. Найти массы образовавшихся хлорпроизводных углеводородов | ||||
|
1-68 (8) | Составьте термохимическое уравнение на основе следующих данных: при сжигании метана объемом 0, 004 м3 выделяется 160, 2 кДж теплоты. Рассчитайте сколько тепловой энергии выделится при сжигании 1000 м3 природного газа, в котором объемная доля метана составляет 98%, принимая, что другие компоненты природного газа не горючи. | ||||
|
1-69 (8) | При сжигании 152, 6 л природного газа, содержащего 95% метана, выделилось столько теплоты, что ее хватило для разложения 4 кг известняка., содержащего 80% карбоната кальция. Составьте термохимическое уравнение реакции разложения карбоната кальция, если известно, что при сжигании 1 моль метана выделяется 890 кДж теплоты. | ||||
|
II. |
Циклоалканы | ||||
|
2-1 (1) | Напишите структурные формулы всех возможных изомеров циклоалканов состава: а) C5H10; б) C6H12; Назовите эти вещества. | ||||
|
2-2 (1) | Напишите структурные формулы всех возможных изомеров циклоалканов состава: C7H14 в которых главная цепь состоит из: а) четырех атомов углерода; б) пяти атомов углерода. Назовите эти вещества. | ||||
|
2-3 (1) | Напишите структурные формулы следующих веществ: а) 1, 1-диметил-2-этил-3-изопропилциклопентан; б) 1, 2-диэтил-3-изопропилциклогексан; в) 1, 2-диметил-2, 3-диэтил-3-пропилциклопентан. | ||||
|
2-4 (2) | Составьте уравнения реакций, характеризующие химические свойства: а) циклобутана; б) циклопентана; в) метилциклопропана; г) метилциклопентана. | ||||
|
2-5 (2) | Напишите уравнения реакций, с помощью которых из соответствующих галогенпроизводных алканов можно получить: а) метилциклогексан; б) циклогексан; в) 1, 1-диметилциклобутан; г) 1, 3-ди-метилциклопентан; д) этилциклогексан. | ||||
|
2-6 (2) | Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: а) 1, 4-дихлорбутан®циклобутан®бутан; б) 1, 2-диметилциклопропан®циклопентан®пентан; в) 1, 4-дибромпентан®метилциклобутан® 2-метилбутан. | ||||
|
2-7 (3) | Относительная плотность паров циклоалкана по кислороду равна 3, 5. Выведите молекулярную формулу циклоалкана. | ||||
|
2-8 (3) | Плотность циклоалкана при нормальных условиях равна 1, 875 г/л. Выведите молекулярную формулу циклоалкана. | ||||
|
2-9 (3) | Относительная плотность паров углеводорода по азоту равна 3. Массовая доля углерода в нем равна 85, 71%. Выведите его молекулярную формулу. | ||||
|
2-10 (3) | Относительная плотность паров углеводорода по водороду равна 35. Массовая доля водорода в нем равна 14, 285%. Выведите молекулярную формулу углеводорода. | ||||
|
2-11 (3) | 7, 5 г органического соединения при нормальных условиях занимает объем 4 л. При сжигании 2, 1 г этого соединения образуется 6, 6 г углекислого газа и 2, 7 г воды. Выведите молекулярную формулу органического соединения. | ||||
|
2-12 (3) | Относительная плотность паров органического соединения по азоту равна 2. При сжигании 9, 8 г этого соединения образуется 15, 68 л углекислого газа (н. у) и 12, 6 г воды. Выведите молекулярную формулу органического соединения. | ||||
|
2-13 (3) | Углеводород имеет относительную плотность по азоту 2, 5. Он не обесцвечивает бромную воду. Предположите возможную структуру углеводорода. Дайте название. | ||||
|
2-14 (3) | Углеводород имеет относительную плотность по углекислому газу 1, 9. Он не обесцвечивает холодный раствор перманганата калия. Предположите возможную структуру углеводорода. Дайте название. | ||||
|
2-15 (4) | Найдите массу 1, 5-дибромпентана, необходимую для получения 21 г циклопентана. | ||||
|
2-16 (4) | Какой объем водорода (н. у. ) необходим для полного гидрирования 24, 5 г метилциклобутана? | ||||
|
2-17 (4) | Найдите объем кислорода, необходимый для сжигания 800 мл циклобутана. | ||||
|
2-18 (4) | Найдите объем 11% раствора азотной кислоты (r=1, 06), необходимый для нитрования 64 г циклогексана. | ||||
|
2-19 (4) | При получении хлорциклопентана из циклопентана выделился хлороводород, растворив который в воде получили 300 г 21, 9% раствора соляной кислоты. Найдите объем вступившего в реакцию хлора (н. у. ). | ||||
|
2-20 (4) | 1-хлорбутан, полученный при гидрохлорировании 112 г циклобутана, нагрели с избытком натрия. Найдите массу образовавшегося вещества и назовите его. | ||||
|
2-21 (4) | 1, 4-дибромбутан массой 108 г нагрели с избытком цинковой пыли. Найдите объем водорода (н. у. ), необходимый для гидрирования полученного циклобутана. | ||||
|
2-22 (5) | Найдите массу циклогексана, полученного при нагревании 28 г цинка с 62 г 1, 6-дихлоргексана. | ||||
|
2-23 (5) | На 210 г метилциклопропана подействовали 118 л водорода (н. у. ). Найдите массу полученного продукта. | ||||
|
2-24 (5, 6) | Найдите массу нитроциклобутана, который образуется при действии 2000 г 6% раствора азотной кислоты на 100, 8 г циклобутана, если доля выхода продуктов реакции составляет 75% от теоретически возможного. | ||||
|
2-25 (6) | При бромировании 15, 68 л циклобутана (н. у. ) получен 1, 4-дибромбутан массой 54, 37 г. Найдите долю выхода продукта реакции. | ||||
|
2-26 (6) | Найдите массу пропана, полученного при гидрировании 89, 6 л циклопропана, если доля выхода продуктов реакции составляет 85% от теоретически возможного. | ||||
|
2-27 (6) | 8 г циклогексана сожгли в избытке кислорода и полученный углекислый газ пропустили через избыток раствора гидроксида кальция, в результате чего выпал осадок массой 45 г. Найдите массовую долю негорючих примесей в циклогексане, если доля выхода продуктов горения составляет 90% от теоретически возможного. | ||||
|
2-28 (7) | Найдите объемный состав смеси циклопропана и циклобутана, относительная плотность которой по азоту равна 1, 875. | ||||
|
2-29 (7) | 16, 1 г смеси циклопропана и циклобутана прогидрировали, затратив 7, 84 л водорода. Найти массовую и объемную доли циклопропана в газовой смеси. | ||||
|
2-30 (7) | 24 л смеси циклопропана и бутана, имеющую плотность по водороду равную 25, 8, прогидрировали. Какой объем водорода при н. у. потребуется, если считать, что реакция прошла количественно. | ||||
|
III |
Алкены | ||||
|
3-1 (1) | Из предложенных формул выберите формулы алкенов: C3H6, C5H12, C7H14, C8H18, C10H20, C11H24, C12H24, C15H30, C16H34, C27H56. | ||||
|
3-2 (1) | Напишите структурные формулы всех возможных изомерных алкенов состава: а) C4H8; б) C5H10; в) C6H12. Назовите эти вещества. | ||||
|
3-3 (1) | Напишите структурные формулы следующих веществ: а) 2-метилпентен-1; б) 2, 3, 3-триметилбутен-1; в) 4, 5-диметилгексен-2; г) 2, 3-диметилпентен-2; д) 3, 3, 4-триметилгептен-1; е) 2, 4, 4-триметил-3-этилпентен-2. | ||||
|
3-4 (1) | Напишите структурные формулы следующих веществ: а) цис-пентен-2; б) транс-пентен-2; | ||||
|
3-5 (2) | Составьте уравнения реакций, характеризующих химические свойства: а) пропена; б) метилпропена; в) бутена-1; г) бутена-2. Укажите условия протекания реакций и назовите продукты реакций. | ||||
|
3-6 (2) | Напишите уравнения реакций гидратации следующих веществ: а) пентен-1; б) пентен-2; в) 2, 3-диметилбутен-1. | ||||
|
3-7 (2) | Напишите уравнения реакций, с помощью которых можно получить: а) пропен; б) бутен-1; в) бутен-2; г) 2-метилбутен-2. | ||||
|
3-8 (2) | Дегидратацией каких спиртов можно получить: а) 4-метилпентен-1; б) 2, 4-диметилпентен-2; в) бутен-2? Напишите уравнения реакций. | ||||
|
3-9 (2) | Напишите уравнения реакций следующих галогенпроизводных алканов со спиртовым раствором щелочи: а) 2-хлор-2-метилпентан; б) 2-бром-2, 3-диметилпентан; в) 2-бром-3-метилгексан; г) 3-бром-2-метилпентан. назовите продукты реакций. | ||||
|
3-10 (2) | Напишите уравнения реакций, с помощью которых можно осуществить превращения: а) пропан®1, 2-дибромпропан® пропен; б) пропан ® 2-бромпропан ® пропен; в) углерод ® полиэтилен. | ||||
|
3-11 (2) | Напишите уравнения реакций: а) 2-хлор-2-метилпентан б) 1-хлор-2-метилпентан | ||||
|
3-12 (3) | Относительная плотность паров алкена по водороду равна 42. Выведите молекулярную формулу алкена. | ||||
|
3-13 (3) | Плотность алкена при н. у. равна 2, 5 г/л. Выведите молекулярную формулу алкена. | ||||
|
3-14 (3) | Относительная плотность паров углеводорода по азоту равна 3, 5. Массовая доля углерода в нем равна 85, 71%. Выведите молекулярную формулу углеводорода. | ||||
|
3-15 (3) | Углеводород массой 12, 5 г при н. у. занимает объем 5 л. Массовая доля водорода в нем равна 14, 29%. Выведите молекулярную формулу углеводорода. | ||||
|
3-16 (3) | Относительная плотность паров органического соединения по воздуху равна 4, 83. При сжигании 17, 5 г этого соединения получен углекислый газ, занимающий при н. у. объем 28 л, и вода массой 22, 5 г. Выведите молекулярную формулу органического соединения. | ||||
|
3-17 (3) | Для полного гидрирования 10 г этиленового углеводорода потребовался 4 л водорода (н. у. ). Какой это углеводород? | ||||
|
3-18 (3) | Найдите молекулярную формулу этиленового углеводорода, зная, что после его взаимодействия с избытком бромоводорода относительная молекулярная масса продукта оказалась в 2, 45 раза больше, чем у исходного углеводорода. | ||||
|
3-19 (3) | Установите формулу гомолога этилена, 0, 42 г которого полностью обесцвечивают 16 г 10% раствора брома в хлороформе. | ||||
|
3-20 (3) | Найдите массу хлороводорода, необходимого для гидрохлорирования 33, 6 г бутена-2. | ||||
|
3-21 (3) | Найдите объем пропилена (н. у. ), полученного при дегидратации 48 г пропанола-2. | ||||
|
3-22 | Какой объем кислорода (н. у. ) необходим для сжигания 5, 6 л бутена-1? | ||||
|
3-23 (4) | Метилбутен-2 массой 10, 5 г обесцвечивает 480 г бромной воды. Найдите массовую долю брома в бромной воде. | ||||
|
3-24 (4) | 3 г пентена обесцвечивает 15 мл раствора брома в четыреххлористом углероде. Определите молярную концентрацию брома в растворе. | ||||
|
3-25 (4) | Найдите объем водорода (н. у. ), необходимый для гидрирования 50 л смеси этана и этилена, если объемная доля этана в ней 40%. | ||||
|
3-26 (4) | 13, 44 л бутена-2 (н. у. ) сожгли в избытке кислорода. Полученный углекислый газ пропустили через избыток раствора гидроксида бария. Найдите массу выпавшего при этом осадка. | ||||
|
3-27 (4) | Найдите объем пропана (н. у. ), необходимого для получения 12, 75 кг полипропилена. | ||||
|
3-28 (4) | 125 г раствора пентена-2 в гептане реагируют с 6 г брома. Найдите массовую долю пентена-2 в растворе. | ||||
|
3-29 (4) | Какая масса брома может прореагировать с 14 г этиленового углеводорода, плотность которого равна 2, 5 г/л. | ||||
|
3-30 (4) | Какую массу 1, 2-дихлорэтана можно получить при взаимодействии этилена с хлором, выделившимся при действии 400 г 18, 25% соляной кислоты на избыток оксида марганца (IV)? | ||||
|
3-31 (4) | Сколько литров оксида углерода (IV) образуется при полном сгорании 5, 6 л этилена и каков состав полученной соли, если весь оксид углерода (IV) был поглощен 250 г 8% раствора гидроксида натрия? | ||||
|
3-32 (4) | Сколько литров диоксида углерода образуется при полном сгорании 6, 72 л метана и каков состав полученной соли, если весь углекислый газ был поглощен 80 г 15% раствора гидроксида натрия? | ||||
|
3-33 (4) | Какое количество вещества и какую массу перманганата калия в водном растворе необходимо взять для окисления 6 моль этилена? | ||||
|
3-34 (5) | 1, 68 г бутена-1 прореагировало с 0, 8 г воды в присутствии концентрированной серной кислоты. Найдите массу образовавшегося продукта. | ||||
|
3-35 (5) | 19, 6 г бутена-1 прореагировало с бромоводородом, занимающим при н. у. объем 9 л. Найдите количество вещества полученного продукта. | ||||
|
3-36 (5, 6) | 6, 2 л пропилена (н. у. ) пропустили через 500 г 2% водного раствора брома и получили 10, 1 г 1, 2-дибромпропана. Найдите долю выхода продукта реакции. | ||||
|
3-37 (6) | При бромировании бутена-2 массой 8, 4 г получен 2, 3-дибромбутан массой 24, 3 г. Найдите долю выхода продукта реакции. | ||||
|
3-38 (6) | Найдите массу спирта, полученного при гидратации 89, 6 л пропилена (н. у. ), если доля выхода продукта реакции составляет 65% от теоретически возможного. | ||||
|
3-39 (6) | Какой объем бутана (н. у. ) потребуется для получения 42 г бутена-2, если доля выхода продуктов реакции составляет 60% от теоретически возможного. | ||||
|
3-40 (7) | К смеси бутена-1 и азота массой 10 г добавили избыток кислорода и подожгли. Для поглощения полученной газовой смеси потребовалось 504 г 10% раствора гидроксида калия (при этом образовалась средняя соль). Найдите массовую долю азота в исходной смеси, если доля выхода продуктов горения составляет 90% от теоретически возможного. | ||||
|
3-41 (7) | Какой объем водорода (н. у. ) потребуется для гидрирования 63 г смеси пропена и пропана, если массовая доля пропана в ней 70%? | ||||
|
3-42 (7) | 2, 8 л смеси метана и этилена полностью прореагировали с 49 мл раствора с массовой долей брома 4% (плотность раствора 1, 02 г/мл). Вычислите объемную долю этилена в исходной смеси. | ||||
|
3-43 (7) | После охлаждения смеси, средняя молекулярная масса которых равна 64, и состоящей из нескольких соседних членов гомологического ряда некоторых углеводородов, со 100оС до комнатной температуры часть ее сконденсировалась. Средняя молекулярная масса смеси гомологов, оставшихся в газообразном состоянии, составила 52, а жидкости – 76, а молекулярная масса наиболее тяжелого из гомологов в два раза больше молекулярной массы самого легкого из них. определите молекулярные формулы гомологов в смеси, а также объемные соотношения, в которых смешаны углеводороды. | ||||
|
3-44 (7) | Для полного сгорания 40 л смеси метана и этилена потребовалось 110 л кислорода. Объемы всех газов измерялись в одинаковых условиях. Сколько литров каждого газа было в смеси? | ||||
|
3-45 (7) | Смесь пропана, бутана и этилена имеет плотность по водороду 19, 4. 4, 48 л такой смеси прореагировало с 16 г брома. Определите состав смеси. | ||||
|
3-46 (7) | Смесь пропилена с дивинилом прореагировала с избытком брома, при этом масса брома в граммах оказалась численно в 8, 5 раза больше объема (н. у. ) смеси газов в литрах. Определите объемный состав исходной смеси. | ||||
|
3-47 (7) | После гидрирования смеси этана и пропилена ее плотность по водороду составила 19, 2. Определите молярное соотношение этана и пропилена в исходной смеси. | ||||
|
3-48 (7) | После гидрирования смеси метана и этилена ее плотность по водороду возросла на 0, 4. Найдите объемную долю этилена в исходной смеси. | ||||
|
3-49 (7) | смесь метана и этилена со средней молекулярной массой 23, 2 подверглась неполному гидрированию, после чего ее плотность по водороду стала равной 11, 9. Какая часть этилена подверглась гидрированию? | ||||
|
3-50 (7) | К 10 л смеси пропилена и пропана прибавили равный объем водорода и всю смесь пропустили над платиновым катализатором, после чего объем газовой смеси составил 16 л. Определите объемный состав исходной смеси, считая, что реакция прошла до конца. | ||||
|
IV |
Алкадиены | ||||
|
4-1 (1) | Напишите структурные формулы всех возможных изомерных алкадиенов состава: а) C5H8; б) C6H10. Назовите эти вещества. | ||||
|
4-2 (1) | Напишите структурные формулы всех возможных изомерных алкадиенов состава C8H14, имеющих в главной цепи 6 атомов углерода. Назовите все вещества. | ||||
|
4-3 (1) | Напишите структурные формулы следующих веществ: а) 2, 4-диметилпентадиен-1, 4; б) 2, 3-диметил-4-этилгептадиен-1, 3; в) 2-метил-3-этилпентадиен-1, 3; г) 2-метил-3, 4-диэтилгептадиен-2, 4. | ||||
|
4-4 (1) | Какие из перечисленных ниже углеводородов являются гомологами? Пропан, бутен-1, метилпропен, метилбутан, пентен-2, диметилпропан, 2-метилнонан, 2-метилбутен-2, н-гептан, гептен-1, октен-1, 2, 2-диметилгексан, 2-метилгексен-2, гексен-2, бутен-2, 2-метилбутен-1. | ||||
|
4-5 (1) | Какие из перечисленных ниже веществ являются изомерами? 2-метил-3-этилпентан, метилциклопентан, н-пентан, пентадиен-1, 3, тетраметилбутан, 2-метилбутен-2, 2-метилбутадиен-1, 3, пентен-1, 1, 2-диметилциклопропан, 3-метилбутен-1, 2-метил-3-этилпентан, циклопентан, 2, 3-диметилгексан, диметилпропан. | ||||
|
4-6 (2) | Как разделить смесь дивинила и этана? Дайте соответствующие пояснения. Напишите уравнения реакций. | ||||
|
4-7 (2) | Как разделить смесь н-бутана и бутадиена-1, 3? Дайте соответствующие пояснения. Напишите уравнения реакций. | ||||
|
4-8 (2) | Составьте уравнения реакций, характеризующих химические свойства: а) бутадиена-1, 3 (дивинила); б) изопрена(2-метилбутадиена-1, 3). Укажите условия протекания реакций и назовите продукты реакций. | ||||
|
4-9 (2) | Напишите уравнения реакций, с помощью которых можно получить: а) бутадиен-1, 3 (дивинил); б) изопрен (2-метилбутадиен-1, 3). Укажите условия протекания реакций и назовите продукты реакций. | ||||
|
4-10 (2) | Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения. Укажите условия протекания реакций и назовите продукты реакций. CH3-CH2OH б) 2, 3-диметилбутадиен-1, 3 | ||||
|
4-11 (3) | 2 л алкадиена при н. у. имеет массу равной 4, 82 г/л. Выведите молекулярную формулу алкадиена. | ||||
|
4-12 (3) | относительная плотность паров алкадиена по кислороду равна 3. Выведите молекулярную формулу алкадиена. | ||||
|
4-13 (3) | относительная плотность углеводорода по воздуху равна 2, 345. Массовая доля углерода в нем равна 88, 24%. Выведите молекулярную формулу углеводорода. | ||||
|
4-14 (3) | относительная плотность паров органического вещества по кислороду равна 2, 125. При сжигании 10, 2 г этого вещества образовалось 16, 8 л диоксида углерода (н. у. ) и 10, 8 г воды. Выведите молекулярную формулу этого вещества. | ||||
|
4-15 (3) | относительная плотность паров органического вещества по водороду равна 48. При сжигании 2, 4 г этого вещества образовалось 3, 92 л углекислого газа (н. у. ) и 2, 7 г воды. Выведите молекулярную формулу вещества. | ||||
|
4-16 (3) | Газообразный при н. у. непредельный углеводород поместили в бомбу из тугоплавкого материала. Бомбу герметически закрыли, нагрели до 1500оС, а затем быстро охладили до исходной температуры, при этом давление в бомбе возросло в 3 раза. Какой углеводород был взят, если известно, что при реакции с хлором 1 моль углеводорода присоединяет 2 моль хлора? | ||||
|
4-17 (3) | При полном сгорании некоторого объема газообразного углеводорода, широко применяющегося в промышленном синтезе, масса образовавшейся воды оказалась равна массе навески углеводорода. Определите строение углеводорода. | ||||
|
4-18 (3) | Некоторое количество алкадиена дает с избытком хлора 23, 8 г тетрахлорида. То же его количество с избытком брома дает 41, 6 г тетрабромида. Напишите структурную формулу алкадиена, если при замене любого атома водорода в его молекуле атомом хлора получается одно и то же соединение. | ||||
|
4-19 (4) | Найдите массу метилбутана, необходимую для получения 20, 4 г изопрена. | ||||
|
4-20 (4) | Найдите массу дивинилового каучука, которую можно получить из 145 кг бутана, если принять выход реакций количественным. | ||||
|
4-21 (4) | Какой объем водорода (н. у. ) потребуется для полного гидрирования 27, 2 г изопрена? | ||||
|
4-22 (4) | Найдите массу бутадиена-1, 3, который можно полностью прогидрировать водородом, занимающим при н. у. объем 336 м3. | ||||
|
4-23 (4) | Найдите массу бромной воды с массовой долей брома, равной 1%, которую может обесцветить 1, 344 л бутадиена-1, 3. | ||||
|
4-24 | Какой объем дивинила можно получить из 156, 8 л этана (н. у. )? | ||||
|
4-25 (5) | Какой объем займет при н. у. углекислый газ, образовавшийся при горении 16, 2 г дивинила в 40 л кислорода (н. у. )? | ||||
|
4-26 (5) | Газ, полученный при сжигании 13, 6 г пентадиена-1, 3 в 35 л кислорода (н. у. ), пропустили через избыток раствора гидроксида кальция. Найдите массу выпавшего при этом осадка. | ||||
|
4-27 (6) | Какой объем спирта, в котором массовая доля воды составляет 4% (r=0, 80 г/мл), потребуется для получения 4 т дивинила по способу Лебедева при выходе реакции 80% от теоретического? | ||||
|
4-28 (6) | При бромировании 2, 7 г дивинила избытком брома образуется 14, 1 г 1, 2, 3, 4 тетрабромбутана. Определите выход продукта реакции. | ||||
|
4-29 (6) | Какая масса 2-метилбутана необходима для получения 23, 12 г изопрена, если доля выхода продукта реакции составляет 85%? | ||||
|
4-30 (6) | Найдите объем метана (н. у. ), необходимый для получения 108 г дивинила, если доля выхода продуктов на первой стадии синтеза - 80%, на второй стадии - 75%, на третьей – 80%. | ||||
|
4-31 (6) | 3200 мл раствора брома в хлороформе с концентрацией брома 0, 1 моль/л полностью прореагировало с газом, образовавшимся при пропускании 19, 6 г паров этанола над оксидом алюминия при 400оС. Считая, что реакция с бромом протекает количественно, вычислите выход реакции прошедшей на катализаторе. | ||||
|
4-32 (7) | Смесь метилбутана и изопрена массой 306 г полностью гидрируется 50, 4 л водорода (н. у. ). Найдите массовую долю метилбутана в исходной смеси. | ||||
|
4-33 (7) | Какие вещества образуются при взаимодействии 72 г брома с 18, 9 г бутадиена? Найдите массы продуктов. | ||||
|
4-34 (7) | Для полного обесцвечивания раствора, содержащего 19, 2 г брома, потребовалось 1, 68 л газовой смеси, образовавшейся при дегидрировании бутана, причем газовая смесь поглотилась полностью. Определить состав газовой смеси. | ||||
|
V |
Алкины | ||||
|
5-1 (1) | Напишите структурные формулы всех возможных изомерных алкинов состава: а) C5H8; б) C6H10. Назовите эти вещества по международной номенклатуре. | ||||
|
5-2 (1) | Напишите структурные формулы всех возможных изомерных алкинов состава C8H14, имеющих в главной цепи 6 атомов углерода. Назовите эти вещества по международной номенклатуре. | ||||
|
5-3 (1) | Напишите структурные формулы: а) 3-метилбутин-1; б) 5-метилгептин-3; в) 2, 2, 5-триметилгексин-3; г) 2, 5-диметилгексин-3; д) 3-метил-3-изопропил-4-вторбутилгептин-1. | ||||
|
5-4 (2) | Напишите уравнения реакций, характеризующих химические свойства: а) пропина; б) бутина-2; в) пентина-1. Укажите условия протекания реакций и назовите продукты реакций. | ||||
|
5-5 (2) | Напишите уравнения реакций между следующими веществами. Укажите условия протекания реакций и назовите продукты реакций. а) пропин и вода; б) 4-метилпентин-1 и хлор (1 моль); в) 3-метилбутин-1 и аммиачный раствор оксида серебра; г) 4-метилгексин-1 и бромоводород (1 моль). | ||||
|
5-6 (2) | Напишите уравнения реакций, с помощью которых можно получить: а) ацетилен; б) пропин; в) бутин-1; г) бутин-2. | ||||
|
5-7 (2) | Напишите уравнения реакций со спиртовым раствором гидроксида натрия следующих веществ: а) 2, 3-дихлор-4, 4-диметилгексана; б) 4-метил-2, 2-дихлорпентана. в) 3, 3-дибром-4-метилгексана. назовите продукты реакций. | ||||
|
5-8 (2) | Напишите уравнения реакций получения из алкенов следующих веществ: а) 3-метилпентина-1; б) 5-метилгептина-2. назовите исходные алкены. | ||||
|
5-9 (2) | Напишите уравнения реакций получения из дигалогеналканов следующих веществ: а) гексина-2; б) 2, 2-диметилгептина-3; в) 2-метил-3-этилоктина-4. назовите исходные вещества. | ||||
|
5-10 (2) | Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения. Укажите условия протекания реакций и назовите продукты реакций. а) CaCO3 ®CaC2 ®C2H2 ® CH3-CHO; б) Al4C3 ® CH4 ® C2H2 ® HCº C-CH=CH2 ® H2C=CH-CH=CH2 ®C4H10; в) CH3-CH2-CH2OH®C3H6®C3H6Br2®C3H4® C3H3Ag; г) CH4 ® CH3Cl ®C2H6®C2H5Br®C2H4®C2H4Cl2®C2H2®C3H4. | ||||
|
5-11 (2) | Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения. Укажите условия протекания реакций и назовите продукты реакций. 2-бромбутан б) 1, 2-дихлорпропан | ||||
|
5-12 (2) | Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: а) метан ®ацетилен®винилацетилен®хлоропрен ®2-хлорбутан® бутен-2 ®2, 3-дибромбутан ® бутин-2; б) оксид кальция ® ацетилен ® пропин; в) ацетилен®дивинил ® этан; г) ацетилен ® пропанон. Укажите условия протекания реакций и назовите продукты реакций. | ||||
|
5-13 (3) | 1 г алкина при н. у. занимает объем 0, 86 л. Выведите молекулярную формулу алкина. | ||||
|
5-14 (3) | Относительная плотность паров алкина по воздуху равна 2, 83. Выведите молекулярную формулу алкина. | ||||
|
5-15 (3) | Относительная плотность паров углеводорода по водороду равна 41. Массовая доля водорода в нем равна 12, 2%. Выведите молекулярную формулу углеводорода. | ||||
|
5-16 (3) | Относительная плотность паров углеводорода по кислороду равна 2, 125. Массовая доля углерода в нем равна 88, 24%. Выведите молекулярную формулу углеводорода. | ||||
|
5-17 (3) | 27 г органического вещества при н. у. занимают объем 11, 2 л. При сжигании 21, 6 г этого вещества образуется 35, 84 л углекислого газа (н. у. ) и 21, 6 г воды. Выведите молекулярную формулу органического вещества | ||||
|
5-18 (3) | Плотность паров органического соединения по неону равна 4, 1. При сжигании 8, 2 г этого вещества образуется 26, 4 г оксида углерода (IV) и 9 г воды. Выведите молекулярную формулу органического вещества. | ||||
|
5-19 (3) | Углекислый газ, полученный при сгорании 3, 4 г углеводорода пропустили через избыток раствора гидроксида кальция и получили 25 г осадка. Выведите простейшую формулу углеводорода. | ||||
|
5-20 (3) | При сгорании навески некоторого углеводорода плотностью по воздуху 1, 38 образовалось 672 мл углекислого газа и 360 мг воды. Установите формулу углеводорода. | ||||
|
5-21 (4) | Найдите массу вещества, полученного при взаимодействии избытка воды с 7, 8 г ацетилена. | ||||
|
5-22 (4) | Какой объем метана (н. у. ) необходим для получения 208 г ацетилена, если выход реакции считать количественным? | ||||
|
5-23 (4) | Какой объем хлороводорода (н. у. ) необходим для полного гидрохлорирования 25 м3 пропина? Какое вещество образуется и какова его масса? | ||||
|
5-24 (4) | Найдите объем метана (н. у. ), необходимый для получения 450 г поливинилхлорида. | ||||
|
5-25 (4) | Какой объем кислорода (н. у. ) необходим для сжигания ацетилена, полученного из 2 м3 метана? | ||||
|
5-26 (4) | При действии аммиачного раствора оксида серебра на ацетилен образовалось взрывчатое вещество массой 9, 6 г. Какой объем ацетилена (н. у. ) прореагировал? | ||||
|
5-27 (5) | Найдите массу ацетона, образующегося при действии 14 г воды на 24 г пропина. | ||||
|
5-28 (5) | Найдите массу оксида углерода (IV), образующегося при сжигании 22 г ацетилена в 44, 8 л кислорода (н. у. ). | ||||
|
5-29 (5, 6) | Какой объем ацетилена (н. у. ) образуется, если 10 г карбида кальция, содержащего 4% примесей обработать 10 мл воды? | ||||
|
5-30 (6) | Найдите массу 2, 2-дибромпропана, образующегося при действии 520 г бромоводорода на 140 г пропина, в котором содержится 15% примесей не реагирующих с бромоводородом. | ||||
|
5-31 (6) | При действии избытка раствора соляной кислоты на 48 г технического карбида кальция образовалось 13, 44 л ацетилена (н. у. ). Найдите массовую долю примесей в техническом карбиде кальция. | ||||
|
5-32 (6) | Найдите массовую долю примесей в техническом карбиде кальция, если при пропускании газа, полученного действием воды на 1, 6 г карбида, через бромную воду в реакцию вступило 7, 2 г брома. | ||||
|
5-33 (6) | Найдите объем метана, необходимый для получения 42 л ацетилена, если доля выхода продуктов реакции составляет 70% от теоретически возможного. | ||||
|
5-34 (6) | Какую массу уксусного альдегида можно получить по реакции Кучерова из 5, 6 л ацетилена (н. у. ), если доля выхода продуктов реакции составляет 80% от теоретически возможного. | ||||
|
5-35 (6) | При действии избытка воды на 32 г технического карбида кальция, содержащего 20% примесей, образовался ацетилен объемом 6, 72 л. Найдите долю выхода продукта реакции. | ||||
|
5-36 (7) | К 6 л смеси метана с ацетиленом прибавили вдвое больший объем водорода и всю смесь пропустили над платиновым катализатором. После этого объем газа составил 12 л. Определите объемную долю ацетилена в исходной смеси. | ||||
|
5-37 (7) | К 2 л смеси этилена и ацетилена добавили 4 л водорода и смесь пропустили над катализатором. Объем смеси уменьшился до 3, 2 л. Определить объемный состав исходной смеси. | ||||
|
5-38 (7) | Смесь этана, пропилена и ацетилена объемом 672 мл (н. у. ) обесцвечивают 60 мл 5% раствора брома в четыреххлористом углероде (r=1, 6). При пропускании продуктов полного сгорания этой смеси через избыток известковой воды, выпал осадок массой 7, 5 г. Каков состав смеси? | ||||
|
5-39 (7) | Смесь этана, этилена и ацетилена пропустили через водный раствор брома. Количество брома в растворе уменьшилось с 0, 23 моль до 0, 005 моль, а объем газовой фазы стал равен 3, 36 л. Определить состав исходной смеси, если. объемы этилена и ацетилена в ней были равными. | ||||
|
5-40 (7) | При обработке кислотой 20 г смеси карбидов кальция и алюминия образовалось 8 л газов. Определите состав смеси. | ||||
|
5-41 (7) | При действии воды на 38, 4 г смеси карбидов алюминия и кальция образовалось 16, 8 л газов (н. у. ). Найдите массу карбида кальция в смеси. | ||||
|
5-42 (7) | К 560 л смеси этилена и ацетилена добавили водород до объема 2 л. После пропускания полученной смеси над платиновым катализатором ее объем уменьшился на 33, 6%. Все объемы измерены при нормальных условиях. Определите объемный состав исходной смеси. | ||||
|
VI |
Арены | ||||
|
6-1 (1) | Напишите структурные формулы всех гомологов бензола с молекулярной формулой а) C7H8; б) C8H10; в) C9H12. Назовите эти вещества по международной номенклатуре. | ||||
|
6-2 (1) | Напишите структурные формулы: а) о-этилвторбутилбензол; б) м-метилизопропилбензол; в) п-метилизопропилбензол; г) 1, 3-диметил-2-третбутилбензол; д) о-ксилол; е) изопропилбензол (кумол); ж) о-нитротолуол | ||||
|
6-3 (1) | Соединение состава C6H4BrCl не взаимодействует на холоду с галогенами, а при нагревании в присутствии катализатора реагирует с бромом, давая два соединения состава C6H3Br2Cl. Определите структуру исходного соединения. | ||||
|
6-4 (1, 3) | Углеводород с плотностью паров по кислороду равной 3, 25 обесцвечивает бромную воду. Может ли он содержать ароматическое ядро? | ||||
|
6-5 (1) | Предложите структуру ароматического углеводорода C10H14, при окислении которого была получена одноосновная кислота. | ||||
|
6-6 (1) | Углеводород C8H10 при хлорировании молекулярным хлором при освещении дает единственный монохлорид C8H9Cl. при хлорировании в темноте в присутствии хлорида железа (III) образуется единственный монохлорид C8H9Cl, отличный по строению от первого. Определите строение углеводорода. | ||||
|
6-7 (1) | Углеводород C9H12 при бромировании бромом на свету дает единственный монобромид C9H11Br. при хлорировании в темноте в присутствии бромида железа (III) образуется единственный монобромид C9H11Br, отличный по строению от первого. Определите строение углеводорода. | ||||
|
6-8 (2) | Напишите уравнения реакций, характеризующих химические свойства: а) бензола; б) толуола; в) пропилбензола. Укажите условия протекания реакций и назовите продукты реакций. | ||||
|
6-9 (2) | Напишите уравнения реакций, назовите продукты реакций: а) бромбензола с 1 моль Cl2; б) хлорбензола с 1 моль хлорметана; в) бромбензола с 1 моль HNO3; г) о-нитротолуола с 1 моль HNO3; д) м-хлортолуола с 1 моль HNO3; е) нитробензола с 1 моль HNO3; ж) бензойной кислоты с 1 моль Br2; з) о-хлортолуола с 1 моль HNO3. | ||||
|
6-10 (2) | Напишите уравнения реакций, с помощью которых можно получить а) толуол; б) о-ксилол; в) м-ксилол; г) п-ксилол; д) изопропилбензол (кумол). Укажите условия протекания реакций. | ||||
|
6-11 (2) | Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения. Укажите условия протекания реакций и названия продуктов. а) CH4 ®C2H2®C6H6®C6H5Br®C6H5CH3 б) C ® CaC2®C6H6 ® C6H5-C2H5 ® C6H5-COOH. | ||||
|
6-12 (2) | Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения. Укажите условия протекания реакций и назовите продукты реакций. а) гексан ® бензол б) пропан | ||||
|
6-13 (2) | Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения. Укажите условия протекания реакций и назовите продукты реакций. а) бензол®о-пропилтолуол; б) бензол®2, 4, 6-тринитротолуол; в) бензол®о-бромтолуол; г) бензол® изопропилбензол (кумол); д) бензол®1-бром-2-нитробензол; е) бензол®1-бром-3-нитробензол. | ||||
|
6-14 (2) | Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения. Укажите условия протекания реакций и назовите продукты реакций. а) карбид алюминия ® стирол; б) 1, 2-диметилциклобутан® изопропилбензол (кумол); в) карбонат кальция ®этилбензол; г) бутен-2®вторбутилбензол; д) углерод®о-бромнитробензол; е) углерод ® гексахлорбензол; ж) метан ® гексахлоран з) карбид алюминия ®1, 3, 5-триметилбензол. | ||||
|
6-15 (3) | Относительная плотность по гелию паров углеводорода ряда бензола равна 23. Выведите его молекулярную формулу. | ||||
|
6-16 (3) | пары арена имеют относительную плотность по воздуху 4, 14. Выведите его молекулярную формулу. | ||||
|
6-17 (3) | Относительная плотность паров углеводорода по углекислому газу равна 2, 41. Массовая доля углерода в нем равна 90, 6%. Выведите молекулярную формулу углеводорода. | ||||
|
6-18 (3) | Относительная плотность паров органического вещества по кислороду равна 2, 44. При сгорании 3, 9 г этого вещества образуется 13, 2 г углекислого газа и 2, 7 г воды. Выведите молекулярную формулу органического вещества. | ||||
|
6-19 (1, 3) | В результате реакции гомолога бензола с водным раствором перманганата калия общая масса органических продуктов окисления больше массы исходного углеводорода в 1, 566 раза. Определите строение исходного углеводорода. | ||||
|
6-20 (1, 3) | В результате реакции гомолога бензола с водным раствором перманганата калия общая масса органических продуктов окисления больше массы исходного углеводорода в 1, 75 раза. Определите строение исходного углеводорода. | ||||
|
6-21 (1, 3) | При хлорировании на свету некоторого углеводорода получается единственное монохлорпроизводное, массовая доля хлора в котором равна 22, 98%. Назовите исходный углеводород. | ||||
|
6-22 (1, 3) | При хлорировании на свету некоторого углеводорода получается единственное монохлорпроизводное, массовая доля хлора в котором равна 21, 07%. Назовите исходный углеводород. | ||||
|
6-23 (4) | Какая масса нитробензола может быть получена при действии избытка нитрующей смеси на 19, 5 г бензола. | ||||
|
6-24 (4) | Какой объем водорода (н. у. ) необходим для получения этилбензола из 52 г стирола? | ||||
|
6-25 (4) | Для нейтрализации газа, выделившегося при нагревании бензола с хлором в присутствии железных стружек, потребовалось 20 г 6% раствора гидроксида натрия. Какая масса бензола прореагировала? | ||||
|
6-26 (4) | При получении 2, 4, 6-тринитротолуола толуол массой 57, 5 г полностью реагирует с 170 г раствора азотной кислоты. Найдите массовую долю азотной кислоты в этом растворе. | ||||
|
6-27 (4) | Найдите массу гептана, необходимую для получения 90, 8 г 2, 4, 6-тринитротолуола. | ||||
|
6-28 (5) | Найдите массу 2, 4, 6-трибромтолуола, полученного при действии 36 г брома на 4, 6 г толуола. | ||||
|
6-29 (5) | Найдите массу гептана, полученного при полном гидрировании 46 г толуола водородом, занимающим при н. у. объем 42 л. | ||||
|
6-30 (3, 6) | Определите массу этилбензола, полученного при взаимодействии 624 кг бензола с 196 м3 этилена, если в реакцию вступило 80% этилена. | ||||
|
6-31 (6) | вычислите массу бутадиена и стирола необходимые для производства 720 кг бутадиен-стирольного каучука, если допустить, что он получается полимеризацией одинаковых количеств молекул бутадиена и стирола и выход реакции составляет 80%. | ||||
|
6-32 (6) | При пропускании 67, 2 л ацетилена (н. у. ) при нагревании над углем в качестве катализатора образуется вещество, горящее коптящим пламенем. Какое это вещество и какова его масса, если выход реакции составляет 75%? | ||||
|
6-33 (6) | При дегидроциклизации технического гептана массой 147, 4 г получен толуола массой 128, 8 г. Найдите массовую долю примесей в техническом гептане. | ||||
|
6-34 (6) | При нитровании 46, 8 г бензола получен нитробензол массой 66, 42 г. Найдите выход продуктов реакции. | ||||
|
6-35 (6) | На 312 г бензола подействовали при нагревании и на свету избытком хлора. Найдите массу образующегося продукта, если доля его выхода составляет 75% от теоретически возможного. | ||||
|
6-36 (6) | Карбид кальция массой 25, 6 г обработали избытком воды и полученный ацетилен подвергли тримеризации. Какую массу нитробензола можно получить из образовавшегося бензола, если выход реакции на первой стадии равен 90%, на второй – 80% и на третьей – 80%? | ||||
|
6-37 (6) | 31, 2 г бензола, содержащего 25% примесей, обработали 30 мл 70% раствора азотной кислоты (r=1, 4 г/мл) и получили 19, 8 г нитробензола. Найдите долю выхода нитробензола. | ||||
|
6-38 (6) | Какой объем бензола (r=0, 88 г/мл) можно получить двухстадийным синтезом из 336 л метана (н. у. ), если доли выхода продуктов реакций составляют соответственно 75% и 80% от теоретически возможного? | ||||
|
6-39 (7) | Газ, выделившийся в процессе дегидрирования 2, 47 г смеси гептана и метилциклогексана до толуола, смешали с 900 мл ацетилена (н. у. ) и пропустили над платиновым катализатором. После этого объем смеси стал 1004 мл. Найти массовые доли каждого из углеводородов исходной смеси. | ||||
|
VII |
Предельные одноатомные спирты. Простые эфиры | ||||
|
7-1 (1) | Напишите структурные формулы всех изомерных спиртов с молекулярной формулой: а) C4H10O; б) C5H12O. Назовите эти вещества по международной номенклатуре. | ||||
|
7-2 (1) | Напишите структурные формулы всех изомерных спиртов с молекулярной формулой C7H16O и длиной главной цепи - 6 атомов углерода. Назовите эти вещества по международной номенклатуре. | ||||
|
7-3 (1) | Напишите структурные формулы следующих веществ: а) 2, 3-диметил-3-этилгексанол-1; б) 2, 2, 3, 3-тетраметилгептанол-1; в) 2, 3, 4-триметил-4-изопропилгептанол-2; г) 2-метил-3-изопропил-4-этилгексанол-3; д) 2-метил-4-вторбутилоктанол-3; е) 2, 3, 3, 5-тетраметил-4-изопропилгексанол-2. | ||||
|
7-4 (2) | При внутримолекулярной дегидратации спирта состава C8H18O образуется смесь трех изомерных алкенов. Назовите спирт и получающиеся из него алкены. Напишите уравнения реакций. | ||||
|
7-5 (2) | При внутримолекулярной дегидратации спирта состава C4H10O образуется единственный алкен. Дегидрирование этого спирта по функциональной группе невозможно. Назовите спирт и получающийся из него алкен. Напишите уравнение реакции. | ||||
|
7-6 (2) | Сравните подвижность атомов водорода в гидроксильной группе следующих спиртов: метанол, этанол, пропанол-1, бутанол-1. | ||||
|
7-7 (2) | Сравните подвижность атомов водорода в гидроксильной группе следующих спиртов: а) бутанол-1; бутанол-2; б) бутанол-1; 3-бромбутанол-1; в) 2-бромбутанол-1; 3-бромбутанол-1; 4-бромбутанол-1; г) 2-фторпропанол-1; 2-хлорпропанол-1; 2-бромпропанол-1; д) 3-хлорпропанол-1; 3, 3- дихлорпропанол-1; 3, 3, 3- трихлорпропанол-1. | ||||
|
7-8 (2) | Напишите уравнения химических реакций, характеризующих химические свойства: а) метанола; б) этанола; в) пропанола-1; г) пропанола-2. | ||||
|
7-9 (2) | Напишите уравнения химических реакций, с помощью которых можно получить: а) метанол; б) этанол; в) пропанол-1; г) пропанол-2. | ||||
|
7-10 (2) | Напишите уравнения реакций межмолекулярной дегидратации следующих смесей спиртов: а) метанола и этанола; б) этанола и пропанола-1; в) метанола и пропанола-1; г) этанола и пропанола-2; д) 2, 3-диметилбутанола-2 и пропанола-2. | ||||
|
7-11 (2) | Напишите формулы спиртов, при внутримолекулярной дегидратации которых образуются следующие алкены: а) пропен; б) 2-метилбутен-1; б) 2-метил-3-этилпентен-1; в) 2-метил-3-этилпентен-2. | ||||
|
7-12 (2) | Осуществите следующие превращения. Напишите уравнения химических реакций, укажите условия их протекания и назовите все вещества. а) C®C2H2®CH3CHO®C2H5OH®C2H4 ®C2H5Br®C4H10 б) CH4®C2H2®винилацетилен ®хлоропрен® хлоропреновый каучук. | ||||
|
7-13 (2) | Осуществите следующие превращения. Напишите уравнения химических реакций, укажите условия их протекания и назовите все вещества. а) бутан б) пропан в) метан | ||||
|
7-14 (2) | Осуществите следующие превращения. Напишите уравнения химических реакций, укажите условия их протекания и назовите все вещества. а) метан® диэтиловый эфир; б) октан®метилпропанол-2; в) углерод ®этилацетат; г) карбид кальция®2-хлорэтанол. | ||||
|
7-15 (2) | В результате взаимодействия спирта с избытком подкисленного раствора перманганата калия получился продукт с молекулярной массой в 1, 30 раза больше молекулярной массы исходного спирта. Определите состав исходного спирта и полученного продукта. | ||||
|
7-16 (2) | В результате взаимодействия спирта с избытком подкисленного раствора перманганата калия получился продукт с молекулярной массой в 1, 23 раза больше молекулярной массы исходного спирта. Определите состав исходного спирта и полученного продукта. | ||||
|
7-17 (3) | Относительная плотность паров предельного одноатомного спирта по водороду равна 37. Выведите молекулярную формулу спирта. | ||||
|
7-18 (3) | Относительная плотность паров предельного простого эфира по гелию равна 15. Выведите молекулярную формулу эфира. | ||||
|
7-19 (3) | Относительная плотность паров органического соединения по кислороду равна 2, 75. Массовая доля углерода в этом веществе равна 68, 18%, массовая доля водорода равна 13, 64%, остальное - кислород. Выведите молекулярную формулу этого вещества. | ||||
|
7-20 (3) | Относительная плотность паров органического соединения по воздуху равна 4. Массовая доля углерода в этом веществе равна 72, 41%, массовая доля водорода равна 13, 79%, массовая доля кислорода равна 13, 79%. Выведите молекулярную формулу этого вещества. | ||||
|
7-21 (3) | Относительная плотность паров органического соединения по гелию равна 25, 5. При сжигании 15, 3 г этого вещества образовалось 20, 16 л (н. у. ) углекислого газа и 18, 9 г воды. Выведите молекулярную формулу органического соединения. | ||||
|
7-22 (3) | Относительная плотность паров органического соединения по воздуху равна 4. При сжигании 14, 5 г этого вещества образуется 38, 5 г оксида углерода (IV) и 18 г воды. Выведите молекулярную формулу органического соединения. | ||||
|
7-23 (3) | В результате сгорания 0, 828 г органического соединения образовалось 1, 584 г углекислого газа и 0, 972 г воды. Относительная плотность паров этого соединения по метану 2, 875. Установите формулу этого соединения и вычислите объем воздуха (н. у. ), необходимого для полного сгорания 13, 8 г этого вещества (объемную долю кислорода в воздухе принимаем равной 20%). | ||||
|
7-24 (3) | При полном окислении 20, 4 г органического вещества было получено 15, 9 г карбоната натрия, 19, 8 г углекислого газа и 13, 5 г воды. Выведите молекулярную формулу органического вещества. | ||||
|
7-25 (3) | 10, 5 г алкена, образовавшегося при дегидратации некоторого спирта полностью взаимодействует с 2кг 2% водного раствора брома. Какой спирт служил исходным веществом? | ||||
|
7-26 (3) | При взаимодействии 0, 74 г предельного одноатомного спирта с металлическим натрием выделился водород в количестве, достаточном для гидрирования 112 мл пропена-1 (н. у. ). Что это за спирт? | ||||
|
7-27 (3, 6) | Определите формулу спирта, при нагревании 18, 5 г которого с серной кислотой получили этиленовый углеводород симметричного строения объемом 4, 2 л, причем выход реакции составил 75%. | ||||
|
7-28 (4) | Пропен подвергли гидратации и из образовавшегося спирта получили простой эфир массой 61, 2 г. Найдите объем использованного пропена (н. у. ). | ||||
|
7-29 (4) | Найдите массу калия, вступившего в реакцию с пропеном-1, если в результате выделилось 2, 8 л водорода (н. у. ), | ||||
|
7-30 (4) | Найдите массу 1-хлорбутана, необходимую для получения бутанола-1 массой 42 г. | ||||
|
7-31 (4) | Определите объем водорода (н. у. ), выделившегося при действии на избыток калия 40 г водного раствора этанола с массовой долей спирта 96%? | ||||
|
7-32 (4) | Какая масса 96% раствора этилового спирта необходима для получения 1, 12 л этилена (н. у. )? | ||||
|
7-33 (4) | Спирт, полученный гидратацией 20 л этилена (н. у. ), полностью прореагировал с избытком металлического натрия. Какой объем водорода (н. у. ) при этом выделился? | ||||
|
7-34 (4) | Найдите массу этанола, необходимого для реакции этерификации с 21 г 20% раствора уксусной кислоты. | ||||
|
7-35 (4) | Какая масса диэтилового эфира может быть получена межмолекулярной дегидратацией 11, 5 г этилового спирта? | ||||
|
7-36 (4) | Какие массы натрия и этанола потребуются для приготовления 200 г спиртового раствора с массовой долей этилата натрия 34%? | ||||
|
7-37 (4) | 246 мл этилового спирта (r=0, 78 г/мл), в котором массовая доля воды 4%, прореагировало с избытком металлического калия. Какой объем водорода (н. у. ) при этом выделился? | ||||
|
7-38 (5) | На 33, 3 г бутанола-1 подействовали металлическим калием массой 23, 4 г. Найдите объем выделившегося при этом газа (н. у. ). | ||||
|
7-39 (5) | Какая масса меди получится при взаимодействии 41, 6 г метанола со 112 г оксида меди (II). | ||||
|
7-40 (3, 6) | При гидратации 448 мл некоторого алкена в присутствии катализатора под повышенным давлением получили 0, 96 г одноатомного спирта, причем выход реакции составил 80% от теоретического. О каком алкене и каком спирте идет здесь речь? | ||||
|
7-41 (6) | При действии на избыток оксида меди (II) 45 г технического этанола образовалась медь массой 57, 6 г. Найдите массовую долю примесей в техническом спирте. | ||||
|
7-42 (6) | Из 138г этанола получен бутадиен-1, 3 массой 72, 9 г. Найдите массовую долю выхода продукта реакции. | ||||
|
7-43 (6) | какова масса соединения, которое образуется при взаимодействии 14, 8 г бутанола-2 с бромоводородной кислотой, если выход реакции равен 75% от теоретического? | ||||
|
7-44 (6) | Какую массу пропанола-2 можно получить гидратацией 89, 6 л пропилена (н. у. ), если доля выхода продукта реакции составляет 75% от теоретически возможного? | ||||
|
7-45 (6) | Найдите массу бромэтана, необходимого для получения 99, 9 г бутанола-2 трехстадийным синтезом, если доли выхода продуктов реакции составляют на первой стадии - 75%, второй - 80% и третьей - 75% от теоретически возможного. | ||||
|
7-46 (7) | В результате гидратации смеси этана с этиленом объемом 25 л (н. у. ) гидратировали и получили 18, 4 г этанола доля выхода которого составляет 80% от теоретически возможного. Найдите объемную долю этана в исходной смеси. | ||||
|
7-47 (7) | Из 89, 6 л бутана (н. у. ) с объемной долей примесей 25% двухстадийным синтезом получен бутанол-2 массой 79, 92 г. Доли выхода продуктов на первой и второй стадиях одинаковы. Найдите доли выхода продуктов. | ||||
|
7-48 (7) | При сгорании 3, 72 г смеси метанола и этанола образовалось 3, 36 л угле- кислого газа (н. у. ). Какой объем кислорода потребовался для горения? | ||||
|
7-49 (7) | При действии избытка металлического калия на раствор, полученный добавлением 180 г бензола к 44 г смеси метанола с этанолом, выделилось 13, 44 л газа (н. у. ). Определите массовую долю каждого спирта в растворе. | ||||
|
7-50 (7) | Смесь первых двух членов гомологического ряда одноатомных спиртов обработали металлическим калием, при этом выделилось 4, 48 л газа, а при взаимодействии смеси спиртов с бромоводородом образовалось 39, 4 г смеси двух бромистых алкилов. Определить состав исходной смеси. | ||||
|
7-51 (7) | 8, 3 г смеси этанола и пропанола-2 обработали избытком металлического натрия, при этом выделилось 1, 68 л водорода. Определите состав смеси. | ||||
|
VIII |
Предельные многоатомные спирты | ||||
|
8-1 (1) | Напишите структурные формулы изомерных многоатомных спиртов с молекулярной формулой: а) C3H8O2; б) C4H10O2; в) C4H10O3; г) C5H12O2; д) C5H12O3. Назовите эти вещества. | ||||
|
8-2 (1) | Напишите структурные формулы следующих веществ: а) 2, 3, 4-триметил-3-этилпентандиол-1, 2; б) 2, 3, 4-триметил-3-изопропилгексантриол-1, 2, 4; в) 2, 2, 5-триметил-4-вторбутилоктантриол-3, 4, 5. | ||||
|
8-3 (2) | Напишите уравнения реакций, характеризующих химические свойства: а) этиленгликоля; б) глицерина. | ||||
|
8-4 (2) | Напишите уравнения реакций, с помощью которых можно получить: а) этиленгликоль; б) глицерин; в) бутандиол-1, 4. | ||||
|
8-5 (2) | Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: а) метан®этан®этен®этиленгликоль б) пропан®пропен®3-хлорпропен®1, 2, 3-трихлорпропан® глицерин; в) этиленгликоль®этаналь®этанол®этен®1, 2-дихлорэтан ®ацетилен® бензол ® этилбензол. | ||||
|
8-6 (2) | Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: а) карбид алюминия®этиленгликоль; б) метан ® ацетилен®пропин®глицерин®тринитроглицерин. | ||||
|
8-7 (3) | Относительная плотность паров органического вещества по углекислому газу равна 2, 41. Массовая доля углерода в этом веществе равна 45, 28%, массовая доля водорода равна 9, 44%, а остальное приходится на кислород. Выведите молекулярную формулу этого вещества. | ||||
|
8-8 (3) | Относительная плотность паров предельного двухатомного спирта по кислороду равна 3, 25. Выведите молекулярную формулу спирта. | ||||
|
8-9 (3) | Относительная плотность паров предельного трехатомного спирта по метану равна 5, 75. Выведите молекулярную формулу спирта. | ||||
|
8-10 (3) | Относительная плотность паров органического вещества по водороду равна 60. Массовая доля углерода в этом веществе равна 50%, массовая доля водорода равна 10%, массовая доля кислорода равна 40%. Выведите молекулярную формулу органического вещества. | ||||
|
8-11 (3) | Относительная плотность паров органического вещества по водороду равна 53. При сжигании 10, 6 г этого вещества образовалось 8, 96 л углекислого газа (н. у. ) и 9 г воды. Выведите молекулярную формулу органического вещества. | ||||
|
8-12 (3) | Относительная плотность паров органического вещества по кислороду равна 4, 25. При сжигании 47, 6 г этого вещества образовалось 77 г оксида углерода (IV) и 37, 8 г воды. Выведите молекулярную формулу органического вещества. | ||||
|
8-13 (4) | Найдите объем водорода (н. у. ), который выделится при взаимодействии 31 г 86% водного раствора этиленгликоля с избытком калия. | ||||
|
8-14 (4) | Найдите объем 80% раствора азотной кислоты (r=1, 45 г/мл), необходимой для получения тринитроглицерина из 69 г глицерина. | ||||
|
8-15 (4) | Какой объем этилена (н. у. ) необходимо взять для получения 139, 5 г этиленгликоля? | ||||
|
8-16 (4) | Найдите массу калия, необходимого для полного взаимодействия с 18, 4 г глицерина. | ||||
|
8-17 (4) | Найдите массу тринитроглицерина, полученного из 36, 8 г глицерина. | ||||
|
8-18 (4) | Найдите объем этиленгликоля (r=1, 11 г/мл), который можно получить из 89, 6 л этана (н. у. ). | ||||
|
8-19 (4) | Какой объем водорода (н. у. ) выделится при действии металлического натрия на некоторое количество глицерина, если при реакции этого же количества глицерина со свежеприготовленным гидроксидом меди (II) в присутствии щелочи образовалось 23, 1 г глицерида меди (II)? | ||||
|
8-20 (4) | При пропускании продуктов полного сгорания этиленгликоля через избыток раствора баритовой воды выпал осадок массой 98, 5 г. Найдите массу сгоревшего этиленгликоля. | ||||
|
8-21 (5) | Какова масса спирта, образующегося при действии водного раствора, содержащего 50, 4 г гидроксида калия на 86, 4 г 1, 2-дибромбутана. | ||||
|
8-22 (5) | Какой объем водорода (н. у. ) выделится при действии 18, 4 г глицерина на металлический натрий массой 16, 1 г? | ||||
|
8-23 (6) | При нитровании 13, 8 г глицерина получен тринитроглицерин массой 27, 4 г. Найдите долю выхода продукта реакции. | ||||
|
8-24 (6) | Сколько литров этилена (н. у. ) потребуется для получения 27, 3 г этиленгликоля, если доля выхода продукта реакции составляет 65% от теоретически возможного? | ||||
|
8-25 (6) | Какой объем (н. у. ) и какого газа надо пропустить через водный раствор перманганата калия, чтобы получить 9, 3 г простейшего двухатомного спирта, если выход продукта реакции составляет 60% от теоретического? | ||||
|
8-26 (6) | Определите строение алкена, если 3, 5 г его реагируют с 10 г брома, а при окислении перманганатом калия в водном растворе он образует симметричный двухатомный спирт. Какая масса спирта получится при окислении алкена, если выход реакции равен 80%? | ||||
|
8-27 (6) | Найдите массу глицерина, который можно получить из 295 г 1, 2, 3-трихлорпропана, если доля выхода продуктов реакции составляет 65% от теоретически возможного. | ||||
|
8-28 (6) | Какую массу тринитроглицерина можно получить при действии 120 г 85% раствора азотной кислоты на 46 г глицерина, если доля выхода продуктов реакции составляет 60% от теоретически возможного? | ||||
|
8-29 (6) | этилен, полученный в две стадии из этана, обработали водным раствором перманганата калия и получили 190, 6 г этиленгликоля, содержащего 15% примесей. Найдите объем исходного этана (н. у. ), если выходы на первых двух стадиях составляют 80% и 90%, соответственно, а на третьей - 75% от теоретически возможных. | ||||
|
8-30 (7) | 24, 6 г смеси этиленгликоля и глицерина обработали избытком металлического калия, при этом выделилось 8, 96 л газа (н. у. ). Определите состав исходной смеси. | ||||
|
IX |
Фенолы | ||||
|
9-1 (1) | Напишите структурные формулы всех изомерных фенолов с молекулярной формулой: а) C6H4(OH)2; б) C6H3(OH)3; в) C7H6(OH)2. в) C8H8(OH)2. Назовите эти вещества по международной номенклатуре. | ||||
|
9-2 (1) | Напишите структурные формулы следующих веществ: а) 1, 2-дигидрокситолуол; б) 2-метил-3-гидроксифенол; в) 2, 4, 6-тринитрофенол; г) бензендиол-1, 3; д) бензентриол-1, 2, 3. | ||||
|
9-3 (2) | Сравните химические свойства: а) фенола и бензола; б) фенола и метанола. | ||||
|
9-4 (2) | Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: а) метан ®бензол®толуол® о-гидрокситолуол (о-крезол); б) этиленгликоль® фенол ® фенолят натрия; в) карбид алюминия ® 2, 4, 6-тринитрофенол (пикриновая кислота); г) ацетиленид серебра®фенолят натрия; д) гексан®бензол®изопропилбензол (кумол) ®фенол. Укажите условия протекания реакций. | ||||
|
9-5 (3) | Относительная плотность паров органического соединения по метану равна 7, 75. Массовая доля углерода в этом веществе равна 67, 74%, массовая доля водорода равна 6, 45%, а остальное приходится на кислород. Выведите молекулярную формулу этого соединения. | ||||
|
9-6 (3) | Относительная плотность паров органического соединения по азоту равна 4, 5. Массовая доля углерода в этом веществе равна 57, 14%, массовая доля водорода равна 4, 76%, массовая доля кислорода равна 38, 10%. Выведите молекулярную формулу этого соединения. | ||||
|
9-7 (3) | Относительная плотность паров органического соединения по водороду равна 47. При сжигании 14, 1 г этого вещества образуется 39, 6 г диоксида углерода и 8, 1 г воды. Выведите молекулярную формулу этого соединения. | ||||
|
9-8 (3) | Относительная плотность паров органического соединения по кислороду равна 3, 875. При сжигании 12, 4 г этого вещества образуется 15, 68 л углекислого газа (н. у. ) и 7, 2 г воды. Выведите молекулярную формулу этого соединения. | ||||
|
9-9 (1, 3) | Раствор, содержащий 1, 46 г соединения относящегося к классу фенолов, обработали избытком брома, при этом образовалось 4, 54 г трибромпроизводного. Считая, что реакция идет количественно, определить строение исходного соединения. | ||||
|
9-10 (1, 3) | Раствор, содержащий 1, 84 г соединения относящегося к классу фенолов, обработали избытком брома, при этом образовалось 5, 87 г трибромпроизводного. Считая, что реакция идет количественно, определить строение исходного соединения | ||||
|
9-11 (4) | Найдите массу прореагировавшего фенола, если при его взаимодействии с избытком калия выделилось 3, 36 л водорода (н. у. ). | ||||
|
9-12 (4) | Какая масса хлорбензола необходима для получения 5, 64 г фенола. | ||||
|
9-13 (4) | К 40 г спиртового раствора фенола прибавили избыток бромной воды. После окончания реакции было получено 13, 24 г осадка. Найдите массовую долю фенола в исходном растворе. Какая масса бромной воды, в которой массовая доля брома 2, 5%, потребовалась для реакции? | ||||
|
9-14 (4) | Какая масса 20% раствора гидроксида натрия может вступить в реакцию с 23, 5 г фенола? | ||||
|
9-15 (4) | 216 г 2, 5% раствора бромной воды брома, полностью прореагировала с 21, 15 г водного раствора фенола. Определите массовую долю фенола в растворе. | ||||
|
9-16 (4) | Какую массу 2, 4, 6-тринитрофенола можно получить при нитровании 18, 8 г фенола? | ||||
|
9-17 (4) | 37, 6 г фенола прореагировали со 90 г раствора азотной кислоты с образованием 2, 4, 6-тринитрофенола. Найдите массовую долю азотной кислоты в этом растворе. | ||||
|
9-18 (4) | При взаимодействии некоторого количества фенола с избытком калия выделился водород объемом 13, 44 л (н. у. ). Найдите объем (н. у. ) ацетилена, необходимого для получения этого количества фенола. | ||||
|
9-19 (5) | Найдите массу фенолята калия, образующегося при действии 20, 6 г гидроксида калия на 32, 9 г фенола. | ||||
|
9-20 (5) | Найдите массу фенола, которая может быть получена взаимодействием водного раствора, содержащего 22, 4 г гидроксида калия, с 54, 95 г бромбензола. | ||||
|
9-21 (6) | При действии избытка водного раствора гидроксида натрия на 67, 5 г хлорбензола получили 42, 3 г фенола. Найдите долю выхода продукта реакции. | ||||
|
9-22 (6) | Какая масса фенола необходима для получения 15, 3 г 2, 4, 6-тринитрофенола, если доля выхода продукта составляет 85% от теоретически возможного? | ||||
|
9-23 (6) | Сколько граммов фенолята калия можно получить взаимодействием избытка гидроксида калия с 11, 75 г фенола, если доля выхода продукта реакции составляет 80% от теоретически возможного? | ||||
|
9-24 (6) | Какая масса 15% водного раствора гидроксида натрия потребуется для нейтрализации 47 г фенола, содержащего 10% примесей. | ||||
|
9-25 (6) | 470 г водного раствора фенола может прореагировать с 12, 5 мл раствора, в котором массовая доля гидроксида калия 40% (r=1, 40 г/мл). Найдите массовую долю фенола в растворе? Какая масса бензола потребовалась бы для получения этого количества фенола, если выход реакции составляет 83% от теоретического? | ||||
|
9-26 (7) | На смесь бензола с фенолом массой 60 г подействовали избытком калия. Найдите объем выделившегося газа (н. у. ), если массовая доля бензола в смеси составляет 76, 5%. | ||||
|
9-27 (7) | Раствор фенола в этиловом спирте разделили на две равные части. К одной из них прибавили металлический натрий, причем выделилось 6, 72 л газа (н. у. ), к другой – избыток бромной воды, в результате чего образовалось 13, 24 г осадка. Определите состав исходного раствора. | ||||
|
9-28 (7) | 61, 5 г раствора фенола в этиловом спирте обработали избытком металлического натрия, при этом выделилось 13, 44 л водорода (н. у. ). Определите массовые доли фенола и этанола в исходном растворе. | ||||
|
X |
Альдегиды и кетоны | ||||
|
10-1 (1) | Напишите структурные формулы всех изомерных карбонильных соединений с молекулярной формулой: а) C3H6O; б) C4H8O; в) C5H10O. Назовите эти вещества по международной номенклатуре. | ||||
|
10-2 (1) | Напишите структурные формулы следующих веществ: а) 2, 2, 4-триметилпентанон-3; б) 2, 4-диметил-3-этилгексаналь; в) 3, 3-диметил-4-вторбутилгептанон-2; г) 2, 2-диметил-3-этил-4-изобутилоктаналь; д) 2, 2, 4-триметил-3-изопропилпентаналь; е) 2, 3, 3-триметил-4-этилгептаналь; ж) 2, 2, 5-триметил-4-этилгептанон-3; з) 3, 4-диметил-4-третбутилгексаналь. | ||||
|
10-3 (2) | Органическое вещество состава а) C3H6O; б) C9H18O не вступает в реакцию серебряного зеркала. При хлорировании этого вещества образуется единственный монохлорид. Назовите органическое вещество; напишите уравнения описанных реакций. | ||||
|
10-4 (2) | Напишите уравнения реакций, характеризующих химические свойства: а) метаналя; б) этаналя; в) пропаналя; г) диметилпропаналя. Укажите условия протекания реакций. | ||||
|
10-5 (2) | Напишите уравнения реакций гидрирования следующих веществ: а) 2, 2, 3-триметилбутаналя; б) бутанона; в) 2, 3-диметилпентаналя; г) 3, 3-диметилгексанона-2. Назовите продукты реакций. | ||||
|
10-6 (2) | Восстановлением каких карбонильных соединений можно получить следующие вещества: а) пропанол-1; б) пропанол-2; в) 3, 3-диметилпетанол-1; г) 3, 4-диметилгептанол-2. Напишите уравнения реакций, назовите исходные вещества. | ||||
|
10-7 (2) | Напишите уравнения реакций окисления следующих веществ: а) 2, 2, 3-триметилбутаналя; б) 2, 3, -диметил-3-этилпентаналя; в) 2, 3, 3, 4-тетраметилгексаналя. Назовите полученные вещества. | ||||
|
10-8 (2) | Напишите уравнения реакций, с помощью которых можно получить: а) метаналь; б) этаналь; в) пропаналь; г) пропанон. Укажите условия протекания реакций. | ||||
|
10-9 (2) | Напишите уравнения реакций гидратации: а) бутина-2; б) пентина-1; в) 3-этилгексина-1; д) 4-метилпентина-1. Назовите продукты реакций. | ||||
|
10-10 (2) | Гидролизом каких галогенпроизводных можно получить следующие вещества: а) 3-метилбутаналь; б) метилбутанон; в) 2, 2, 4, 5-тетраметил-4-этилгептанон-3; г) 2, 2, 4, 5-тетраметил-4-этилоктаналь. Напишите уравнения реакций, назовите исходные вещества. | ||||
|
10-11 (2) | Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: а) Al4C3®CH4®C2H2®CH3-CHO®C2H5OH®C2H4®C2H5OH; б) CaC2®C2H2®C2H4®C2H5OH®CH3-CHO®CH3-COOH® ®CH3COONa®CH4 в) C2H2®C6H6®C6H5CH3®C6H5CH2Cl®C6H5CH2OH®C6H5CHO® C6H5COOH® C6H5COONa; г) пропан®1-хлорпропан®пропанол-1®пропаналь®пропанол-1. д) пропан®пропен®2-бромпропан®пропанол-2®пропанон. е) этаналь®этанол® этен®этин®1, 1-дибромэтан®этаналь. ж) пентанон-2® пентаналь; з) пентаналь ®пентанон-2; и) углерод®бензойный альдегид; к) пропаналь®1, 3, 5-триметилбензол; Укажите условия протекания реакций и названия продуктов реакций. | ||||
|
10-12 (2) | Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) C2H4 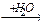 ? ? 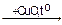 ? ? 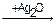 ? ? 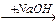 ? ? 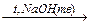 ?
б) CH3CH2CH2OH ?
б) CH3CH2CH2OH 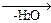 ? ? 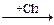 ? ? 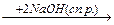 ? ? 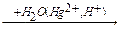 ? ? 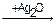 ? ? 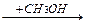 ?
в) этаналь ?
в) этаналь 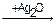 ? ? 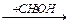 ? ? 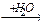 ? ? 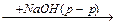 ? ? 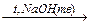 ? Назовите продукты реакций. ? Назовите продукты реакций.
| ||||
|
10-13 (3) | Относительная плотность паров предельного альдегида по кислороду равна 1, 8125. Выведите молекулярную формулу альдегида. | ||||
|
10-14 (3) | Относительная плотность паров предельного альдегида по неону равна 5. Выведите молекулярную формулу альдегида. | ||||
|
10-15 (3) | Относительная плотность паров органического соединения по водороду равна 36. Массовая доля углерода в этом веществе равна 66, 67%, массовая доля водорода равна 11, 11%, а остальное приходится на кислород. Выведите молекулярную формулу органического соединения и предложите структуру, если известно, что это вещество: а) не дает реакции «серебряного зеркала»; б) дает реакции «серебряного зеркала». | ||||
|
10-16 (3) | 10 л газообразного соединения при н. у. имеют массу 13, 4 г. Массовые доли углерода и водорода в нем составляют соответственно 40, 0% и 6, 7%, остальное – кислород. Установите молекулярную формулу соединения. | ||||
|
10-17 (3) | Относительная плотность паров органического соединения по кислороду равна 3, 125. Массовая доля углерода в этом веществе равна 72%, массовая доля водорода равна 12%, остальное - кислород. Выведите молекулярную формулу этого соединения. | ||||
|
10-18 (3) | Относительная плотность паров органического соединения по азоту равна 3, 071. При сжигании 8, 6 г этого вещества образуется 11, 2 л углекислого газа и 9 мл воды (н. у. ). Выведите молекулярную формулу этого соединения. | ||||
|
10-19 (3) | Относительная плотность паров органического соединения по сернистому газу равна 2. При сжигании 19, 2 г этого вещества образуется 52, 8 г углекислого газа (н. у. ) и 21, 6 г воды. Выведите молекулярную формулу органического соединения. | ||||
|
10-20 (3) | При реакции аммиачного раствора оксида серебра с 2, 25 г некоторого альдегида было получено 32, 4 г металлического серебра. Назовите этот альдегид. | ||||
|
10-21 (4) | Какая масса и какого вещества может быть получена взаимодействием 135 г пропанола-2 оксидом меди (II)? | ||||
|
10-22 (4) | Найдите объем водорода (н. у. ), необходимого для получения пропанола гидрированием 217, 5 г пропаналя. | ||||
|
10-23 (4) | На 32 г бутаналя, содержащего 15% примесей, подействовали избытком аммиачного раствора оксида серебра. Найдите массу образовавшегося осадка. | ||||
|
10-24 (4) | Какую массу 15% раствора уксусного альдегида можно получить по реакции Кучерова из 78, 4 л ацетилена (н. у. )? | ||||
|
10-25 (4) | Найдите объем этана (н. у. ), необходимого для получения 30, 8 г уксусного альдегида. | ||||
|
10-26 (4) | На некоторое количество формальдегида подействовали избытком аммиачного раствора оксида серебра. Масса полученного при этом серебра в 2 раза больше, чем при такой же реакции уксусного альдегида массой 22 г. Найдите массу использованного формальдегида. | ||||
|
10-27 (4) | Какова процентная концентрация раствора, полученного при растворении в 225 г воды формальдегида, образованного окислением 160 г метилового спирта. | ||||
|
10-28 (5) | Найдите массу оксида меди (I), образующегося при действии 13, 05 г пропаналя на 34, 3 г гидроксида меди (II). | ||||
|
10-29 (5) | Смесь 17, 6 г этаналя и 10 л (н. у. ) водорода пропустили над платиновым катализатором. Найдите массу полученного спирта. | ||||
|
10-30 (5, 6) | На 137, 2 г гидроксида меди (II) подействовали при нагревании 20% раствором бутаналя массой 462, 5 г. Найдите массу полученного оксида меди (I), если доля выхода продуктов реакции составляет 75% от теоретически возможного. | ||||
|
10-31 (6) | При гидратации пропина массой 10 г получен ацетон массой 13, 05 г. Найдите долю выхода продукта реакции. | ||||
|
10-32 (6) | Какова масса серебра, образующегося при действии избытка аммиачного раствора оксида серебра на 11, 6 г пропаналя, если доля выхода продуктов реакции составляет 85% от теоретически возможного? | ||||
|
10-33 (6) | При окислении метана получен формальдегид массой 150 г. Найдите объем окисленного метана (н. у. ), если доля выхода продуктов реакции составляет 80% от теоретически возможного. | ||||
|
10-34 (6) | Какова массовая доля формальдегида в растворе, полученном путем растворения в 340 мл воды всего формальдегида, образовавшегося при окислении 100 мл метилового спирта (r=0, 80 г/мл), если выход реакции составляет 80% от теоретического? | ||||
|
10-35 (6) | При окислении 225 мл пропанола-1 (r=0, 80 г/мл) получили 150 г альдегида. Найдите выход реакции в процентах от теоретического. Какая масса оксида серебра (в виде аммиачного раствора) может прореагировать с полученным альдегидом? | ||||
|
10-36 (6) | Смесь, образовавшаяся после окисления 11, 5 г этилового спирта оксидом меди (II), прореагировала с аммиачным раствором оксида серебра, причем выделилось 32, 4 г металла. Определите выход реакции окисления спирта, считая, что реакция с оксидом серебра протекает количественно. | ||||
|
10-37 (6) | Карбид кальция массой 100 г, содержащий 4% примесей, обработали избытком воды и полученный ацетилен гидратировали. Масса образовавшегося альдегида равна 16, 5 г. Найдите доли выхода продуктов реакции, если известно, что в обеих реакциях они одинаковы. | ||||
|
10-38 (7) | При взаимодействии 8, 22 г смеси формальдегида и ацетальдегида с аммиачным раствором оксида серебра образовалось 86, 4 г металла. Какой объем занял бы формальдегид при н. у. в виде газа? | ||||
|
10-39 (7) | При взаимодействии продуктов гидрирования 8, 9 г смеси уксусного и муравьиного альдегида с металлическим натрием выделилось 2, 8 л водорода (н. у. ). Какой объем водорода потребовалось бы для получения из этих альдегидов соответствующих спиртов путем каталитического гидрирования, если принять выход реакции за 100%? Определить состав исходной смеси. | ||||
|
10-40 (7) | 2, 5 г смеси ацетилена и формальдегида полностью реагируют с 30, 16 г оксида серебра, растворенного в водном растворе аммиака. Определить состав смеси в массовых процентах. | ||||
|
10-41 (7) | 2, 24 г смеси ацетилена и формальдегида полностью реагирует с аммиачным раствором оксида серебра, при этом общая масса серебра в осадке составила 25, 92 г. Определить состав исходной смеси. | ||||
|
10-42 (7) | Для каталитического гидрирования 35, 6 г смеси муравьиного и уксусного альдегидов потребовалось 22, 4 л водорода. Определить состав смеси. | ||||
|
XI |
Карбоновые кислоты. Сложные эфиры. Жиры. | ||||
|
11-1 (1) | Напишите структурные формулы всех изомерных карбоновых кислот с молекулярной формулой: а) C3H6O2; б) C4H8O2; в) C6H10O2. Назовите эти вещества.. | ||||
|
11-2 (1) | Напишите структурные формулы следующих карбоновых кислот: а) 2, 2, 4-триметил-3-этилгексановая кислота; б) 3, 4, 5, 5-тетраметил-3, 4-диэтилгептановая кислота; в) 2, 2, 3-триметил-3-этилпентановая кислота; г) 2-метил-4-изопропил-3-этилгексановая кислота. д) 2, 4-диметил-3-гексеновая кислота. | ||||
|
11-3 (1) | Напишите структурные формулы всех возможных изомеров с молекулярной формулой: а) C2H4O2; б) C3H6O2; в) C4H8O2. Назовите эти вещества. | ||||
|
11-4 (1) | Какие из перечисленных ниже веществ являются изомерами? Пентанол-1; пентанол-3; бутандиол-1, 2; 2-метилбутаналь; изопропилформиат; 2-метилбутанол-2; пентанон-2; метилпропановая кислота; диметилпропанол; метилбутанон; 2-метилпропандиол-1, 3; изопропилацетат. | ||||
|
11-5 (1) | Какие из перечисленных ниже веществ являются гомологами? Бутанол-2, этанол; 3-метилбутаналь; этандиол; пропановая кислота; 2-метилпро-панол-2; пропанон; пропандиол-1, 3; 3-метилбутановая кислота; 2-метилгексанол-2; пентандиол-1, 3; пентановая кислота; бутанол-1; 3-метилгексаналь; гександиол-1, 2; 3-метилгептановая кислота, бутанон. | ||||
|
11-6 (2) | Сравните силу следующих кислот: а) муравьиной, уксусной, пропионовой; б) уксусной, хлоруксусной, дихлоруксусной; в) 2-бромпропановой, 3-бромпропионовой; г) 2-фторпропановой, 2-хлорпропановой, 2-бромпропановой | ||||
|
11-7 (2) | Напишите уравнения реакций, характеризующих химические свойства: а) муравьиной кислоты; б) уксусной; в) пропионовой кислоты; в) бензойной кислоты. Укажите условия протекания реакций. | ||||
|
11-8 (2) | Как отличить муравьиную кислоту от уксусной?. | ||||
|
11-9 (2) | Напишите уравнения реакций, с помощью которых можно получить: а) уксусную кислоту; б) масляную кислоту. Укажите условия протекания реакций. | ||||
|
11-10 (2) | Окислением каких алканов можно получить: а) этановую кислоту; б) бутановую кислоту; в) метилпропановую кислоту. Напишите уравнения реакций, назовите исходные вещества. | ||||
|
11-11 (2) | Сравните физические и химические свойства уксусной кислоты и ее изомера. Ответ мотивируйте. | ||||
|
11-12 (2) | Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: а) CH3COONa®CH4®C2H2®CH3CHO®CH3COOH®CH3COONa®CH4; б) CH4®CH3Cl®C2H6®C2H5Cl®C2H5OH®CH3CHO®CH3COOH® CH2ClCOOH; в) CaC2 ® C2H2 ® C6H6® C6H5CH3 ® C6H5COOH ® C6H5COONa. г) метан ®уксусно-этиловый эфир®ацетат натрия; д) изобутан ® пропионовый ангидрид®этан; е) карбонат кальция ®хлоруксусная кислота; ж) масляная кислота® изопропиловый эфир пропионовой кислоты Укажите условия протекания реакций и названия продуктов. | ||||
|
11-13 (2) | Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) CH3COOC2H5 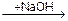 ? ? 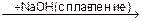 ?;
б) CH3COOC2H5 ?;
б) CH3COOC2H5 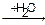 ? ? 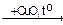 ? ? 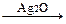 ? ? 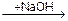 ;
в) CH3CH2CH2COOH ;
в) CH3CH2CH2COOH 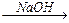 ? ? 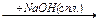 ? ? 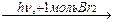 ? ? 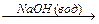 ? ? 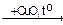 ? ? 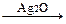 ? ?
| ||||
|
11-14 (3) | Массовая доля углерода в предельной одноосновной карбоновой кислоте составляет 54, 5%. Какая это кислота? Какие эфиры будут ее изомерами? | ||||
|
11-15 (3) | Относительная плотность паров предельной двухосновной карбоновой кислоты по воздуху равна 4, 07. Выведите молекулярную формулу карбоновой кислоты. | ||||
|
11-16 (3) | Относительная плотность паров органического соединения по неону равна 5, 1. Массовая доля углерода в этом веществе равна 58, 82%, массовая доля водорода равна 9, 8%, а остальное - кислород. Выведите молекулярную формулу органического соединения. Предложите возможные структуры. | ||||
|
11-17 (3) | Относительная плотность паров органического соединения по кислороду равна 4, 5. Массовая доля углерода в этом веществе равна 66, 67%, массовая доля водорода равна 11, 11%, массовая доля кислорода равна 22, 22%. Выведите молекулярную формулу органического соединения. | ||||
|
11-18 (3) | Относительная плотность паров органического соединения по гелию равна 15. При сжигании 18 г этого соединения образуется 26, 4 г оксида углерода (IV) и 10, 8 г воды. Выведите молекулярную формулу органического соединения. | ||||
|
11-19 (3) | При прокаливании на воздухе из 0, 395 г некоторого вещества получили 0, 140 г оксида кальция, из 0, 948 г этого же вещества – 537, 6 мл (н. у) CO2, а из 0, 869 г вещества – 0, 297 г H2O. Найдите формулу соединения. | ||||
|
11-20 (3) | При полном окислении 4, 8 г органического вещества было получено 2, 8 л оксида углерода (IV) (н. у. ), 2, 25 г воды и 2, 65 г карбоната натрия. Установите формулу вещества. | ||||
|
11-21 (3) | Для нейтрализации 4, 2 г одноосновной органической кислоты потребовалось 38, 15 г раствора с концентрацией едкого кали 2 моль/л и плотностью 1, 09 г/мл. Установите формулу кислоты. | ||||
|
11-22 (3) | Какой эфир одноосновной кислоты подвергся гидролизу, если 8, 22 мл этого эфира (r=0, 90 г/мл) прореагировала с 5, 6 г гидроксида калия? | ||||
|
11-23 (3) | Оливковое масло содержит 80% по массе триглицерида одноосновной ненасыщенной карбоновой кислоты с одной двойной связью в радикале. Определите формулу карбоновой кислоты, если известно, что 2, 21 кг оливкового масла содержит 2 моль этого триглицерида. | ||||
|
11-24 (3, 4) | При окислении 4, 6 г кислородсодержащего органического вещества образовалась кислота, на нейтрализацию которой было израсходовано 23, 68 мл раствора с массовой долей гидроксида калия 20% (r=1, 18 г/мл). Установите формулу исходного вещества. | ||||
|
11-25 (4) | Какая масса карбоната кальция потребуется для получения такого количества карбида кальция (углерод берется в избытке), которое достаточно для получения из ацетилена 45 г уксусной кислоты? | ||||
|
11-26 (4) | Найдите массу ацетата натрия, образующегося при действии избытка уксусной кислоты на 1, 61 г металлического натрия. | ||||
|
11-27 (4) | При окислении пропаналя получена пропионовая кислота массой 14, 8 г. Найдите массу окисленного альдегида. | ||||
|
11-28 (4) | Найдите массу метанола, полностью вступающего в реакцию этерификации с 50 г 84% раствора уксусной кислоты. | ||||
|
11-29 (4) | Для нейтрализации 26, 4 г масляной кислоты потребовалось 40 г раствора гидроксида натрия. Найдите массовую долю гидроксида натрия в этом растворе. | ||||
|
11-30 (4) | Найдите массу 95% раствора уксусной кислоты, необходимой для получения 22 г этилацетата. | ||||
|
11-31 (4) | Муравьиный альдегид, полученный окислением метана, окислили до муравьиной кислоты, которую нагрели в присутствии концентрированной серной кислотой. Для сжигания выделившегося газа потребовалось 5 л кислорода (н. у. ). Найдите объем исходного метана (н. у. ). | ||||
|
11-32 (4) | Какая масса соли образуется при реакции между оксидом углерода (II) объемом 2, 8 л, и гидроксидом натрия? | ||||
|
11-33 (4) | Вычислите массу уксусного ангидрида, который следует растворить в 14, 9 г воды, чтобы образовался раствор с массовой долей уксусной кислоты 95%. | ||||
|
11-34 (4) | Какую массу уксусного ангидрида требуется ввести в 300 г водного раствора уксусной кислоты (массовая доля кислоты 91%), чтобы получить безводную уксусную кислоту. Какова масса образовавшейся безводной уксусной кислоты? | ||||
|
11-35 (4) | Сколько граммов уксусного ангидрида нужно добавить, чтобы из 66, 4 г водного раствора, в котором содержится 24 г уксусной кислоты, получить раствор с массовой долей кислоты 50%? | ||||
|
11-36 (4) | Сколько тонн глицерина может выработать мыловаренный завод из 100 тонн технического жира, содержащего 40% трипальмитинового глицерида.. | ||||
|
11-37 (4) | Для полного гидрирования двойной связи в олеиновой кислоте, образовавшейся в результате гидролиза жира, потребовалось 26, 88 м3 водорода (при н. у. ). Какая масса жира, содержащего 90% триолеата подверглась гидролизу? | ||||
|
11-38 (3, 4) | Некоторый спирт подвергли окислению, при этом образовалась одноосновная карбоновая кислота. При сжигании 13, 2 г этой кислоты получили углекислый газ, для полной нейтрализации которого потребовалось 160 мл раствора с массовой долей гидроксида натрия 24% (r=1, 25 г/мл) с образованием средней соли. Установите формулу исходного спирта. | ||||
|
11-39 (4) | На 69 г муравьиной кислоты подействовали избытком серной кислоты и нагрели. Какую массу Fe3O4 можно восстановить до металла выделившимся газом? | ||||
|
11-40 (5) | Найдите объем водорода (н. у. ), выделяющегося при действии 64, 4 г муравьиной кислоты на 16, 8 г магния. | ||||
|
11-41 (5) | В процессе окислительного крекинга на 162, 4 г бутана подействовали 170 л кислорода (н. у. ). Найдите массу полученной уксусной кислоты. | ||||
|
11-42 (5) | Сколько литров водорода (при н. у. ) можно получить при взаимодействии 8, 05 г натрия с 26, 4 г масляной кислоты? | ||||
|
11-43 (5) | Рассчитайте массу уксусно-этилового эфира, образующегося при действии 120 г уксусной кислоты на 80, 5 г этилового спирта. | ||||
|
11-44 (5, 6) | Сколько граммов этилацетата можно получить из 11, 5 г этанола и 18 г уксусной кислоты, если выход реакции составляет 80% от теоретического? | ||||
|
11-45 (6) | При окислении 29 г пропаналя получена карбоновая кислота массой 22, 2 г. Найдите долю выхода продукта реакции. | ||||
|
11-46 (6) | Найдите объем (н. у. ) оксида углерода (II), полученного при нагревании с концентрированной серной кислотой муравьиной кислоты массой 55, 2 г, если доля выхода продуктов реакции составляет 80% от теоретически возможного. | ||||
|
11-47 (6) | Какие массы и каких веществ потребуются для получения 59, 2 г этилформиата, если выход реакции составляет 80% от теоретического? | ||||
|
11-48 (6) | Найдите массу муравьиной кислоты, необходимой для получения 207, 4 г фенилформиата, если доля выхода продуктов реакции составляет 85% от теоретически возможного. | ||||
|
11-49 (6) | Найдите массу карбида кальция, необходимую для получения 36 г уксусной кислоты. Содержание примесей в карбиде кальция равно 10% | ||||
|
11-50 (6) | Какой объем ацетилена (н. у. ) потребуется для получения 315 г уксусной кислоты, если общий выход процесса составляет 75% от теоретического? | ||||
|
11-51 (6) | Этанол, полученный при гидролизе 22 г этилацетата, подвергли внутримолекулярной дегидратации и получили 1, 792 л этена (н. у. ). Доля выхода продуктов описанных реакций относятся как 1: 2. Найдите доли выхода продуктов этих реакций. | ||||
|
11-52 (6) | К 188 г метилацетата, содержащего 20% примесей, добавили 280 г 40% раствора гидроксида калия и нагрели. Найдите массу полученного метанола, если доля выхода продуктов реакции составляет 85% от теоретически возможного. | ||||
|
11-53 (7) | К 15, 2 г смеси уксусной и муравьиной кислот прибавили 70 г раствора с массовой долей гидроксида калия 40%. После этого получившаяся смесь смогла прореагировать с 4, 48 л углекислого газа (н. у. ), причем образовалась кислая соль. Найдите массы кислот в исходной смеси. | ||||
|
11-54 (7) | После реакции 22, 6 г смеси двух одноосновных органических кислот с избытком аммиачного раствора оксида серебра образовалось 21, 6 г металла. Такое же количество исходной смеси может нейтрализовать 14, 8 г гидроксида кальция. Какие это кислоты и каковы их массы в смеси? | ||||
|
11-55 (7) | 8, 73 г смеси муравьиной, щавелевой (этандиовой) кислот и фенола может прореагировать с 85, 82 мл (r=1, 109) 10% раствора гидроксида калия. При обработке такой же массы этой смеси избытком бромной воды выделяется 6, 62 г осадка. Вычислить массовые доли каждого компонента в этой смеси. | ||||
|
11-56 (7) | Имеется смесь муравьиной, уксусной и щавелевой кислот. При полном окислении 3, 48 г такой смеси образуется 2, 016 л углекислого газа (н. у. ). На нейтрализацию такой же массы смеси потребовалось 140 г раствора с массовой долей гидроксида калия 2, 8%. Найдите массы компонентов в исходной смеси. | ||||
|
11-57 (7) | Для нейтрализации смеси уксусной кислоты и фенола потребовалось 45, 05 мл раствора с массовой долей гидроксида натрия 12% (r=1, 11 г/мл). При действии на такую же смесь бромной воды выпал осадок массой 33, 1 г. Найдите массы фенола и уксусной кислоты в исходной смеси. | ||||
|
11-58 (7) | При взаимодействии 28, 75 мл этилового спирта (r=0, 80 г/мл). со смесью муравьиной и уксусной кислот в присутствии серной кислоты при нагревании образовалось 41, 2 г смеси сложных эфиров. Считая, что спирт прореагировал полностью, определите массы образовавшихся эфиров. | ||||
|
XII | Углеводы. | ||||
|
12-1 (1) | Напишите структурные формулы всех форм глюкозы, находящихся в равновесии в водном растворе. | ||||
|
12-2 | Напишите циклические формы: а) крахмала, б) сахарозы, в) клетчатки. | ||||
|
12-3 (1, 2) | Сравните состав и свойства глюкозы и фруктозы. | ||||
|
12-4 (1, 2) | Сравните состав и свойства крахмала и целлюлозы. | ||||
|
12-5 (2) | Как различить вещества, находящиеся в склянках без этикеток: а) растворы глицерина и глюкозы; б) растворы глюкозы и сахарозы; в) глюкозы и формальдегида. Ответ мотивируйте. | ||||
|
12-6 (2) | С помощью каких химических реакций можно доказать, что глюкоза содержит: а) альдегидную группу б) пять гидроксильных групп в) две рядом стоящие гидроксильные группы. | ||||
|
12-7 (2) | Напишите реакции: а) восстановления глюкозы; б) с гидроксидом меди (II) при нагревании; в) с гидроксидом меди (II) при обычных условиях. | ||||
|
12-8 (2) | Какие из следующих углеводов подвергаются гидролизу: а) фруктоза; б) крахмал; в) сахароза; г) глюкоза; д) целлюлоза. Напишите соответствующие уравнения реакций. | ||||
|
12-9 (2) | Напишите уравнения реакций, при помощи которых можно из целлюлозы получить: а) этанол; б) уксусно-этиловый эфир; в) триацетат целлюлозы; г) уксусную кислоту. | ||||
|
12-10 (2) | Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: а) углерод ® крахмал ® глюкоза ® этанол ® дивинил. б) сахароза® глюкоза ® этанол® ацетальдегид®уксусная кислота в) целлюлоза® глюкоза®этанол®этилен® полиэтилен Укажите условия протекания реакций. | ||||
|
12-11 (3) | При полном сгорании 5, 4 г некоторого органического соединения, относительная молекулярная масса которого равна 180, образовалось 4, 032 л (н. у. ) углекислого газа и 3, 24 г воды. Определите молекулярную формулу этого соединения и предложите возможные структуры. | ||||
|
12-12 (3) | Три разных органических соединения имеют следующий состав: углерод – 40%, водород – 6, 67%, кислород – 53, 33%. Относительная молекулярная масса первого соединения равна 60, второго - 120, а третьего – 180. Определите их молекулярные формулы. | ||||
|
12-13 (4) | При спиртовом брожении глюкозы получено 322 г этанола. Сколько граммов глюкозы израсходовалось и какой объем углекислого газа образовался при этом? | ||||
|
12-14 (5) | 27 г глюкозы подвергли полному брожению, после чего весь выделившийся углекислый газ поглотили прозрачной известковой водой, содержащей 11, 1 г гидроксида кальция. Останется ли поглощающий раствор прозрачным или в нем появится осадок? | ||||
|
12-15 (6) | Массовая доля крахмала в картофеле составляет 20%. Вычислите массу глюкозы, которую можно получить из 1 т картофеля, если выход глюкозы равен 75% от теоретического. | ||||
|
12-16 (6) | Из крахмала массой 32, 4 г получена глюкоза, выход которой составил 80%. К глюкозе добавлен избыток аммиачного раствора оксида серебра. Рассчитайте массу серебра, образовавшегося при этом. | ||||
|
12-17 (6) | При молочнокислом брожении 45 кг глюкозы получено 32, 4 кг молочной кислоты. Вычислите выход продукта реакции (в %) от теоретического. | ||||
|
12-18 (6) | Определите массу крахмала, который надо подвергнуть гидролизу, чтобы из полученной глюкозы при молочнокислом брожении образовалась молочная кислота массой 135 г. Массовая доля выхода продукта гидролиза крахмала равна 80%, продукта брожения глюкозы - 75%. | ||||
|
12-19 (6) | Рассчитайте, какой объем 90% уксусной кислоты (r=1 г/мл) потребуется для полной этерификации целлюлозы, содержащей в 500 кг древесины, считая, что целлюлозы в древесине 50% по массе. | ||||
|
12-20 (6) | Найдите массу глюкозы, которая была подвергнута спиртовому брожению, если при этом выделилось столько же углекислого газа, сколько его образуется при сгорании 120 мл метанола (r=0, 80 г/мл), причем реакция горения протекает количественно. выход реакции брожения составляет 80% от теоретического. | ||||
|
12-21 (6) | Рассчитайте, какой объем 98% процентной азотной кислоты (r=1500 кг/м3) потребуется для получения тринитроцеллюлозы массой 2 т при выходе 90% от теоретического. | ||||
|
12-22 (6) | Вычислите, сколько килограммов древесных опилок, содержащих 60% чистой целлюлозы, надо взять, чтобы в результате трехстадийного процесса получить 1120 л этилена. Выход на первой стадии равен 80%, на второй – 70%, на третьей – 85%. Напишите уравнения реакций всех протекающих процессов. | ||||
|
12-23 (6) | При гидролизе 486 г крахмала получена глюкоза (выход глюкозы равен 80%), которую подвергли спиртовому брожению. В результате получили 1500 г водного раствора спирта. Вычислите массовую долю этанола в этом растворе, учитывая, что выход этанола в реакции брожения составил 70% от теоретического. | ||||
|
12-24 (7) | 54 г смеси фенола и глюкозы растворены в воде и к полученному раствору прибавили избыток аммиачного раствора оксида серебра при нагревании, при этом образовался осадок массой 21, 6 г. Определите массовые доли компонентов в смеси. | ||||
|
12-25 (7) | 2, 1 г смеси формальдегида и глюкозы растворены в воде и полученный раствор прибавлен к аммиачному раствору оксида серебра, приготовленному из 35, 87 мл 34% раствора нитрата серебра (r=1, 4 г/мл). Выпавший осадок отфильтровали и к нейтрализованному азотной кислотой фильтрату прибавили избыток раствора хлорида калия. При этом выпало 5, 74 г осадка. Определите состав исходной смеси. | ||||
|
12-26 (7) | 20 г смеси фруктозы, муравьиного альдегида и глюкозы растворили в воде и к полученному раствору прибавили избыток аммиачного раствора оксида серебра при нагревании, при этом образовался осадок массой 73, 44 г и выделилось 3, 36 л газа (н. у. ). Определите массовые доли компонентов в смеси. | ||||
|
XIII | Амины. Анилин | ||||
|
13-1 (1) | Напишите структурные формулы изомерных аминов с общей молекулярной формулой: а) CH5N; б) CH6N2; в) C4H11N; г) C5H13N; д) C3H7N; е) C4H9N. Назовите эти вещества. | ||||
|
13-2 (1) | Напишите структурные формулы следующих веществ: а) 2-амино-2, 3, 3-триметилгексан; б) 2-амино-2, 3-диметил-3-изопропил-4-этилоктан; в) метилтретбутиламин; г) диметилтретбутиламин. | ||||
|
13-3 (1) | Напишите структурные формулы изомерных аминов с общей молекулярной формулой: а) C7H9N; б) C8H11N, если их молекулы содержат бензольное ядро Назовите эти вещества. | ||||
|
13-4 (1) | Сравните основные свойства следующих веществ а) аммиак, метиламин, анилин; б) аммиак, фениламин, дифениламин; в) аммиак, метилбутиламин, метилтретбутиламин; Ответ мотивируйте. | ||||
|
13-5 (2) | Напишите уравнения реакций, характеризующих химические свойства: а) метиламина; б) этиламина; в) изопропиламина; г) анилина. Укажите условия протекания реакций и названия продуктов. | ||||
|
13-6 (2) | Напишите уравнения реакций, с помощью которых можно получить: а) метиламин; б) этиламин; в) изопропиламин. | ||||
|
13-7 (2) | Восстановлением каких нитросоединений можно получить: а) 1-аминопропан; б) вторбутиламин; в) анилин; в) о-метиланилин. Напишите уравнения соответствующих реакций. | ||||
|
13-8 (2) | Из каких галогенопроизводных можно получить: а) этиламин; б) анилин; в) п-метиланилин; г) метилпропиламин. Напишите уравнения соответствующих реакций. | ||||
|
13-9 (2) | Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения. Укажите условия протекания реакций, назовите вещества. а) CH3COONa ® CH4 ® CH3Cl ® C2H6 ® C2H5NO2 ® C2H5NH2 ® ®C2H5NH3Br; б) CH4 ® C2H2 ® C6H6 ® C6H5NO2 ® C6H5NH2 ® C6H2Br3NH2; в) карбонат кальция® анилин; г) углерод ® о-метиланилин; д) карбид алюминия ® триэтиламин; е) этилформиат ® 2, 4, 6-триброманилин. ж) метан ® 2-аминобутан. | ||||
|
13-10 (2) | Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения. Укажите условия протекания реакций, назовите вещества.
а) пропанол-1 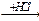 ? ? 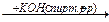 ? ? 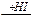 ? ? 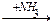 ? ? 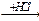 ?
б) этаналь ?
б) этаналь 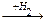 ? ? 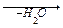 ? ? 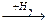 ? ? 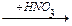 ? ? 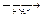 ? ?
| ||||
|
13-11 (3) | Для сгорания 6 моль вещества потребовалось 13, 5 моль кислорода и образовалось 6 моль углекислого газа, 3 моль азота и 15 моль воды. Установите молекулярную формулу вещества. | ||||
|
13-12 (3) | Относительная плотность паров предельного амина по кислороду равна 1, 844. Выведите молекулярную формулу амина. | ||||
|
13-13 (3) | Относительная плотность паров ароматического амина по метану равна 6, 69. Выведите молекулярную формулу амина. | ||||
|
13-14 (3) | Массовая доля углерода в диамине равна 48, 65%, массовая доля азота равна 37, 84%. Выведите молекулярную формулу диамина. | ||||
|
13-15 (3) | Массовая доля углерода в моноамине равна 63, 16%, массовая доля азота равна 24, 56%. Выведите молекулярную формулу амина. | ||||
|
13-16 (3) | Относительная плотность паров органического соединения по водороду равна 43, 5. При сгорании 17, 4 г этого вещества образуется 44 г углекислого газа, 2, 24 л азота (н. у. ) и 23, 4 г воды. Выведите молекулярную формулу органического соединения. | ||||
|
13-17 (3) | Относительная плотность паров органического соединения по этану равна 1, 5. При сгорании 9 г этого вещества образуется 8, 96 л углекислого газа, 12, 6 г воды и 2, 24 л азота (н. у. ). Выведите молекулярную формулу органического соединения. | ||||
|
13-18 | Какой объем азота (н. у. ) образуется при сгорании 22, 5 г этиламина? | ||||
|
13-19 (4) | Найдите массу нитробензола, необходимого для получения 27, 9 г анилина. | ||||
|
13-20 | Найдите объем ацетилена, необходимого для получения 83, 7 г анилина. | ||||
|
13-21 (4) | какой объем хлороводорода может вступить в реакцию с этиламином, синтезированным из 4 л метана (н. у. )? | ||||
|
13-22 (4) | Хлороводород, выделившийся при полном хлорировании 5, 04 л метана (н. у. ), пропустили через 55, 8 г анилина. Определите массу соли, образовавшейся при этом. | ||||
|
13-23 (5) | Через раствор, содержащий 7, 75 г метиламина, пропустили 6, 72 л хлороводорода (н. у. ). Найдите массу образовавшейся соли. | ||||
|
13-24 (5) | Найдите массу 2, 4, 6-триброманилина, полученного при действии 24 г брома на 18, 6 г анилина. | ||||
|
13-25 (6) | Найдите массу анилина, полученного восстановлением 39, 4 г нитробензола, содержащего 6% примесей. | ||||
|
13-26 (6) | Найдите массу 20% раствора соляной кислоты, реагирующей без остатка с 200 г анилина, содержащего 7% примесей. | ||||
|
13-27 (6) | При восстановлении 61, 5 г нитробензола получен анилин массой 27, 9 г. Найдите долю выхода продукта реакции. | ||||
|
13-28 (6) | Найдите массу 2, 4, 6-триброманилина, полученного при действии избытка брома на 27, 9 г анилина, если доля выхода продукта реакции составляет 80% от теоретически возможного. | ||||
|
13-29 (6) | Найдите массу 1-бромпропана, необходимого для получения 26, 55 г 1-аминопропана, если доля выхода продуктов реакции составляет 75% от теоретически возможного. | ||||
|
13-30 (6) | На 14, 75 г пропиламина подействовали 121, 5 г 20% раствора бромоводородной кислоты. Найдите массу полученной соли, если доля выхода продуктов реакции составляет 90% от теоретически возможного. | ||||
|
13-31 (6) | При нитровании 156 г бензола смесью концентрированных серной и азотной кислот было получено мононитропроизводное с выходом реакции 85% от теоретического. Продукт реакции восстановили водородом в момент выделения, и выход этой реакции составил 70% от теоретического. Какова масса и объем конечного продукта, если его плотность равна 1, 02 г/мл? | ||||
|
13-32 (7) | Смесь фенола и анилина прореагировала с 56 г раствора, в котором массовая доля гидроксида калия 5%. Эта же смесь может прореагировать с бромной водой, содержащей 72 г брома. Определите массы фенола и анилина в исходной смеси. | ||||
|
13-33 (7) | Через 50 г смеси фенола, анилина и бензола пропустили газообразный хлороводород, при этом выпал осадок массой 12, 95 г. с такой же смесью полностью прореагировал раствор, содержащий 6 г едкого натра. Найдите массовые доли компонентов в смеси. | ||||
|
13-34 (7) | 25 г смеси фенола и анилина с бензолом встряхивали с водным раствором щелочи, при этом масса смеси уменьшилась на 4, 7 г. Затем оставшуюся часть встряхивали с соляной кислотой, после чего ее масса уменьшилась еще на 9, 3 г. Определите массовый состав смеси. | ||||
|
13-35 (7) | Через 60 г смеси бензола, фенола и анилина пропустили хлороводород. Масса образовавшегося осадка, который отделили фильтрованием, составила 25, 9 г. На фильтрат подействовали раствора гидроксида натрия, в результате чего он разделился на два слоя. Найдите состав смеси, если объем верхнего слоя составил 19, 5 мл (r=0, 8). | ||||
|
13-36 (7) | Продукты полного сгорания пропана и метиламина обработали избытком известковой воды. При этом образовалось 140 г осадка, а объем не поглощенного водой газа в 2, 5 раза меньше объема исходной смеси. Определить состав исходной смеси. | ||||
|
13-37 (7) | При дегидрировании смеси циклогексана и циклогексена в бензол выделился водород в количестве, необходимом для полного восстановления 24, 6 г нитробензола в анилин. Найти состав исходной смеси, если известно, что такое же количество этой смеси может обесцветить 1600 г 2% водного раствора брома. | ||||
|
XIV |
Аминокислоты | ||||
|
14-1 (1) | Напишите структурные формулы всех изомерных веществ с молекулярной формулой: а) C3H7O2N; б) C4H9O2N. Назовите эти вещества. | ||||
|
14-2 (1) | Напишите структурные формулы изомерных предельных моноаминокарбоновых кислот с: а) пятью атомами углерода в молекуле. б) шестью атомами углерода в молекуле. Назовите эти вещества. | ||||
|
14-3 (2) | Какая из кислот обладает более сильными кислотными свойствами - a-аминомасляная или b-аминомасляная?. Ответ мотивируйте. | ||||
|
14-4 (2) | Какая из кислот обладает более сильными основными свойствами - a-аминомасляная или b-аминомасляная?. Ответ мотивируйте. | ||||
|
14-5 (2) | Напишите уравнения реакций, характеризующих химические свойства: а) a-аминопропионовой кислоты; б) b-аминопропионовой кислоты. | ||||
|
14-6 (2) | Какая из перечисленных аминокислот не имеет оптических изомеров: а) глицин; б) аланин; в) b-аминопропионовая; г) b-аминомасляная? | ||||
|
14-7 | Напишите уравнения реакций образования: а) дипептидов из глицина и аланина; б) трипептида Ала-Гли-Ала. | ||||
|
14-8 (2) | Напишите уравнения реакций, с помощью которых можно получить: а) аминоуксусную кислоту из уксусной; б) a-аминомасляную кислоту из масляной. | ||||
|
14-9 (2) | Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: а) карбид алюминия ® a-аминомасляная кислота; б) метан ® b-аминопропионовая кислота; в) 1, 4-дихлорбутан ® 2-амино-2-метилпропановая кислота; г) этилен ® этиловый эфир 2-аминобутановой кислоты; д) ацетилен ® глицил-глицин | ||||
|
14-10 (2) | выведите молекулярную формулу моноаминокарбоновой кислоты, массовая доля азота в которой составляет 11, 97%. | ||||
|
14-11 (3) | Массовая доля кислорода в предельном эфире аминоуксусной кислоты составляет 27, 35%. Напишите возможные структурные формулы этого эфира. | ||||
|
14-12 (4) | Какой минимальный объем аммиака (н. у. ) необходим для получения 52, 5 г глицина из хлоруксусной кислоты? | ||||
|
14-13 (4) | Считая выход реакций на всех стадиях равным теоретическому, определите, какую массу аминоуксусной кислоты можно получить исходя из 30 г карбида кальция, содержащего 4% примесей, используя на промежуточной стадии реакцию Кучерова. | ||||
|
14-14 (4) | Найдите массу соли, образующейся при пропускании избытка бромоводорода через раствор, содержащий 80, 1 г аланина. | ||||
|
14-15 (4) | 45 г глицина полностью вступает в реакцию. с 292 г раствора соляной кислоты. Найдите массовую долю хлороводорода в этом растворе. | ||||
|
14-16 (4) | Найдите массу 14% раствора гидроксида калия, необходимого для нейтрализации 78, 6 г e-аминокапроновой кислоты. | ||||
|
14-17 (4) | Найдите массу соли, образующейся при действии 80 г 25% раствора едкого натра на 46, 8 г b-аминомасляной кислоты. | ||||
|
14-18 (5) | Найдите массу соли, образующейся при пропускании 2, 8 л (н. у. ) хлороводорода через 150 г 6% раствор аминоуксусной кислоты. | ||||
|
14-19 (5) | При аминировании 198, 9 г бромпропионовой кислоты образовалось 97, 2 г a-аланина. Найдите долю выхода продуктов реакции. | ||||
|
14-20 (6) | Какую массу дипептида глицил-глицина можно получить из 105 г аминоуксусной кислоты, если доля выхода продуктов реакции составляет 75% от теоретически возможного? | ||||
|
14-21 (3, 7) | 38, 2 г смеси a-аминокислоты и первичного амина (молярное соотношение 3: 1) могут прореагировать с 40 г 36, 5% соляной кислоты. Определите качественный и количественный состав исходной смеси, если известно, что оба вещества содержат одинаковое число атомов углерода | ||||
|
14-22 (3, 7) | 6 г смеси аминокислоты и первичного амина (молярное соотношение 1: 1) могут прореагировать с 20 г 40, 5% бромоводородной кислоты. Определите качественный и количественный состав исходной смеси, если известно, что оба вещества содержат одинаковое число атомов углерода | ||||
|
14-23 (3, 7) | 31, 5 г смеси аминокислоты и вторичного амина (молярное соотношение 3: 2) могут прореагировать с 100 г 18, 25% соляной кислоты. Определите качественный и количественный состав исходной смеси, если известно, что оба вещества содержат одинаковое число атомов углерода | ||||
|
XV |
Комбинированные задачи | ||||
|
15-1 (1) | Вещество состава C7H8 взаимодействует с бромом, легко нитруется, давая взрывчатое вещество, обесцвечивает раствор перманганата калия. Что это за вещество? | ||||
|
15-2 (1, 3) | Некоторое количество используемого в промышленности низкокипящего углеводорода (т. кип. ниже 50оС) при взаимодействии с избытком хлора дает 39, 2 г продукта, а с избытком брома – 74, 8 г продукта (условия реакции таковы, что замещение практически не протекает). Что это за углеводород и где он используется? | ||||
|
15-3 (1, 3) | Массовая доля углерода в некотором углеводороде равна 85, 7%. 90% атомов водорода эквивалентны (структурно идентичны). Какой это может быть углеводород? | ||||
|
15-4 (1, 3) | Массовая доля углерода в некотором углеводороде равна 86, 96%. Все атомы водорода эквивалентны (структурно идентичны). Какой это может быть углеводород? | ||||
|
15-5 (1, 3) | Относительная плотность некоторого углеводороде по кислороду равна 3, 5. 75% атомов водорода эквивалентны (структурно идентичны). Какой это может быть углеводород? | ||||
|
15-6 (1, 3) | 21, 2 г газообразного углеводорода поглотили 23744 мл водорода при нагревании над платиновым катализатором. Определите возможные структуры углеводорода. | ||||
|
15-7 (2) | Предложите способ химической очистки уксусной кислоты от небольших количеств содержащихся в ней примесей муравьиной кислоты и метилового спирта, используя только неорганические реактивы. | ||||
|
15-8 (2) | Напишите уравнения реакций, с помощью которых можно осуществить превращения: а) CH4 ® C2H2 ® уксусный альдегид ® диэтиловый эфир®этилен; б) ацетилен®бензол ® хлорбензол ® фенол ® тринитрофенол; в) гексан ® анилин. | ||||
|
15-9 (2) | Имеются бутин-1 и бутин-2. Как их различить? Дайте соответствующие пояснения. Напишите уравнения реакций. | ||||
|
15-10 (2) | Из пентена-1 получите пентен-2. Напишите уравнения соответствующих реакций. | ||||
|
15-11 (2) | Имеются два соединения: C2H4O2 и его ближайший гомолог. Оба вещества образуют ангидриды, сложные эфиры, изменяют окраску индикаторов, взаимодействуют со щелочами, но только одно из них восстанавливает серебро из аммиачного раствора оксида серебра (I) и разлагается в присутствии концентрированной серной кислоты. Назвать вещества и написать все реакции. | ||||
|
15-12 (2) | В семи пронумерованных пробирках находятся следующие вещества: водный раствор фенола, уксусная кислота, этилформиат, ацетальдегид, , гексен-1, этанол, бензол. Провели некоторые реакции и выяснили: а) с натрием реагируют вещества в пробирках 1, 2, 6; б) с гидроксидом натрия – 1, 2, 3; в) с водным раствором брома – 1, 5; г) с аммиачным раствором оксида серебра – 3, 4. В каких пробирках находятся какие вещества? | ||||
|
15-13 (2) | В трех пробирках находятся смеси: а) метанола и толуола; б) ) метанола и этиленгликоля; в) метанола и хлороформа. С помощью какого одного вещества можно определить содержимое пробирок. | ||||
|
15-14 (2) | В трех пробирках находятся смеси: а) спирта и бензола; б) ) спирта и уксусной кислоты; в) спирта и тетрахлорметана. С помощью какого одного вещества можно определить содержимое пробирок. | ||||
|
15-15 (2) | В трех пробирках имеются растворы хлороводорода в метаноле, диэтиловом эфире и уксусной кислоте. Как, проведя не более двух различных опытов, определить содержимое каждой пробирки? | ||||
|
15-16 (2) | В трех пробирках имеются 0, 25 моль/л растворы брома в бензоле, тетрахлорметане и гексане. Как, проведя не более двух различных опытов, определить содержимое каждой пробирки? | ||||
|
15-17 (3) | Из 30, 6 г непредельного углеводорода в результате реакции с бромом образуется 102, 6 г дибромида. Известно, что продукт гидрирования исходного углеводорода взаимодействует с хлором при нагревании и освещении, давая только одно монохлорпроизводное. Какова структура непредельного углеводорода? | ||||
|
15-18 (3) | Из 4, 1 г непредельного углеводорода в результате реакции с бромом образуется 12, 1 г дибромида. Известно, что продукт гидрирования исходного углеводорода взаимодействует с хлором при нагревании и освещении, давая только одно монохлорпроизводное. Какова структура непредельного углеводорода? | ||||
|
15-19 (3) | При сжигании 4, 32 г вещества образовалось 6. 72 л углекислого газа и 6, 48 г паров воды. Определите молекулярную формулу вещества, если 36 г его при 177оС и давлении 6, 54 атм. занимают объем 2, 82 л. | ||||
|
15-20 (3) | Углеводород содержит 85, 7% углерода. Определите молекулярную формулу вещества, если 4, 2 г его при 127оС и давлении 5 атм. занимает объем 328 мл. | ||||
|
15-21 (3) | 4, 86 г дипептида сожгли в избытке кислорода. Смесь газообразных веществ пропустили через трубку с оксидом фосфора (V), а затем через раствор гидроксида кальция. Из полученной смеси удалили кислород и измерили объем оставшегося газа, который оказался равным 672 мл (н. у. ). Масса трубки с оксидом фосфора (V) увеличилась на 2, 7 г. Масса выпавшего осадка равна 15 г. Определите формулу дипептида, если известно, что одна из аминокислот – глицин. | ||||
|
15-22 (4) | В производстве ацетатного волокна получают эфир целлюлозы и уксусной кислоты. Составьте уравнения реакции, считая, что при этерификации образуется диацетилцеллюлоза. Сколько диацетилцеллюлозы образовалось, если во взаимодействие с целлюлозой вступило 37, 5 г 80% раствора уксусной кислоты? | ||||
|
15-23 (7) | На гидрирование 5 л смеси бутена-1 и бутадиена-1, 3 потребовалось 6 л водорода (н. у. ). Определите массовые и объемные доли веществ в исходной смеси. | ||||
|
15-24 (7) | На гидрирование 28 л смеси гексена-1 и гексина-1 потребовалось 33, 6 л водорода (н. у. ). Определите массовые и объемные доли веществ в исходной смеси. | ||||
|
15-25 (7) | На гидрирование 4, 2 л смеси этена и этина потребовалось 7 л водорода (н. у. ). Определите массовые и объемные доли веществ в исходной смеси. | ||||
|
15-26 (7) | Для нейтрализации смеси карболовой кислоты и этилового спирта потребовалось 50 мл 40% раствора гидроксида калия (r=1, 4 г/см3). При обработке этой смеси металлическим натрием могло бы выделиться 6, 72 л газа (н. у. ). Определите массовые доли компонентов в исходной смеси. | ||||
|
15-27 (7) | При полном сгорании 3, 2 г смеси неопентана и пентена-1 выделилось 5, 04 л углекислого газа (н. у. ). Определите массовые доли компонентов в смеси и их количество. | ||||
|
15-28 (7) | При полном сгорании 256 мг смеси гексана и гексена-2 выделилось 403, 2 мл углекислого газа (н. у. ). Определите количественный состав смеси. | ||||
|
15-29 (7) | При полном сгорании 1, 5 г смеси изопрена и циклопентана выделилось 2464 мл углекислого газа (н. у. ). Определите количественный состав смеси. | ||||
|
15-30 (7) | Продукты полного сгорания смеси пропана и метиламина в избытке кислорода пропустили через избыток раствора гидроксида бария, в результате чего образовалось 98, 5 г осадка. Не поглощенные при этом газы пропустили над раскаленной медью. При этом приведенный к нормальным условиям объем газа стал в 5 раза меньше объема исходной смеси пропана и метиламина (н. у. ). Определите массовые доли веществ в исходной смеси газов. | ||||
|
15-31 (7) | Продукты полного сгорания смеси бутана и этиламина в избытке кислорода пропустили через избыток раствора гидроксида кальция, в результате чего образовалось 40 г осадка. Не поглощенные при этом газы пропустили над раскаленной медью. При этом приведенный к нормальным условиям объем газа стал в 4 раза меньше объема исходной смеси пропана и метиламина (н. у. ). Определите массовые доли веществ в исходной смеси газов. | ||||
Молекулярные массы некоторых
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|
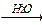 ?
? 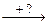 CH3Cl
CH3Cl 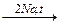 ?
? 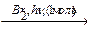 ?
? 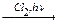 (два вещества)
(два вещества)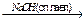 ?
? 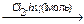 ?
? 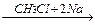 ???
??? 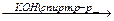 ?
? 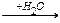 ?
? 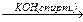 ?
? 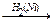 ?
? 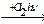 ?
? 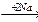 ? Назовите все вещества..
? Назовите все вещества.. 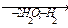 ?
? 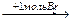 ?
? 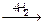 ?
? 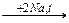 ?
? 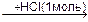 ?
? 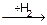 ?
? 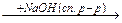 ?
? 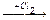 ?
? 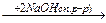 ?
? 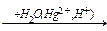 ?
? 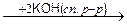 ?
? 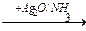 ?
? 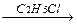 ?
? 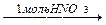 ?;
?; 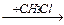 ?
? 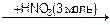 ?
? 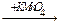 ?
? 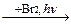 ?
? 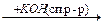 ? ®1, 3, 5-триметилбензол.
? ®1, 3, 5-триметилбензол. 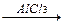 ?
? 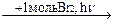 ?
? 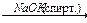 ?
? 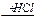 ?
? 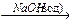 ?
? 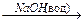 ?
?  ?
? 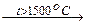 ?
? 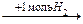 ?
? 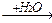 ?
? 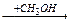 ???
??? 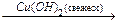 ?
?