
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Направление протекания окислительно-восстановительных реакций
Направление протекания окислительно-восстановительных реакций
По величинам Е0 можно определить ЭДС (∆ Е0) ОВР и направление её самопроизвольного протекания. Реакция протекает самопроизвольно, если ЭДС больше нуля. Если ЭДС меньше нуля, реакция идет в обратном направлении.
ЭДС = Е0 окисл. – Е0 вос-ль > 0
Т. е. для протекания окислительно-восстановительной реакции окислительный потенциал окислителя должен быть больше окислительного потенциала восстановителя.
Рассчитаем ЭДС реакции восстановления перманганата калия в кислой среде.
2KMnO4 + 5Na2SO3 + 3H2SO4 → 2MnSO4 + 5Na2SO4 + K2SO4 +3H2O
Е0 MnO4- + 8H+ / Mn2+ + 4H2O = +1, 51 В
Е0 SO42- + 2H+ / SO32- + H2O = +0, 22 В
ЭДС = Е0 окисл. – Е0 вос-ль > 0
KMnO4 – окислитель
Na2SO3 – восстановитель
ЭДС = 1, 51 – 0, 2 = 1. 29 В > 0, следовательно реакция идет в прямом направлении (слева направо).
Вывод: Всегда системы с более высоким значением Е0 будут окислять системы с более низким его значением.
Однако, в случаях, когда значения Е0 окислителя и восстановителя близки, направление протекания процесса может изменяться в зависимости от концентрации участников процесса.
Термодинамика электродных процессов
Гальванический элемент (Г. Э. ) – прибор, в котором происходит преобразование энергии химической окислительно-восстановительной реакции в электрическую энергию (ХИТ – химический источник тока).
При работе Г. Э. электрохимическая система с более высоким значением электродного потенциала выступает в качестве окислителя, а с более низким – в качестве восстановителя.
Стандартная ЭДС (∆ Е0) гальванического элемента связана со стандартной энергией Гиббса протекающей в нем реакции соотношением
- DG0 = n F∆ E0
С другой стороны, DG0 связана с константой равновесия реакции уравнением
DG0 = - RT ln Kравн
Объединяя оба уравнения, получаем
n F∆ E0 = 2. 3 RT lg Kравн,
выразив из предыдущего уравнения lgKравн и подставив значения постоянных величин (Т = 298 К; R = 8. 413 Дж/К∙ моль; F = 96500 Кл/моль – число Фарадея) получаем 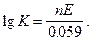
Так как ∆ Е0 = Е0окисл. - Е0восст. , то получаем lgKравн = (Е0окисл. - Е0восст) ∙ n /0. 059.
Таким образом: 1) если Е0окисл. - Е0восст > 0, реакция полностью протекает до конца (необратима), Kравн – большая величина;
2) Е0окисл. - Е0восст < 0, реакция идет в обратном направлении, Kравн – маленькая величина;
3) Е0окисл. - Е0восст = 0, Kравн = 1, имеет место равновесие, реакция не может протекать в сторону образования продуктов без изменения условий.
Пример: Sn2+ + 2Fe3+ « Sn4+ + 2Fe2+
Е0 Sn4+/ Sn2+ = 0. 15 В; Е0 Fe3+/ Fe2+ = 0. 77 В
Так как Е0 (Fe3+/ Fe2+) > Е0 (Sn4+/ Sn2+), то Fe3+ будет окислителем, а Sn2+ - восстановителем.
lgKравн = (0. 77 – 0. 15)∙ 2/0. 059 = 21, т. е Kравн = 1021
Так как Kравн – большая положительная величина, реакция протекает необратимо, равновесие сдвинуто в сторону образования продуктов реакеции.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|