
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Лабораторная работа № 2. ЗАМЕРЗАНИЕ РАСТВОРОВ ЭЛЕКТРОЛИТОВ. 1. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Лабораторная работа № 2
ЗАМЕРЗАНИЕ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
Цель работы: определить температуру замерзания растворителя (воды), 1-моляльного раствора KCl и 2, 5-моляльного раствора KCl; вычислить степень диссоциации растворов хлорида калия и сравнить их между собой.
1. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Задание выполняется на установке, которая представлена на рисунке 1.
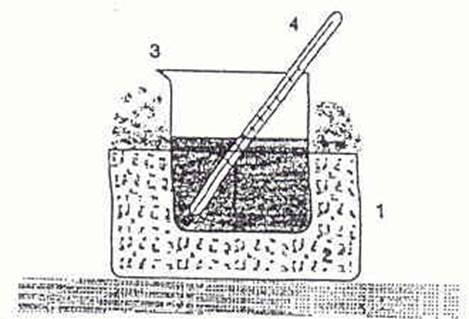
Рис. 1 Схема установки для определения температуры замерзания:
1 - кристаллизатор; 2 - охлаждающая смесь; 3 - стакан с водой или раствором; 4 – термометр
В кристаллизаторе 1 приготовьте охлаждающую смесь, состоящую из снега и поваренной соли: 3-5 чайных ложек соли на 5-8 ложек снега.
В стакан 3 налейте 5 -6 мл дистиллированной воды и поместите его в охлаждающую смесь.
Помешивая воду термометром (осторожно, чтобы не разбить термометр), определите температуру замерзания воды. Температурой замерзания считать ту, которую покажет термометр после появления первого кристаллика льда в замораживаемой жидкости.
Аналогично определите температуру замерзания 1-моляльного и 2, 5 моляльного раствора хлорида калия. Результаты представьте в виде таблицы.
Таблица
| Система | tзам | Δ tзам | Изотонический коэффициент i | Степень диссоциации α |
| H2O | - | - | - | |
| 1-моляльный раствор KCl | ||||
| 2, 5-моляльный раствор KCl |
Рассчитайте изотонический коэффициент i. используя формулу
Δ tзам = i∙ K∙ Cm,
где Δ tзам = tзам( р-ля) - tзам( р-ра)
K- криоскопическая константа растворителя, К(H2O)=1, 86;
Cm- моляльность раствора,
По полученным данным рассчитайте степень диссоциации раствора KCl в воде по формуле α = 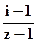 , где z – число ионов, на которые распадается данная молекула.
, где z – число ионов, на которые распадается данная молекула.
Постройте график зависимости температуры замерзания раствора от концентрации растворенной соли.
Сделайте выводы:
1) сравните температуру замерзания растворителя и растворов, сравните температуру замерзания двух растворов разной концентрации;
2) сравните степени диссоциации двух растворов разной концентрации.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|