
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Физика атома 1 страница
Стр 1 из 2Следующая ⇒
| 1. | Ядерная модель атома Резерфорда. Запишите формулу Резерфорда (с пояснениями).
Ядерная модель атома Резерфорда:
1) атом состоит из ядра и электронной оболочки (электроны, обращаются по круговым орбитам вокруг ядра);
2) электрический заряд ядра 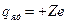 ; суммарный электрический заряд электронов ; суммарный электрический заряд электронов 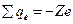 ; полный заряд атома ; полный заряд атома 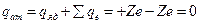 ;
3) масса ядра ;
3) масса ядра 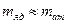 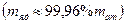 − основная масса атома сосредоточена в его ядре;
4) размеры атомного ядра − основная масса атома сосредоточена в его ядре;
4) размеры атомного ядра 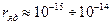 м; размеры атома м; размеры атома 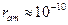 м.
Формула Резерфорда позволяет рассчитать относительное число частиц, рассеянных ядрами фольги в элементарном телесном угле м.
Формула Резерфорда позволяет рассчитать относительное число частиц, рассеянных ядрами фольги в элементарном телесном угле 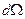 под углом под углом 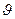 к первоначальному направлению их движения: к первоначальному направлению их движения:
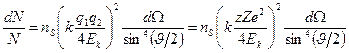 ;
где ;
где 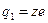 и и 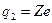 − заряды частицы и ядра, − заряды частицы и ядра, 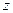 и и 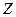 − зарядовые числа частицы и ядра, − зарядовые числа частицы и ядра, 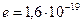 Кл − элементарный электрический заряд, Кл − элементарный электрический заряд, 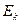 − кинетическая энергия налетающей частицы, коэффициент − кинетическая энергия налетающей частицы, коэффициент 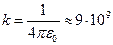 (Н∙ м2)/Кл2 в СИ и (Н∙ м2)/Кл2 в СИ и 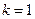 в СГСЭ; в СГСЭ; 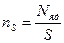 − число ядер на единицу площади поверхности рассеивающего слоя (фольги), − число ядер на единицу площади поверхности рассеивающего слоя (фольги), 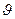 − угол, на который рассеивается заряженная частица, − угол, на который рассеивается заряженная частица, 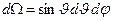 − элементарный телесный угол. − элементарный телесный угол.
|
| 2. | Виды спектров. Какие вещества дают линейчатые, полосатые и сплошные спектры излучения? Сформулируйте комбинационный принцип Ритца.
Виды спектров: различают спектры испускания (которые дают вещества при высоких температурах) и спектры поглощения (которые дают те же вещества при низких температурах при прохождении через них излучения со сплошным спектром).
Спектры испускания:
сплошной спектр испускания дают твердые и жидкие тела при высоких температурах;
линейчатый спектр испускания дают разряженные одноатомные газы при высоких температурах, это спектр испускания не взаимодействующих атомов, поэтому также называется атомным спектром. Линейчатый спектр состоит из отдельных узких спектральных линий (для атома каждого химического элемента характерен свой набор спектральных линий);
полосатый спектр испускания дают многоатомные газы при высоких температурах; полосатый спектр состоит из тесно расположенных узких спектральных линий, которые образуют группы линий − полосы.
Комбинационный принцип Ритца:
Все многообразие спектральных линий рассматриваемого атома может быть получено путем попарных комбинаций величин, называемых спектральными термами атома:
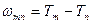 ,
где ,
где 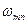 − циклическая частота фотона, испускаемого атомом, − циклическая частота фотона, испускаемого атомом, 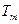 и и 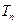 − спектральные термы данного атома ( − спектральные термы данного атома ( 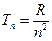 − спектральный терм атома водорода), − спектральный терм атома водорода),  − порядковый номер терма; − порядковый номер терма; 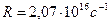 − постоянная Ридберга. − постоянная Ридберга.
|
| 3. | Сформулируйте постулаты Бора. Сформулируйте правило квантования орбит Бора. Запишите выражение для энергии 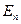 водородоподобного атома в стационарном состоянии и приведите схему энергетических уровней водородоподобного атома.
Постулаты Бора
Первый постулат: Атом может длительное время находится только в определенных, так называемых стационарных состояниях, которые характеризуются дискретными значениями энергии водородоподобного атома в стационарном состоянии и приведите схему энергетических уровней водородоподобного атома.
Постулаты Бора
Первый постулат: Атом может длительное время находится только в определенных, так называемых стационарных состояниях, которые характеризуются дискретными значениями энергии 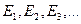 В стационарных состояниях атом не излучает.
Правило квантования орбит: Из всевозможных круговых орбит электрона в атоме стационарным состояниям соответствуют лишь те орбиты, при движении по которым момент импульса электрона равен целому числу постоянных Планка: В стационарных состояниях атом не излучает.
Правило квантования орбит: Из всевозможных круговых орбит электрона в атоме стационарным состояниям соответствуют лишь те орбиты, при движении по которым момент импульса электрона равен целому числу постоянных Планка:
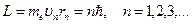 где
где 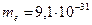 кг − масса покоя электрона; кг − масса покоя электрона; 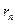 − радиус − радиус  -ой орбиты электрона; -ой орбиты электрона; 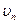 − скорость электрона на − скорость электрона на  -ой орбите; -ой орбите;  − главное квантовое число, которое определяет энергию атома в стационарном состоянии.
Второй постулат: при переходе атома из стационарного состояния с большей энергией − главное квантовое число, которое определяет энергию атома в стационарном состоянии.
Второй постулат: при переходе атома из стационарного состояния с большей энергией 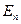 в стационарное состояние с меньшей энергией в стационарное состояние с меньшей энергией 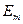 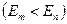 происходит излучение кванта света (фотона) с энергией происходит излучение кванта света (фотона) с энергией
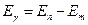 .
такое же соотношение выполняется и в случае поглощения, когда падающий фотон переводит атом с низшего энергетического уровня .
такое же соотношение выполняется и в случае поглощения, когда падающий фотон переводит атом с низшего энергетического уровня 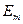 на более высокий на более высокий 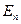 .
Энергия .
Энергия 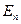 водородоподобного атома в стационарном состоянии: водородоподобного атома в стационарном состоянии:
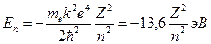 где
где 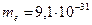 кг − масса покоя электрона; кг − масса покоя электрона; 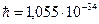 Дж∙ с − приведенная постоянная Планка; Дж∙ с − приведенная постоянная Планка; 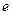 − элементарный электрический заряд; − элементарный электрический заряд; 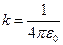 − постоянная в законе Кулона; − постоянная в законе Кулона; 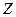 − зарядовое число водородоподобного атома; − зарядовое число водородоподобного атома;  − главное квантовое число, которое определяет энергию атома в стационарном состоянии.
Схема энергетических уровней водородоподобного атома: − главное квантовое число, которое определяет энергию атома в стационарном состоянии.
Схема энергетических уровней водородоподобного атома:
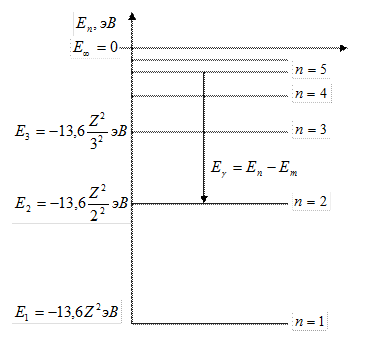
|
| 4. | Запишите выражение для энергии 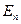 водородоподобного атома в стационарном состоянии и приведите схему энергетических уровней водородоподобного атома. Дайте определение энергии ионизации атома водородоподобного атома в стационарном состоянии и приведите схему энергетических уровней водородоподобного атома. Дайте определение энергии ионизации атома 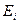 .
Энергия .
Энергия 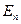 водородоподобного атома в стационарном состоянии: водородоподобного атома в стационарном состоянии:
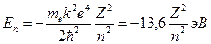 где
где 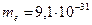 кг − масса покоя электрона; кг − масса покоя электрона; 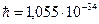 Дж∙ с − приведенная постоянная Планка; Дж∙ с − приведенная постоянная Планка; 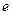 − элементарный электрический заряд; − элементарный электрический заряд; 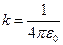 − постоянная в законе Кулона; − постоянная в законе Кулона; 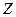 − зарядовое число водородоподобного атома; − зарядовое число водородоподобного атома;  − главное квантовое число, которое определяет энергию атома в стационарном состоянии.
Схема энергетических уровней водородоподобного атома: − главное квантовое число, которое определяет энергию атома в стационарном состоянии.
Схема энергетических уровней водородоподобного атома:
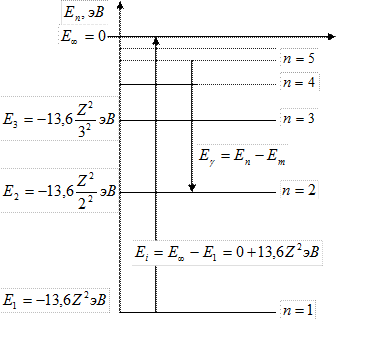 Энергией ионизации атома
Энергией ионизации атома 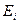 называется минимальная энергия, которую необходимо затратить, чтобы от атома, находящегося в основном состоянии, оторвать электрон: называется минимальная энергия, которую необходимо затратить, чтобы от атома, находящегося в основном состоянии, оторвать электрон:
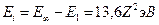 − энергия ионизации водородоподобного атома.
потенциал ионизации − энергия ионизации водородоподобного атома.
потенциал ионизации 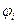 водородоподобного атома: водородоподобного атома:
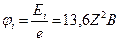 ;
первый потенциал возбуждения ;
первый потенциал возбуждения 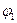 водородоподобного атома: водородоподобного атома:
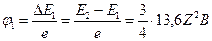 . .
|
| 5. | Запишите обобщенную формулу Бальмера. На схеме энергетических уровней водородоподобного атома покажите переходы, соответствующие различным спектральным сериям.
Обобщенная формула Бальмера для фотона в спектре излучения водородоподобного атома:
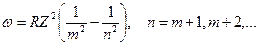 ; ;
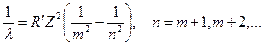 где
где 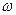 и и 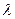 − соответственно циклическая частота и длина волны фотона в спектре излучения водородоподобного атома; − соответственно циклическая частота и длина волны фотона в спектре излучения водородоподобного атома; 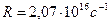 и и 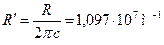 − постоянная Ридберга; − постоянная Ридберга; 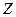 − зарядовое число водородоподобного атома; − зарядовое число водородоподобного атома;  и и 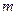 − номера энергетических уровней водородоподобного атома, между которыми происходит переход с излучением или поглощением фотона; − номера энергетических уровней водородоподобного атома, между которыми происходит переход с излучением или поглощением фотона; 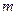 − определяет серию спектральной линии; − определяет серию спектральной линии;  − определяет линию в серии.
Схема энергетических уровней водородоподобного атома с переходами, соответствующими различным спектральным сериям: − определяет линию в серии.
Схема энергетических уровней водородоподобного атома с переходами, соответствующими различным спектральным сериям:
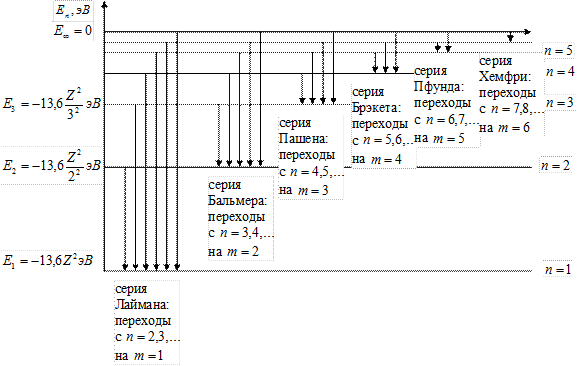
|
| 6. | Сформулируйте постулаты Бора. Сформулируйте правило квантования орбит Бора. Трудности теории Бора.
Постулаты Бора
Первый постулат: Атом может длительное время находится только в определенных, так называемых стационарных состояниях, которые характеризуются дискретными значениями энергии 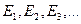 В стационарных состояниях атом не излучает.
Правило квантования орбит: Из всевозможных круговых орбит электрона в атоме стационарным состояниям соответствуют лишь те орбиты, при движении по которым момент импульса электрона равен целому числу постоянных Планка: В стационарных состояниях атом не излучает.
Правило квантования орбит: Из всевозможных круговых орбит электрона в атоме стационарным состояниям соответствуют лишь те орбиты, при движении по которым момент импульса электрона равен целому числу постоянных Планка:
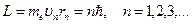 где
где 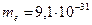 кг − масса покоя электрона; кг − масса покоя электрона; 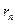 − радиус − радиус  -ой орбиты электрона; -ой орбиты электрона; 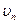 − скорость электрона на − скорость электрона на  -ой орбите; -ой орбите;  − главное квантовое число, которое определяет энергию атома в стационарном состоянии.
Второй постулат: при переходе атома из стационарного состояния с большей энергией − главное квантовое число, которое определяет энергию атома в стационарном состоянии.
Второй постулат: при переходе атома из стационарного состояния с большей энергией 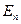 в стационарное состояние с меньшей энергией в стационарное состояние с меньшей энергией 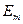 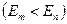 происходит излучение кванта света (фотона) с энергией происходит излучение кванта света (фотона) с энергией
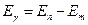 .
такое же соотношение выполняется и в случае поглощения, когда падающий фотон переводит атом с низшего энергетического уровня .
такое же соотношение выполняется и в случае поглощения, когда падающий фотон переводит атом с низшего энергетического уровня 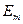 на более высокий на более высокий 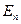 .
Трудности теории Бора:
1) теория Бора является непоследовательной квантовой теорией: полуклассической, полуквантовой;
2) описывает частоту, но не интенсивность и поляризацию спектральных линий водородоподобного атома;
3) не объясняет тонкую структуру спектральных линий атома водорода;
4) не работает для многоэлектронных атомов (начиная с атома гелия). .
Трудности теории Бора:
1) теория Бора является непоследовательной квантовой теорией: полуклассической, полуквантовой;
2) описывает частоту, но не интенсивность и поляризацию спектральных линий водородоподобного атома;
3) не объясняет тонкую структуру спектральных линий атома водорода;
4) не работает для многоэлектронных атомов (начиная с атома гелия).
|
| 7. | Гипотеза де Бройля. Длина волны де Бройля (формулы с пояснениями).
Гипотеза де Бройля – гипотеза об универсальности корпускулярно-волнового дуализма:
Не только фотоны, но и электроны, и любые другие частицы вещества наряду с корпускулярными обладают также волновыми свойствами.
Согласно гипотезе де Бройля, движение какой-либо микрочастицы связано с волновым процессом, длина волны которого равна
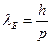 − длина волны де Бройля микрочастицы;
для нерелятивистской частицы − длина волны де Бройля микрочастицы;
для нерелятивистской частицы 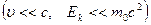 : :
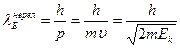 ;
для релятивистской частицы ;
для релятивистской частицы 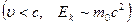 : :
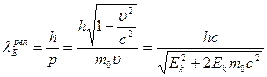 ;
где ;
где 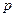 - импульс микрочастицы; - импульс микрочастицы; 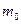 - масса покоя микрочастицы; - масса покоя микрочастицы; 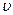 - скорость микрочастицы; - скорость микрочастицы; 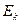 - кинетическая энергия микрочастицы; - кинетическая энергия микрочастицы; 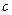 - скорость света в вакууме; - скорость света в вакууме; 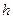 - постоянная Планка. - постоянная Планка.
|
| 8. | Статистическая (вероятностная) интерпретация волн де Бройля, предложенная М. Борном (формулировка). Статистическая интерпретация волновой функции?
Статистическая (вероятностная) интерпретация волн де Бройля, предложенная М. Борном:
Интенсивность волны де Бройля в какой либо точке пространства пропорциональна вероятности обнаружить частицу в этой точке.
Состояние микрочастицы в квантовой механике задается волновой функцией − пси-функцией 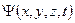 , зависящей от координат микрочастицы и времени.
Статистическая интерпретация волновой функции:
Вероятность обнаружить микрочастицу , зависящей от координат микрочастицы и времени.
Статистическая интерпретация волновой функции:
Вероятность обнаружить микрочастицу 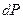 вблизи точки с координатами вблизи точки с координатами 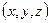 в элементарно малом объеме пространства в элементарно малом объеме пространства 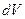 в момент времени в момент времени 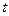 прямо пропорциональна квадрату модуля волновой функции частицы: прямо пропорциональна квадрату модуля волновой функции частицы:
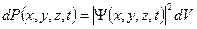 или или 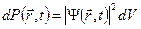 . .
|
| 9. | Соотношения неопределенностей Гейзенберга для координаты и проекции импульса. Соотношение неопределенностей для энергии и времени (формулировки, формулы с пояснениями).
Соотношения неопределенностей Гейзенберга для координаты и проекции импульса:
Невозможны такие состояния микрочастиц, в которых они имели бы одновременно точные значения координаты 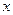 и проекции импульса и проекции импульса 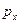 . Неопределенности этих величин удовлетворяют условию . Неопределенности этих величин удовлетворяют условию
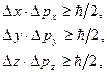 где
где 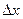 - неопределенность в определении координаты - неопределенность в определении координаты 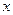 частицы; частицы; 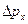 - неопределенность в определении проекции импульса частицы; - неопределенность в определении проекции импульса частицы; 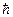 - приведенная постоянная Планка.
Соотношение неопределенностей Гейзенберга для энергии и времени:
Чем короче время существования какого-либо состояния микросистемы (или микрочастицы) или время, отведенное для его наблюдения, тем с меньшей определенностью можно говорить об энергии этого состояния. Произведение неопределенностей для энергии и времени не может быть по порядку величины меньше постоянной Планка - приведенная постоянная Планка.
Соотношение неопределенностей Гейзенберга для энергии и времени:
Чем короче время существования какого-либо состояния микросистемы (или микрочастицы) или время, отведенное для его наблюдения, тем с меньшей определенностью можно говорить об энергии этого состояния. Произведение неопределенностей для энергии и времени не может быть по порядку величины меньше постоянной Планка 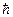 : :
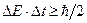 где
где 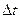 - время пребывания микрообъекта в состоянии с энергией - время пребывания микрообъекта в состоянии с энергией 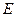 , а , а 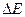 - неопределенность в энергии этого состояния; - неопределенность в энергии этого состояния; 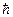 - приведенная постоянная Планка. - приведенная постоянная Планка.
|
| 10. | Состояние частицы в квантовой механике. Волновая функция и ее статистический (вероятностный) смысл; условие нормировки волновой функции стандартные условия, которым должна удовлетворять волновая функция.
Постулат 1:
Состояние микрочастицы в квантовой механике задается волновой функцией − пси-функцией 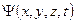 , зависящей от координат микрочастицы и времени.
Статистическая интерпретация волновой функции:
Вероятность обнаружить микрочастицу , зависящей от координат микрочастицы и времени.
Статистическая интерпретация волновой функции:
Вероятность обнаружить микрочастицу 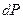 вблизи точки с координатами вблизи точки с координатами 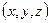 в элементарно малом объеме пространства в элементарно малом объеме пространства 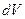 в момент времени в момент времени 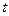 прямо пропорциональна квадрату модуля волновой функции частицы: прямо пропорциональна квадрату модуля волновой функции частицы:
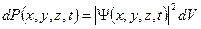 или или 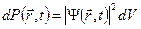 .
Вероятность обнаружить микрочастицу .
Вероятность обнаружить микрочастицу  в конечном объеме пространства в конечном объеме пространства  в момент времени в момент времени 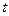 : :
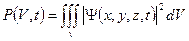 .
Условие нормировки волновой функции .
Условие нормировки волновой функции 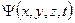 : :
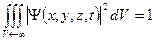 ;
вероятность обнаружить частицу в любой момент времени ;
вероятность обнаружить частицу в любой момент времени 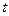 в какой-то точке пространства (вероятность достоверного события) равна 1.
Стандартные условия, которым должна удовлетворять волновая функция:
1. ВФ в какой-то точке пространства (вероятность достоверного события) равна 1.
Стандартные условия, которым должна удовлетворять волновая функция:
1. ВФ 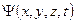 должна быть непрерывной, конечной, однозначной;
2. производные ВФ должна быть непрерывной, конечной, однозначной;
2. производные ВФ 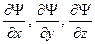 должны быть непрерывны;
3. должны быть непрерывны;
3. 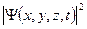 должна быть интегрируема: должна быть интегрируема: 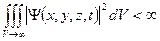 .
Принцип суперпозиции состояний:
Если квантовая система может находиться в различных состояниях, описываемых волновыми функциями .
Принцип суперпозиции состояний:
Если квантовая система может находиться в различных состояниях, описываемых волновыми функциями 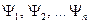 , то она может находиться в состоянии, описываемом волновой функцией, которая является линейной комбинацией этих функций: , то она может находиться в состоянии, описываемом волновой функцией, которая является линейной комбинацией этих функций:
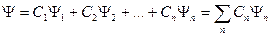 ,
где ,
где 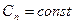 . .
|
| 11. | Принцип суперпозиции (формулировка постулата). Собственные значения и собственные функции линейных эрмитовых операторов (формулировки теорем).
Принцип суперпозиции состояний:
Если квантовая система может находиться в различных состояниях, описываемых волновыми функциями 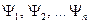 , то она может находиться в состоянии, описываемом волновой функцией, которая является линейной комбинацией этих функций: , то она может находиться в состоянии, описываемом волновой функцией, которая является линейной комбинацией этих функций:
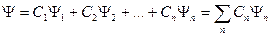 ,
где ,
где 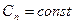 .
Постулат: Каждая динамическая переменная (физическая величина) в квантовой механике представляется линейным эрмитовым оператором. Взаимодействия между физическими величинами выражаются с помощью соотношений между операторами, изображающими эти величины.
Если выполняется равенство: .
Постулат: Каждая динамическая переменная (физическая величина) в квантовой механике представляется линейным эрмитовым оператором. Взаимодействия между физическими величинами выражаются с помощью соотношений между операторами, изображающими эти величины.
Если выполняется равенство: 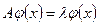 , где , где 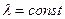 ,
то функция ,
то функция 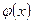 называется собственной функцией оператора называется собственной функцией оператора 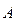 ; а постоянная ; а постоянная 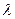 − собственным значением оператора − собственным значением оператора 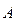 .
Теорема: Собственные значения эрмитовых операторов являются действительными числами.
Теорема: Множество собственных функций линейного эрмитового оператора образуют полную ортонормированную систему функций:
а) полнота системы: любая функция .
Теорема: Собственные значения эрмитовых операторов являются действительными числами.
Теорема: Множество собственных функций линейного эрмитового оператора образуют полную ортонормированную систему функций:
а) полнота системы: любая функция 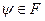 может быть представлена через СФ может быть представлена через СФ 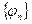 : : 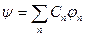 ;
б) ортогональность и нормированность системы: ;
б) ортогональность и нормированность системы:
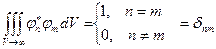 , где , где 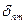 − символ Кронекера. − символ Кронекера.
|
| 12. | Общее или временное уравнение Шредингера (вид уравнения; условия, которым должно удовлетворять УШ).
Состояние микрочастицы в квантовой механике задается волновой функцией − пси-функцией 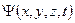 , зависящей от координат микрочастицы и времени. Вид функции получается из решения уравнения Шредингера: , зависящей от координат микрочастицы и времени. Вид функции получается из решения уравнения Шредингера:
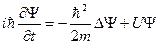 ,
где ,
где 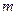 − масса частицы; − масса частицы; 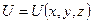 − потенциальная энергия частицы в поле; − потенциальная энергия частицы в поле; 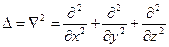 − оператор Лапласа, − оператор Лапласа, 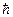 − приведенная постоянная Планка, − приведенная постоянная Планка, 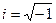 − мнимая единица.
Если прибегнуть к записи с помощью операторов, то уравнение можно представить в виде − мнимая единица.
Если прибегнуть к записи с помощью операторов, то уравнение можно представить в виде
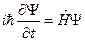 ,
где ,
где 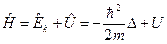 − оператор Гамильтона.
Уравнение Шредингера − основное уравнение нерелятивистской квантовой механики, оно не выводится, а постулируется. Общие требования, которым должно удовлетворять уравнение Шредингера:
1. УШ должно быть универсальным, то есть любое состояние частицы (в любых физических условиях) должно описываться ВФ − оператор Гамильтона.
Уравнение Шредингера − основное уравнение нерелятивистской квантовой механики, оно не выводится, а постулируется. Общие требования, которым должно удовлетворять уравнение Шредингера:
1. УШ должно быть универсальным, то есть любое состояние частицы (в любых физических условиях) должно описываться ВФ 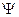 , являющейся решением УШ;
2. УШ − дифференциальное уравнение в частных производных по , являющейся решением УШ;
2. УШ − дифференциальное уравнение в частных производных по 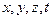 , поскольку оно описывает изменяющееся во времени и пространстве состояние частицы;
3. УШ должно быть совместно с условием , поскольку оно описывает изменяющееся во времени и пространстве состояние частицы;
3. УШ должно быть совместно с условием 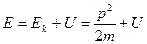 , так как в определенных ситуациях микрочастица ведет себя как классическая частица;
4. УШ должно быть линейным уравнением, что следует из принципа суперпозиции состояний. , так как в определенных ситуациях микрочастица ведет себя как классическая частица;
4. УШ должно быть линейным уравнением, что следует из принципа суперпозиции состояний.
|
| 13. | Стационарные состояния (определение). Уравнение Шредингера для стационарных состояний (вид уравнения).
Стационарные состояния − это состояния, в которых все наблюдаемые физические величины не изменяются с течение времени.
Это возможно, если силовое поле, в котором движется частица, стационарно, то есть 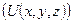 не зависит явно от времени, и имеет смысл потенциальной энергии частицы. В этом случае состояние микрочастицы задается волновой функцией − пси-функцией не зависит явно от времени, и имеет смысл потенциальной энергии частицы. В этом случае состояние микрочастицы задается волновой функцией − пси-функцией 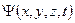 , которая может быть представлена в виде: , которая может быть представлена в виде:
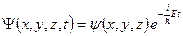 .
Уравнение Шредингера для стационарных состояний (или стационарное уравнением Шредингера) имеет вид: .
Уравнение Шредингера для стационарных состояний (или стационарное уравнением Шредингера) имеет вид:
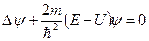 где
где 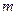 − масса частицы; − масса частицы; 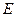 - энергия частицы; - энергия частицы; 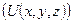 - потенциальная энергия частицы в поле; - потенциальная энергия частицы в поле; 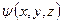 - координатная составляющая волновой функции; - координатная составляющая волновой функции; 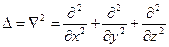 − оператор Лапласа; − оператор Лапласа; 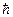 − приведенная постоянная Планка.
В операторном виде стационарное уравнение Шредингера: − приведенная постоянная Планка.
В операторном виде стационарное уравнение Шредингера:
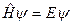 ,
где ,
где 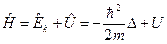 − оператор Гамильтона (или оператор полной энергии частицы), − оператор Гамильтона (или оператор полной энергии частицы), 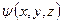 - собственная функция оператора - собственная функция оператора 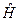 , , 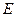 - собственное значение оператора - собственное значение оператора 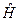 . .
|
| 14. | Собственные функции и собственные значения линейных эрмитовых операторов (определение). Измерение физических величин в квантовой механике (формулировка постулата).
Собственные функции и собственные значения линейных эрмитовых операторов
Если в результате действия оператора 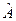 на функцию на функцию 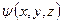 (которая при всех значениях ее аргументов является однозначной непрерывной и конечной) получается та же функция (которая при всех значениях ее аргументов является однозначной непрерывной и конечной) получается та же функция 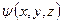 , умноженная на некоторое число , умноженная на некоторое число 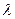 (в общем случае комплексное): (в общем случае комплексное):
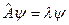 ,
то функцию ,
то функцию 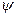 называют собственной функцией оператора называют собственной функцией оператора 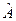 , а , а 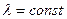 - собственным значением оператора - собственным значением оператора 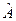 .
Измерение физических величин в квантовой механике
Постулат: При измерении физической величины могут получиться с той или иной вероятностью только собственные значения соответствующего ей оператора: .
Измерение физических величин в квантовой механике
Постулат: При измерении физической величины могут получиться с той или иной вероятностью только собственные значения соответствующего ей оператора:
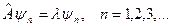 ,
собственные значения оператора ,
собственные значения оператора 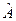 : : 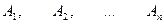 ;
собственные функции оператора ;
собственные функции оператора 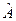 : : 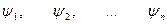 ;
вероятность при измерении физической
величины ;
вероятность при измерении физической
величины 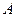 получить СЗ получить СЗ 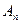 : : 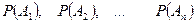 . .
|
| 15. | Среднее значение физической величины (формулировка постулата, формула с пояснениями). Понятие о совместных наблюдаемых, условие одновременной измеримости различных динамических переменных (формулировки).
Среднее значение физической величины
Постулат: Среднее значение физической величины 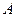 , изображаемой оператором , изображаемой оператором 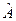 , в состоянии, которое описывается волновой функцией , в состоянии, которое описывается волновой функцией 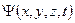 , находится по формуле: , находится по формуле:
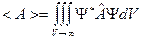 .
Совместные наблюдаемые
Две динамические переменные называются совместными, если результат измерения одной не влияет на результат измерения другой, то есть эти две динамические переменные можно измерить одновременно.
Теорема: Физические величины .
Совместные наблюдаемые
Две динамические переменные называются совместными, если результат измерения одной не влияет на результат измерения другой, то есть эти две динамические переменные можно измерить одновременно.
Теорема: Физические величины 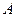 и и 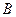 (изображаемые операторами (изображаемые операторами 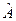 и и 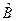 ) совместны ) совместны 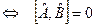 , т. е. операторы , т. е. операторы 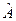 и и 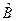 коммутируют. коммутируют.
|
| 16. | Операторы основных физических величин в квантовой механике: 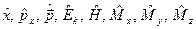 (формулы с пояснениями).
Основными операторами КМ являются операторы координаты и импульса:
оператор координаты (формулы с пояснениями).
Основными операторами КМ являются операторы координаты и импульса:
оператор координаты  оператор проекции импульса
оператор проекции импульса 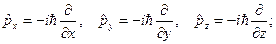 оператор импульса
оператор импульса 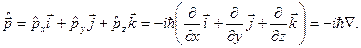 Операторы других физических величин находятся по правилу:
Формулы классической физики для связи между величинами в квантовой механике следует рассматривать, как формулы, связывающие операторы этих величин.
оператор кинетической энергии
Операторы других физических величин находятся по правилу:
Формулы классической физики для связи между величинами в квантовой механике следует рассматривать, как формулы, связывающие операторы этих величин.
оператор кинетической энергии 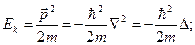 оператор полной энергии − оператор Гамильтона
оператор полной энергии − оператор Гамильтона 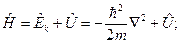 операторы проекций момента импульса
операторы проекций момента импульса 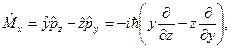
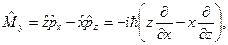
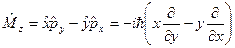 ;
оператор квадрата модуля момента импульса ;
оператор квадрата модуля момента импульса 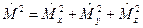 ;
оператор проекции момента импульса в сферических координатах ;
оператор проекции момента импульса в сферических координатах 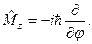
|
| 17. | Частица в бесконечно глубокой одномерной потенциальной яме (уравнение Шредингера, собственные значения и собственные функции).
Одномерное уравнение Шредингера для стационарных состояний имеет вид:
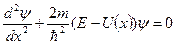 ,
Собственные функции частицы вбесконечно глубокой одномерной потенциальной яме: ,
Собственные функции частицы вбесконечно глубокой одномерной потенциальной яме:
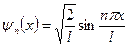 .
Собственные значения энергии частицы вбесконечно глубокой одномерной потенциальной яме: .
Собственные значения энергии частицы вбесконечно глубокой одномерной потенциальной яме:
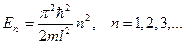 ,
где ,
где 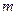 − масса частицы; − масса частицы; 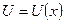 − потенциальная энергия частицы в поле; − потенциальная энергия частицы в поле; 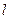 − ширина ямы, − ширина ямы, 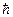 − приведенная постоянная Планка, − приведенная постоянная Планка,  − главное квантовое число (определяет значение энергии − главное квантовое число (определяет значение энергии 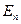 частицы в стационарном состоянии). частицы в стационарном состоянии).
|
| 18. | Квантовый гармонический осциллятор (определение, уравнение Шредингера для квантового ЛГО, формула для собственных значений энергии, правило отбора для квантового ЛГО).
Квантовым линейным гармоническим осциллятором (квантовым ЛГО) называют частицу, движущуюся в потенциальном поле вида 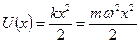 .
Уравнение Шредингера для квантового ЛГО: .
Уравнение Шредингера для квантового ЛГО:
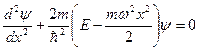 .
Собственные значения энергии .
Собственные значения энергии 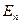 квантового ЛГО: квантового ЛГО:
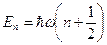 ; ; 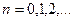 ,
где ,
где 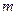 − масса частицы; − масса частицы; 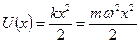 − потенциальная энергия частицы в поле; − потенциальная энергия частицы в поле; 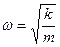 − циклическая частота фотона, испускаемого или поглощаемого квантовым ЛГО, − циклическая частота фотона, испускаемого или поглощаемого квантовым ЛГО, 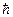 − приведенная постоянная Планка, − приведенная постоянная Планка,  − главное квантовое число (определяет значение энергии − главное квантовое число (определяет значение энергии 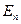 частицы в стационарном состоянии).
Правило отбора для квантового ЛГО: частицы в стационарном состоянии).
Правило отбора для квантового ЛГО: 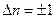 ,
для квантового ЛГО возможны лишь переходы между соседними энергетическими уровнями, следовательно, главное квантовое число ,
для квантового ЛГО возможны лишь переходы между соседними энергетическими уровнями, следовательно, главное квантовое число  может меняться только на единицу. может меняться только на единицу.
|
| 19. | Бесконечный прямоугольный потенциальный барьер (барьер ступенчатой формы); энергия налетающей частицы 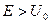 : уравнение Шредингера, коэффициенты отражения : уравнение Шредингера, коэффициенты отражения 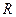 и прохождения (прозрачности) и прохождения (прозрачности) 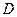 барьера (формулы с пояснениями). барьера (формулы с пояснениями).
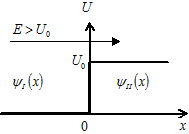 Одномерное уравнение Шредингера для стационарных состояний имеет вид: Одномерное уравнение Шредингера для стационарных состояний имеет вид:
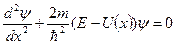 .
Коэффициент отражения барьера .
Коэффициент отражения барьера 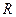 определяет вероятность отражения частицы от потенциального барьера: определяет вероятность отражения частицы от потенциального барьера:
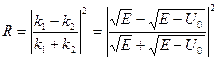 ;
Коэффициент прозрачности барьера ;
Коэффициент прозрачности барьера 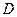 определяет вероятность прохождения частицей потенциального барьера: определяет вероятность прохождения частицей потенциального барьера:
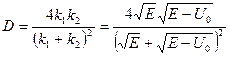 ; ;
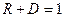 ;
где ;
где 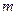 − масса частицы; − масса частицы; 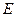 − энергия налетающей частицы; − энергия налетающей частицы; 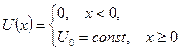 − потенциальная энергия частицы в поле; − потенциальная энергия частицы в поле; 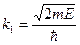 и и 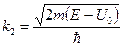 − коэффициенты в уравнениях Шредингера для областей − коэффициенты в уравнениях Шредингера для областей 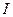 и и 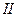 . .
|
| 20. | 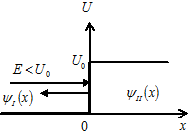 Бесконечный прямоугольный потенциальный барьер (барьер ступенчатой формы); энергия налетающей частицы Бесконечный прямоугольный потенциальный барьер (барьер ступенчатой формы); энергия налетающей частицы 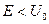 : уравнение Шредингера, коэффициенты отражения : уравнение Шредингера, коэффициенты отражения 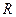 и прохождения (прозрачности) и прохождения (прозрачности) 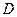 барьера, эффективная глубина проникновения частицы в область барьера (формулы с пояснениями).
Одномерное уравнение Шредингера для стационарных состояний имеет вид: барьера, эффективная глубина проникновения частицы в область барьера (формулы с пояснениями).
Одномерное уравнение Шредингера для стационарных состояний имеет вид:
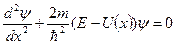 .
Коэффициент отражения барьера .
Коэффициент отражения барьера 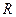 определяет вероятность отражения частицы от потенциального барьера: определяет вероятность отражения частицы от потенциального барьера:
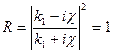 ;
Коэффициент прозрачности барьера ;
Коэффициент прозрачности барьера 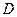 определяет вероятность прохождения частицей потенциального барьера: определяет вероятность прохождения частицей потенциального барьера:
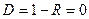 ;
где ;
где 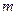 − масса частицы; − масса частицы; 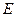 − энергия налетающей частицы; − энергия налетающей частицы; 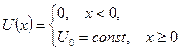 − потенциальная энергия частицы в поле; − потенциальная энергия частицы в поле; 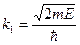 и и 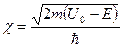 − коэффициенты в уравнениях Шредингера для областей − коэффициенты в уравнениях Шредингера для областей  и и 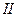 .
Эффективной глубиной проникновения .
Эффективной глубиной проникновения 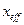 частицы в область барьера называется расстояние от границы барьера частицы в область барьера называется расстояние от границы барьера 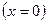 , до точки в области , до точки в области 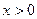 , в которой вероятность обнаружить частицу уменьшается в , в которой вероятность обнаружить частицу уменьшается в 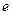 раз по сравнению с вероятностью обнаружить частицу на границе барьера: раз по сравнению с вероятностью обнаружить частицу на границе барьера:
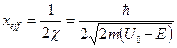 . .
|
| 21. | Прохождение частицы через потенциальные барьеры прямоугольной конечной ширины 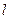 (уравнение Шредингера, формула с пояснениями для коэффициента прозрачности барьера (уравнение Шредингера, формула с пояснениями для коэффициента прозрачности барьера 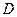 ). Туннельный эффект (определение). ). Туннельный эффект (определение).
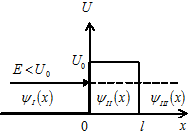 Одномерное уравнение Шредингера для стационарных состояний имеет вид Одномерное уравнение Шредингера для стационарных состояний имеет вид
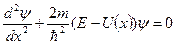 .
Коэффициент прозрачности .
Коэффициент прозрачности 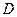 барьера конечной ширины барьера конечной ширины  − величина, определяющая вероятность прохождения частицей потенциального барьера: − величина, определяющая вероятность прохождения частицей потенциального барьера:
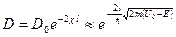 ,
где ,
где 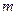 − масса частицы, − масса частицы, 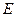 − энергия частицы, налетающей на потенциальный барьер, − энергия частицы, налетающей на потенциальный барьер, 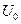 − высота барьера, − высота барьера, 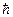 − приведенная постоянная Планка, − приведенная постоянная Планка, 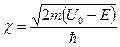 − коэффициент в уравнении Шредингера (10. 13), − коэффициент в уравнении Шредингера (10. 13), 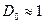 (по порядку величины) в предположении малой прозрачности барьера (по порядку величины) в предположении малой прозрачности барьера 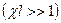 .
Туннельным эффектом называется явление прохождения микрочастицы через потенциальный барьер, в случае, когда энергия частицы .
Туннельным эффектом называется явление прохождения микрочастицы через потенциальный барьер, в случае, когда энергия частицы 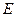 ниже высоты барьера ниже высоты барьера 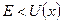 . .
|
| 22. | Какими квантовыми числами описывается состояние электрона в атоме водорода?
Состояние электрона в атоме водорода описывается следующими квантовыми числами:
 главное квантовое число (номер энергетического уровня); главное квантовое число (номер энергетического уровня);  определяет значение энергии определяет значение энергии 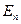 электрона в атоме водорода; электрона в атоме водорода;
 орбитальное квантовое число, орбитальное квантовое число, 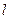 определяет модуль орбитального момента импульса определяет модуль орбитального момента импульса 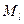 электрона в атоме водорода: электрона в атоме водорода:
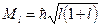 ; ; 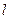 может принимать значения может принимать значения 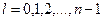 при заданном главном квантовом числе при заданном главном квантовом числе  ; ;
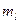 магнитное орбитальное квантовое число, определяет значение проекции орбитального момента импульса магнитное орбитальное квантовое число, определяет значение проекции орбитального момента импульса 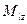 электрона на выделенную ось электрона на выделенную ось 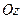 : :
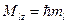 ; ; 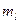 может принимать значения может принимать значения 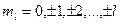 . .
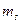 магнитное спиновое квантовое число, определяет значение проекции спинового момента импульса магнитное спиновое квантовое число, определяет значение проекции спинового момента импульса 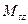 электрона на выделенную ось электрона на выделенную ось 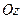 : :
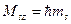 , , 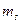 может принимать значения может принимать значения 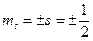 . .
|
| 23. | От каких квантовых чисел и как зависит энергия электрона в атоме водорода?
Энергия электрона в атоме водорода 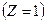 зависит только от главного квантового числа зависит только от главного квантового числа  : :
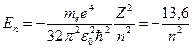 эВ. , т. е. эВ. , т. е. 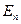 ~ ~ 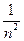 .
Энергия атома водорода не зависит орбитального .
Энергия атома водорода не зависит орбитального 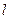 и магнитного чисел и магнитного чисел 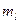 . Поэтому состояние с энергией . Поэтому состояние с энергией 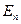 при при 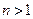 вырождено. Кратность вырождения равна числу различных возможных квантовых чисел вырождено. Кратность вырождения равна числу различных возможных квантовых чисел 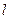 и и 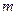 , и равна соответственно , и равна соответственно 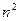 . .
|
| 24. | Сформулируйте правила квантования момента импульса и проекции момента импульса на выделенную ось.
Модуль орбитального момента импульса электрона в атоме водорода может принимать только дискретные значения:
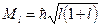 ,
где ,
где 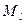 модуль орбитального момента импульса электрона; модуль орбитального момента импульса электрона; 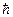 приведенная постоянная Планка; приведенная постоянная Планка; 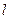 орбитальное квантовое число, которое может принимать значения орбитальное квантовое число, которое может принимать значения 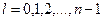 при заданном главном квантовом числе при заданном главном квантовом числе  .
Проекция момента импульса электрона на выделенную ось может принимать только дискретные значения: .
Проекция момента импульса электрона на выделенную ось может принимать только дискретные значения:
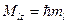 ,
где ,
где 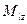 проекция момента импульса электрона на выделенную ось проекция момента импульса электрона на выделенную ось 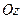 ; ; 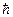 приведенная постоянная Планка; приведенная постоянная Планка; 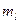 магнитное орбитальное квантовое число, которое может принимать значения магнитное орбитальное квантовое число, которое может принимать значения 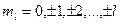 . .
|
| 25. | Спин электрона. Сформулируйте правила квантования спинового момента импульса электрона и проекции спинового момента импульса на выделенную ось.
В соответствии с общей теорией квантовых моментов, спин электрона определяется по формуле:
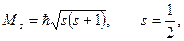 где
где 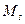 модуль собственного момента импульса (спин) электрона; модуль собственного момента импульса (спин) электрона; 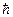 приведенная постоянная Планка; приведенная постоянная Планка; 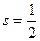 спиновое квантовое число электрона.
Проекция спинового момента импульса электрона на выделенную ось: спиновое квантовое число электрона.
Проекция спинового момента импульса электрона на выделенную ось:
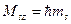 ,
где ,
где 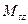 проекция спинового момента импульса электрона на выделенную ось проекция спинового момента импульса электрона на выделенную ось 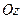 ; ; 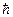 приведенная постоянная Планка; приведенная постоянная Планка; 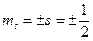 магнитное спиновое квантовое число. магнитное спиновое квантовое число.
|
| 26. | Сложение моментов для квантовых систем из многих частиц. Результирующий механический момент многоэлектронного атома. Типы связи. Правила отбора для случая нормальной связи.
В соответствии с общей теорией квантовых моментов, спин электрона определяется по формуле:
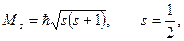 где
где 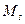 модуль собственного момента импульса (спин) электрона; модуль собственного момента импульса (спин) электрона; 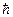 приведенная постоянная Планка; приведенная постоянная Планка; 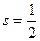 спиновое квантовое число электрона.
Орбитальный момент импульса электрона: спиновое квантовое число электрона.
Орбитальный момент импульса электрона:
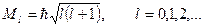 где
где 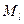 модуль орбитального момента импульса электрона; модуль орбитального момента импульса электрона; 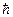 приведенная постоянная Планка; приведенная постоянная Планка; 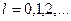 орбитальное квантовое число электрона.
а) Результирующий (суммарный) спиновый момент системы большого числа частиц (электронов) определяют как векторную сумму составляющих векторов: орбитальное квантовое число электрона.
а) Результирующий (суммарный) спиновый момент системы большого числа частиц (электронов) определяют как векторную сумму составляющих векторов:
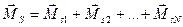 .
Результирующий спиновый момент атома: .
Результирующий спиновый момент атома:
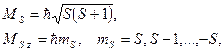 где
где 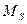 − модуль суммарного спинового момента атома; − модуль суммарного спинового момента атома; 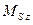 − проекция суммарного спинового момента атома на выбранное направление − проекция суммарного спинового момента атома на выбранное направление 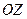 ; ; 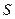 − квантовое число суммарного спинового момента атома; − квантовое число суммарного спинового момента атома; 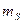 − магнитное квантовое число суммарного спинового момента атома.
б) Результирующий орбитальный момент системы большого числа частиц (электронов) определяют как векторную сумму составляющих векторов: − магнитное квантовое число суммарного спинового момента атома.
б) Результирующий орбитальный момент системы большого числа частиц (электронов) определяют как векторную сумму составляющих векторов:
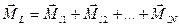 .
Результирующий орбитальный момент атома: .
Результирующий орбитальный момент атома:
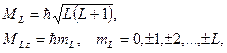 где
где 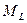 − модуль суммарного орбитального момента атома; − модуль суммарного орбитального момента атома; 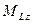 − проекция суммарного орбитального момента атома на выбранное направление − проекция суммарного орбитального момента атома на выбранное направление 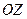 ; ; 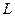 − квантовое число суммарного орбитального момента импульса атома; − квантовое число суммарного орбитального момента импульса атома; 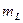 − магнитное квантовое число суммарного орбитального момента атома.
Типы связи:
1) нормальная связь (или − магнитное квантовое число суммарного орбитального момента атома.
Типы связи:
1) нормальная связь (или 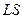 -связь) − наиболее типичная (характерная для легких и не слишком тяжелых атомов).
В случае нормальной связи взаимодействие орбитальных (и спиновых) моментов электронов атома преобладает над спин-орбитальным взаимодействием для отдельного электрона: -связь) − наиболее типичная (характерная для легких и не слишком тяжелых атомов).
В случае нормальной связи взаимодействие орбитальных (и спиновых) моментов электронов атома преобладает над спин-орбитальным взаимодействием для отдельного электрона:
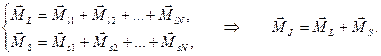 Полный (результирующий) момент импульса атома:
Полный (результирующий) момент импульса атома:
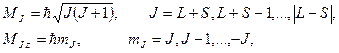 ,
где ,
где 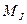 − модуль полного механического момента атома; − модуль полного механического момента атома; 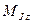 − проекция полного момента атома на выбранное направление − проекция полного момента атома на выбранное направление  ; ; 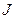 − квантовое число полного момента импульса атома; − квантовое число полного момента импульса атома; 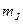 − магнитное квантовое число полного момента атома.
Правила отбора: − магнитное квантовое число полного момента атома.
Правила отбора: 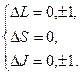 2)
2) 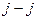 -связь − характерна для тяжелых атомов.
В случае -связь − характерна для тяжелых атомов.
В случае 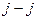 -связи преобладает спин-орбитальное взаимодействие, т. е. для каждого электрона моменты -связи преобладает спин-орбитальное взаимодействие, т. е. для каждого электрона моменты 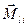 и и 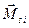 взаимодействуют между собой сильнее, чем взаимодействуют между собой сильнее, чем 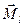 и и 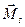 других электронов.
для каждого отдельного электрона находим полный момент импульса: других электронов.
для каждого отдельного электрона находим полный момент импульса: 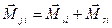 ,
полный момент импульса атома: ,
полный момент импульса атома: 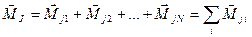 . .
|
| 27. | Принцип запрета Паули. Заполнение электронных оболочек атомов.
Принцип запрета Паули: в системе одинаковых фермионов любые два из них не могут одновременно находиться в одном и том же состоянии.
Состояние электронов в атоме однозначно определяется набором четырех квантовых чисел: главного 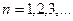 ,
орбитального ,
орбитального 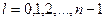 ,
магнитного орбитального ,
магнитного орбитального 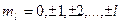 ,
магнитного спинового ,
магнитного спинового 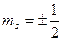 .
Распределение электронов в атоме подчиняется принципу Паули, который может быть дан в иной формулировке: в одном и том же атоме не может быть более одного электрона с одинаковым набором четырех квантовых чисел .
Распределение электронов в атоме подчиняется принципу Паули, который может быть дан в иной формулировке: в одном и том же атоме не может быть более одного электрона с одинаковым набором четырех квантовых чисел 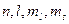 .
При фиксированном значении главного квантового числа .
При фиксированном значении главного квантового числа  возможны возможны 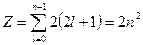 различных состояний.
Совокупность электронов в многоэлектронном атоме, имеющих одно и то же главное квантовое число различных состояний.
Совокупность электронов в многоэлектронном атоме, имеющих одно и то же главное квантовое число  , называют электронной оболочкой. В каждой из оболочек электроны распределяются по подоболочкам, соответствующим определенному значению орбитального квантового числа , называют электронной оболочкой. В каждой из оболочек электроны распределяются по подоболочкам, соответствующим определенному значению орбитального квантового числа 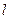 . Количество электронов в подоболочке определяется магнитным орбитальным . Количество электронов в подоболочке определяется магнитным орбитальным 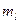 и магнитным спиновым и магнитным спиновым 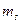 квантовыми числами: максимальное число электронов в подоболочке с данным квантовыми числами: максимальное число электронов в подоболочке с данным 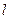 равно равно 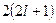 . Обозначения оболочек, а также распределение электронов по оболочкам и подоболочкам представлены в табл. 6. . Обозначения оболочек, а также распределение электронов по оболочкам и подоболочкам представлены в табл. 6. 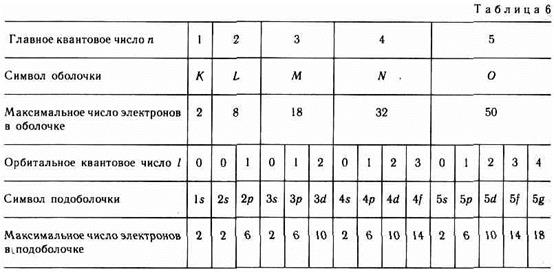
|
| 28. | Магнитный момент атома.
В классической физике электрон, обращающийся по замкнутой орбите вокруг ядра атома, обладает магнитным моментом 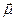 : :
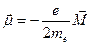 ,
где ,
где 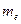 − масса электрона; − масса электрона; 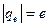 − модуль заряда электрона; − модуль заряда электрона; 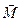 − вектор орбитального момента импульса электрона; − вектор орбитального момента импульса электрона; 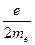 − гиромагнитное отношение.
В квантовой механике:
а) орбитальный магнитный момент атома: − гиромагнитное отношение.
В квантовой механике:
а) орбитальный магнитный момент атома:
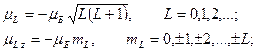 где
где 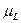 − орбитальный магнитный момент атома; − орбитальный магнитный момент атома; 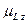 − проекция орбитального магнитного момента на выбранное направление − проекция орбитального магнитного момента на выбранное направление 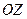 ; ; 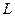 − квантовое число результирующего орбитального момента импульса атома; − квантовое число результирующего орбитального момента импульса атома; 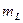 − магнитное квантовое число результирующего орбитального момента импульса атома; − магнитное квантовое число результирующего орбитального момента импульса атома; 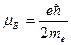 − магнетон Бора.
б) спиновый магнитный момент атома: − магнетон Бора.
б) спиновый магнитный момент атома:
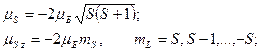 где
где 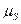 − собственный (спиновый) магнитный момент атома; − собственный (спиновый) магнитный момент атома; 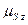 − проекция спинового магнитного момента на выбранное направление − проекция спинового магнитного момента на выбранное направление  ; ; 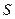 − квантовое число результирующего спинового момента импульса атома; − квантовое число результирующего спинового момента импульса атома; 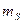 − магнитное квантовое число результирующего спинового момента импульса атома; − магнитное квантовое число результирующего спинового момента импульса атома; 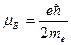 − магнетон Бора.
в) полный магнитный момент атома: − магнетон Бора.
в) полный магнитный момент атома:
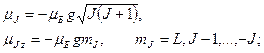 где
где 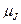 − полный магнитный момент атома; − полный магнитный момент атома; 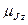 − проекция полного магнитного момента на выбранное направление − проекция полного магнитного момента на выбранное направление 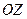 ; ; 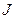 − квантовое число полного механического момента импульса атома; − квантовое число полного механического момента импульса атома; 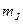 − магнитное квантовое число полного механического момента импульса атома; − магнитное квантовое число полного механического момента импульса атома; 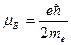 − магнетон Бора; − магнетон Бора; 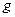 − множитель (фактор) Ланде: − множитель (фактор) Ланде:
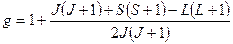 . .
|
| 29. | Эффект Зеемана. Простой и сложный эффект Зеемана.
Эффект Зеемана состоит в том, что во внешнем магнитном поле спектральные линии атомов расщепляются на несколько компонент.
Расщепление спектральных линий обусловлено расщеплением энергетических уровней атома. Это объясняется тем, что атом, обладающий магнитным моментом 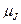 , приобретает в магнитном поле дополнительную энергию , приобретает в магнитном поле дополнительную энергию 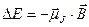 : :
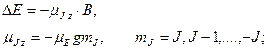 где
где 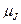 − полный магнитный момент атома; − полный магнитный момент атома; 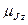 − проекция полного магнитного момента на выбранное направление − проекция полного магнитного момента на выбранное направление 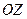 ; ; 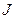 − квантовое число полного механического момента импульса атома; − квантовое число полного механического момента импульса атома; 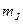 − магнитное квантовое число полного механического момента импульса атома; − магнитное квантовое число полного механического момента импульса атома; 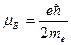 − магнетон Бора; − магнетон Бора; 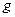 − множитель (фактор) Ланде. Таким образом, энергетический уровень расщепляется на − множитель (фактор) Ланде. Таким образом, энергетический уровень расщепляется на 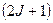 равноотстоящих подуровней, причем величина расщепления зависит от множителя Ланде равноотстоящих подуровней, причем величина расщепления зависит от множителя Ланде 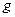 .
а) простой (нормальный) эффект Зеемана:
спектральные линии расщепляются на три компоненты;
присущ спектральным линиям не имеющим тонкой структуры (переходы между синглетными уровнями .
а) простой (нормальный) эффект Зеемана:
спектральные линии расщепляются на три компоненты;
присущ спектральным линиям не имеющим тонкой структуры (переходы между синглетными уровнями 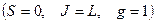 ).
а) сложный (аномальный) эффект Зеемана:
спектральные линии расщепляются на ).
а) сложный (аномальный) эффект Зеемана:
спектральные линии расщепляются на 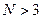 компонент (переходы между несинглетными уровнями, связано с множителем Ланде компонент (переходы между несинглетными уровнями, связано с множителем Ланде 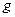 );
наблюдается в слабом магнитном поле, когда зеемановское расщепление мало по сравнению с компонентами тонкой структуры. );
наблюдается в слабом магнитном поле, когда зеемановское расщепление мало по сравнению с компонентами тонкой структуры.
|
| 30. | Тождественность частиц. Фермионы и бозоны. Принцип Паули. Квантовые статистики Ферми-Дирака и Бозе-Эйнштейна.
Принцип тождественности частиц в квантовой механике:
Все одинаковые частицы, образующие данную квантовую систему, являются совершенно тождественными.
В классической физике частицы одинаковы, но отличимы друг от друга: пи перестановке двух частиц возникает состояние, которое надо учитывать как новое, не зависящее от начального состояния.
В квантовой механике частицы тождественны, т. е. абсолютно неотличимы: состояние, возникающее при перестановке частиц, тождественно совпадает с начальным состоянием. Например, для двух частиц 1 и 2: 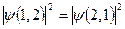 .
Таким образом, системы тождественных частиц можно описать только с помощью двух видов волновых функций − четных и нечетных:
волновая функция симметрична относительно состояний частиц: .
Таким образом, системы тождественных частиц можно описать только с помощью двух видов волновых функций − четных и нечетных:
волновая функция симметрична относительно состояний частиц: 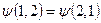 ;
волновая функция антисимметрична относительно состояний частиц: ;
волновая функция антисимметрична относительно состояний частиц: 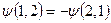 ;
Согласно квантовой теории все микрочастицы подразделяют на два класса, которым соответствуют две квантовые статистики:
частицы с полуцелым спином называются фермионами; они описываются антисимметричными ВФ и подчиняются статистике Ферми-Дирака;
частицы с целым спином называются бозонами; они описываются симметричными ВФ и подчиняются статистике Бозе-Эйнштейна.
Идеальный газ из бозонов — бозе-газ— описывается квантовой статистикой Бозе-Эйнштейна. В статистике Бозе-Эйнштейна среднее число частиц ;
Согласно квантовой теории все микрочастицы подразделяют на два класса, которым соответствуют две квантовые статистики:
частицы с полуцелым спином называются фермионами; они описываются антисимметричными ВФ и подчиняются статистике Ферми-Дирака;
частицы с целым спином называются бозонами; они описываются симметричными ВФ и подчиняются статистике Бозе-Эйнштейна.
Идеальный газ из бозонов — бозе-газ— описывается квантовой статистикой Бозе-Эйнштейна. В статистике Бозе-Эйнштейна среднее число частиц 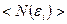 , находящихся в состоянии с энергией , находящихся в состоянии с энергией 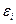 (или функция распределения частиц): (или функция распределения частиц):
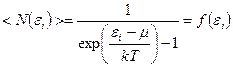 ;
где ;
где 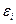 − энергия частицы в определенном состоянии, − энергия частицы в определенном состоянии, 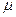 − химический потенциал системы, имеющий физический смысл работы по удалению одной частицы из системы при постоянных давлении и температуре, − химический потенциал системы, имеющий физический смысл работы по удалению одной частицы из системы при постоянных давлении и температуре, 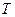 − абсолютная температура, − абсолютная температура, 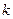 − постоянная Больцмана.
Идеальный газ из фермионов — ферми-газ — описывается квантовой статистикойФерми-Дирака. В статистике Ферми-Дирака среднее число частиц − постоянная Больцмана.
Идеальный газ из фермионов — ферми-газ — описывается квантовой статистикойФерми-Дирака. В статистике Ферми-Дирака среднее число частиц 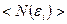 , находящихся в состоянии с энергией , находящихся в состоянии с энергией 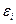 (или функция распределения частиц): (или функция распределения частиц):
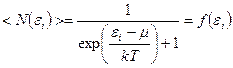 .
В В статистике Ферми-Дирака в каждом квантовом состоянии может находиться не более одной частицы (принцип Паули), а в статистике Бозе-Эйнштейна − любое количество частиц. .
В В статистике Ферми-Дирака в каждом квантовом состоянии может находиться не более одной частицы (принцип Паули), а в статистике Бозе-Эйнштейна − любое количество частиц.
|
| 31. | Распределение электронов по энергетическим уровням (распределение Ферми-Дирака). Уровень Ферми. Идеальный электронный газ.
Распределение электронов по различным квантовым состояниям подчиняется принципу Паули, согласно которому в одном состоянии не может быть двух одинаковых (с одинаковым набором четырех квантовых чисел) электронов. Следовательно, по квантовой теории, электроны в металле не могут располагаться на самом низшем энергетическом уровне даже при температуре 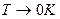 . Принцип Паули вынуждает электроны взбираться вверх «по энергетической лестнице».
Электроны проводимости в металле можно рассматривать как идеальный газ, подчиняющийся распределению Ферми — Дирака: . Принцип Паули вынуждает электроны взбираться вверх «по энергетической лестнице».
Электроны проводимости в металле можно рассматривать как идеальный газ, подчиняющийся распределению Ферми — Дирака:
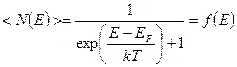 .
где .
где 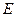 − электронов в определенном квантовом состоянии, − электронов в определенном квантовом состоянии, 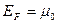 — максимальная кинетическая энергия электронов при — максимальная кинетическая энергия электронов при 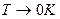 , которая называется энергией Ферми, и равна химическому потенциалу электронного газа при , которая называется энергией Ферми, и равна химическому потенциалу электронного газа при 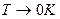 , , 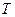 − абсолютная температура, − абсолютная температура, 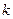 − постоянная Больцмана.
Для фермионов (электроны являются фермионами) среднее число частиц в квантовом состоянии и вероятность заселенности квантового состояния совпадают, так как квантовое состояние либо может быть не заселено, либо в нем будет находиться одна частица. При − постоянная Больцмана.
Для фермионов (электроны являются фермионами) среднее число частиц в квантовом состоянии и вероятность заселенности квантового состояния совпадают, так как квантовое состояние либо может быть не заселено, либо в нем будет находиться одна частица. При 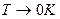 все нижние квантовые состояния, вплоть до состояния с энергией все нижние квантовые состояния, вплоть до состояния с энергией 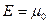 , заполнены электронами, а все состояния с энергией , заполнены электронами, а все состояния с энергией 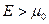 свободны. Следовательно, свободны. Следовательно, 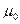 есть не что иное, как максимальная кинетическая энергия, которую могут иметь электроны проводимости в металле при есть не что иное, как максимальная кинетическая энергия, которую могут иметь электроны проводимости в металле при 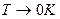 . Эта максимальная кинетическая энергия называется энергией Фермии обозначается . Эта максимальная кинетическая энергия называется энергией Фермии обозначается 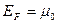 . .
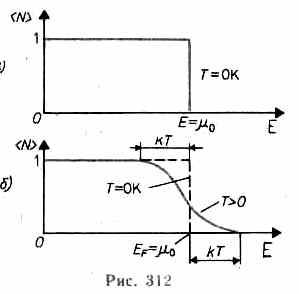 Наивысший энергетический уровень, занятый электронами, называется уровнем Ферми. Уровню Ферми соответствует энергия Ферми
Наивысший энергетический уровень, занятый электронами, называется уровнем Ферми. Уровню Ферми соответствует энергия Ферми 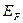 , которую имеют электроны на этом уровне.
При температурах , которую имеют электроны на этом уровне.
При температурах 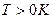 , функция распределения Ферми — Дирака плавно изменяется от 1 до 0 в узкой области (порядка kT) в окрестности , функция распределения Ферми — Дирака плавно изменяется от 1 до 0 в узкой области (порядка kT) в окрестности 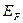 . Это объясняется тем, что при . Это объясняется тем, что при 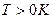 небольшое число электронов с энергией, близкой к небольшое число электронов с энергией, близкой к 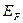 , возбуждается за счет теплового движения и их энергия становится больше , возбуждается за счет теплового движения и их энергия становится больше 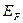 . Вблизи границы Ферми при . Вблизи границы Ферми при 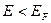 заполнение электронами меньше единицы, а при заполнение электронами меньше единицы, а при 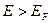 — больше нуля. В тепловом движении участвует лишь небольшое число электронов, например при комнатной температуре — больше нуля. В тепловом движении участвует лишь небольшое число электронов, например при комнатной температуре 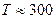 К— это 10-5 от общего числа электронов. К— это 10-5 от общего числа электронов.
|
| 32. | Состав и характеристики атомного ядра.
Атомное ядро состоит из частиц, которые называются нуклонами − протонов и нейтронов.
Протон 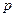 − положительно заряженная частица: − положительно заряженная частица: 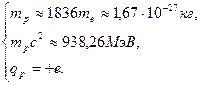 Нейтрон
Нейтрон  − электрически нейтральная частица: − электрически нейтральная частица: 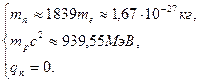 В свободном состоянии нейтрон нестабилен, он превращается в протон с испусканием электрона и антинейтрино:
В свободном состоянии нейтрон нестабилен, он превращается в протон с испусканием электрона и антинейтрино: 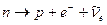 (среднее время жизни нейтрона (среднее время жизни нейтрона 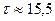 мин).
Протон и нейтрон обладают полуцелым спином (спиновое квантовое число для мин).
Протон и нейтрон обладают полуцелым спином (спиновое квантовое число для 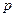 и и  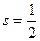 ), т. е. они являются фермионами.
Протон и нейтрон обладают отличными от нуля магнитными моментами: ), т. е. они являются фермионами.
Протон и нейтрон обладают отличными от нуля магнитными моментами: 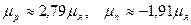 , где , где 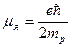 − ядерный магнетон.
Состав ядра задается двумя целыми числами: зарядовым числом − ядерный магнетон.
Состав ядра задается двумя целыми числами: зарядовым числом 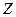 , которое совпадает с номером элемента в таблице Менделеева, и массовым числом , которое совпадает с номером элемента в таблице Менделеева, и массовым числом 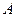 :
полное число нуклонов ( :
полное число нуклонов ( 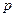 и и  ) в ядре: ) в ядре: 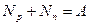 ;
число протонов в ядре: ;
число протонов в ядре: 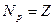 ;
число нейтронов в ядре: ;
число нейтронов в ядре: 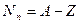 .
Радиус ядра оценивается по формуле: .
Радиус ядра оценивается по формуле: 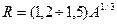 фм (1фм фм (1фм 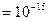 м − один ферми). Плотность ядерного вещества примерно одинакова во всех ядрах и составляет м − один ферми). Плотность ядерного вещества примерно одинакова во всех ядрах и составляет 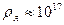 кг/м3.
Ядро атома химического элемента кг/м3.
Ядро атома химического элемента 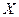 с зарядовым числом с зарядовым числом 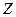 и массовым числом и массовым числом 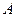 принято обозначать: принято обозначать: 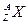 .
Наряду с термином ядро атома также используется термин нуклид. Ядра называются изотопами одного и того же химического элемента, если они имеют одинаковые порядковые номера (равное число протонов .
Наряду с термином ядро атома также используется термин нуклид. Ядра называются изотопами одного и того же химического элемента, если они имеют одинаковые порядковые номера (равное число протонов 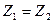 ) и различное число нейтронов (обычно это выражается неравенством массовых чисел ) и различное число нейтронов (обычно это выражается неравенством массовых чисел 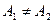 ). Ядра с различным числом протонов ). Ядра с различным числом протонов 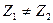 , но одинаковым числом нейтронов , но одинаковым числом нейтронов 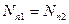 называются изотонами. Ядра, у которых равны массовые числа: называются изотонами. Ядра, у которых равны массовые числа: 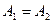 , называются изобарами.
Изотопы могут быть как стабильными, так и радиоактивными. Радиоактивные изотопы характеризуются типом распада ( , называются изобарами.
Изотопы могут быть как стабильными, так и радиоактивными. Радиоактивные изотопы характеризуются типом распада ( 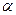 -распад и -распад и 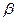 -распад) и постоянной распада -распад) и постоянной распада 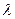 (или периодом полураспада (или периодом полураспада 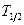 ). ).
|
| 33. | Масса и энергия связи ядра. Удельная энергия связи.
Одной из важнейших характеристик атомного ядра является его масса 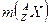 . В ядерной физике принято массу ядра (и атома) измерять в атомных единицах массы (а. е. м. ) и в энергетических единицах МэВ (это вытекает из известного соотношения Эйнштейна . В ядерной физике принято массу ядра (и атома) измерять в атомных единицах массы (а. е. м. ) и в энергетических единицах МэВ (это вытекает из известного соотношения Эйнштейна 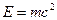 , согласно которому массе в кг соответствует энергия в Дж). За атомную единицу массы принята , согласно которому массе в кг соответствует энергия в Дж). За атомную единицу массы принята 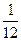 массы изотопа углерода массы изотопа углерода 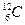 : :
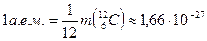 кг.
Измеренные с достаточной точностью массы ядер оказались меньше, чем суммарная масса составляющих их нуклонов. Дефектом массы атомного ядра называется разность массы ядра, выраженной в а. е. м., и массового числа: кг.
Измеренные с достаточной точностью массы ядер оказались меньше, чем суммарная масса составляющих их нуклонов. Дефектом массы атомного ядра называется разность массы ядра, выраженной в а. е. м., и массового числа: 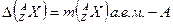 .
Между нуклонами действуют силы притяжения, удерживающие их в ядре − ядерные силы. Энергией связи ядра называется величина, равная минимальной работе, которую необходимо совершить, чтобы разделить ядро на отдельные протоны и нейтроны: .
Между нуклонами действуют силы притяжения, удерживающие их в ядре − ядерные силы. Энергией связи ядра называется величина, равная минимальной работе, которую необходимо совершить, чтобы разделить ядро на отдельные протоны и нейтроны:
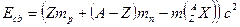 ,
где ,
где 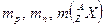 − массы протона, нейтрона и соответствующего атомного ядра.
Удельной энергией связи − массы протона, нейтрона и соответствующего атомного ядра.
Удельной энергией связи 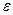 называется отношение энергии называется отношение энергии 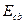 связи атомного ядра к массовому числу связи атомного ядра к массовому числу 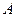 : :
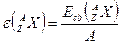 . .
|
| 34. | Спины и магнитные моменты ядер. Четность.
Спином ядра (полным механическим моментом) называется полный момент импульса ядра, который является результатом сложения спиновых и орбитальных моментов отдельных протонов и нейтронов входящих в состав ядра. Каждый нуклон, в свою очередь, обладает собственным моментом импульса (спином) и орбитальным моментом импульса (обусловленный движением нуклона относительно общего центра масс ядра).
В соответствии с общей теорией квантовых моментов, спин протона и нейтрона определяется по формуле:
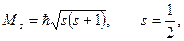 где
где 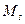 модуль собственного момента импульса (спин) нуклона в ядре; модуль собственного момента импульса (спин) нуклона в ядре; 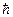 приведенная постоянная Планка; приведенная постоянная Планка; 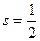 спиновое квантовое число протона или нейтрона.
Орбитальный момент импульса нуклона: спиновое квантовое число протона или нейтрона.
Орбитальный момент импульса нуклона:
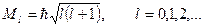 где
где 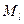 модуль орбитального момента импульса нуклона (протона или нейтрона) в ядре; модуль орбитального момента импульса нуклона (протона или нейтрона) в ядре; 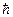 приведенная постоянная Планка; приведенная постоянная Планка; 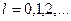 орбитальное квантовое число протона или нейтрона.
Результирующий (суммарный) спиновый момент системы большого числа частиц определяют как векторную сумму составляющих векторов: орбитальное квантовое число протона или нейтрона.
Результирующий (суммарный) спиновый момент системы большого числа частиц определяют как векторную сумму составляющих векторов:
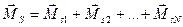 .
Модуль результирующего спинового момента ядра атома: .
Модуль результирующего спинового момента ядра атома:
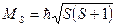 , где , где 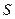 − спиновое квантовое число суммарного спинового момента ядра.
Результирующий орбитальный момент системы большого числа частиц определяют как векторную сумму составляющих векторов: − спиновое квантовое число суммарного спинового момента ядра.
Результирующий орбитальный момент системы большого числа частиц определяют как векторную сумму составляющих векторов:
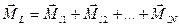 .
Модуль результирующего орбитального момента ядра атома: .
Модуль результирующего орбитального момента ядра атома:
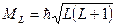 , где , где 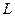 − орбитальное квантовое число суммарного орбитального момента импульса ядра.
Полный момент импульса ядра атома (спин ядра): − орбитальное квантовое число суммарного орбитального момента импульса ядра.
Полный момент импульса ядра атома (спин ядра):
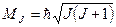 , где , где 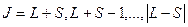 − квантовое число полного момента импульса ядра.
Поскольку спиновое квантовое число одного нуклона − квантовое число полного момента импульса ядра.
Поскольку спиновое квантовое число одного нуклона 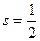 , число , число 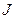 полуцелое при нечетном полуцелое при нечетном 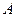 (нечетном числе нуклонов в ядре), и целое при четном (нечетном числе нуклонов в ядре), и целое при четном 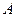 (четном числе нуклонов в ядре). Полные моменты импульсов большинства нуклонов в ядре располагаются «антипараллельно», взаимно компенсируя друг друга (этот эффект называется «спариванием нуклонов»). У всех четно-четных ядер (т. е. ядер с четными числами протонов и нейтронов) спин основного состояния равен нулю.
Наряду с механическим моментом ядро обладает и магнитным моментом. Магнитный момент ядра обусловлен спиновыми магнитными моментами нуклонов и магнитными моментами, связанными с орбитальным движением протонов. Результирующий магнитный момент ядра: (четном числе нуклонов в ядре). Полные моменты импульсов большинства нуклонов в ядре располагаются «антипараллельно», взаимно компенсируя друг друга (этот эффект называется «спариванием нуклонов»). У всех четно-четных ядер (т. е. ядер с четными числами протонов и нейтронов) спин основного состояния равен нулю.
Наряду с механическим моментом ядро обладает и магнитным моментом. Магнитный момент ядра обусловлен спиновыми магнитными моментами нуклонов и магнитными моментами, связанными с орбитальным движением протонов. Результирующий магнитный момент ядра:
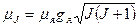 ,
где ,
где 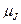 результирующий магнитный момент ядра; результирующий магнитный момент ядра; 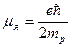 ядерный магнетон; ядерный магнетон; 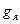 ядерное гиромагнитное отношение; ядерное гиромагнитное отношение; 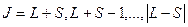 − квантовое число полного момента импульса ядра. − квантовое число полного момента импульса ядра.
|
| 35. | Ядерные силы.
Между нуклонами в ядре действуют ядерные силы притяжения, которые в сотни раз превышают электромагнитные силы отталкивания между протонами. Именно эти силы обеспечивают устойчивость ядер.
Особенности ядерных сил:
1. Ядерные силы являются короткодействующими с радиусом действия 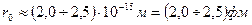 . При удалении нуклонов на расстояния, превышающие радиус действия, ядерное взаимодействие быстро исчезает, т. е. ядерные силы являются короткодействующими.
2. Ядерные силы обладают свойством насыщения. Это означает, что каждый нуклон внутри ядра взаимодействует с определенным числом ближайших протонов и нейтронов.
3. Ядерные силы обладают свойством зарядовой независимости: они не зависят от того, какие нуклоны вступают во взаимодействие (протон-протон, протон-нейтрон или нейтрон-нейтрон).
4. Ядерные силы не являются центральными силами.
5. Ядерные силы зависят от направления спинов. . При удалении нуклонов на расстояния, превышающие радиус действия, ядерное взаимодействие быстро исчезает, т. е. ядерные силы являются короткодействующими.
2. Ядерные силы обладают свойством насыщения. Это означает, что каждый нуклон внутри ядра взаимодействует с определенным числом ближайших протонов и нейтронов.
3. Ядерные силы обладают свойством зарядовой независимости: они не зависят от того, какие нуклоны вступают во взаимодействие (протон-протон, протон-нейтрон или нейтрон-нейтрон).
4. Ядерные силы не являются центральными силами.
5. Ядерные силы зависят от направления спинов.
|
| 36. | Классификация моделей ядра. Капельная модель ядра. Оболочечная модель ядра.
В настоящее время не создано универсальной модели ядер, которая позволила бы в рамках единого теоретического подхода рассчитывать различные ядерные характеристики. Каждая модель наиболее успешно объясняет отдельные свойства ядер.
Ядерные модели можно условно разделить на две группы − коллективные и одночастичные.
Капельная модель ядра (1936; Н. Бор и Я. И. Френкель) относится к коллективным моделям.
Эта модель основана на аналогии между поведением нуклонов в ядре и поведением молекул в капле жидкости. Так, в обоих случаях силы, действующие между составными частицами — молекулами в жидкости и нуклонами в ядре, — являются короткодействующими и им свойственно насыщение. Для капли жидкости при данных внешних условиях характерна постоянная плотность ее вещества. Ядра также характеризуются практически постоянной плотностью, не зависящей от числа нуклонов в ядре. Наконец, объем капли, так же как и объем ядра, пропорционален числу частиц. Существенное отличие ядра от капли жидкости в этой модели заключается в том, что она трактует ядро как каплю электрически заряженной несжимаемой жидкости (с плотностью, равной ядерной), подчиняющуюся законам квантовой механики. Капельная модель ядра позволила получить полуэмпирическую формулу для энергии связи нуклонов в ядре (зависимость энергии связи ядер 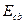 от зарядового от зарядового  и массового и массового  чисел), объяснила механизм ядерных реакций и особенно реакции деления тяжелых ядер.
Оболочечная модель ядра (М. Гепперт-Майер и X. Иенсен, 1949 г) относится к одночастичным моделям.
Оболочечная модель предполагает распределение нуклонов в ядре по дискретным энергетическим уровням (оболочкам), заполняемым нуклонами согласно принципу Паули, и связывает устойчивость ядер с заполнением этих уровней. Считается, что ядра о полностью заполненными оболочками являются наиболее устойчивыми. Такие особо устойчивые (магические) ядра действительно существуют.
Оболочечная модель ядра позволила объяснить спины и магнитные моменты ядер, различную устойчивость атомных ядер, а также периодичность изменений их свойств. Эта модель особенно хорошо применима для описания легких и средних ядер, а также для ядер, находящихся в основном (невозбужденном) состоянии. чисел), объяснила механизм ядерных реакций и особенно реакции деления тяжелых ядер.
Оболочечная модель ядра (М. Гепперт-Майер и X. Иенсен, 1949 г) относится к одночастичным моделям.
Оболочечная модель предполагает распределение нуклонов в ядре по дискретным энергетическим уровням (оболочкам), заполняемым нуклонами согласно принципу Паули, и связывает устойчивость ядер с заполнением этих уровней. Считается, что ядра о полностью заполненными оболочками являются наиболее устойчивыми. Такие особо устойчивые (магические) ядра действительно существуют.
Оболочечная модель ядра позволила объяснить спины и магнитные моменты ядер, различную устойчивость атомных ядер, а также периодичность изменений их свойств. Эта модель особенно хорошо применима для описания легких и средних ядер, а также для ядер, находящихся в основном (невозбужденном) состоянии.
|
| 37. | Ядерные реакции. Основные законы сохранения в ядерных реакциях. Понятие сечения реакции. Энергия ядерной реакции.
Ядерные реакции— это превращения атомных ядер при взаимодействии с элементарными частицами (в том числе и с g-квантами) или друг с другом.
Символическая запись ядерной реакции: 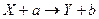 или ( или ( 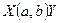 ,
где ,
где 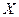 и и 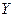 — исходное и конечное ядра, — исходное и конечное ядра, 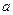 и и 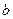 — налетающая на ядро и испускаемая (или испускаемые) в ядерной реакции частицы.
Во всех ядерных реакциях выполняются:
а) закон сохранения зарядового числа (закон сохранения электрического заряда: — налетающая на ядро и испускаемая (или испускаемые) в ядерной реакции частицы.
Во всех ядерных реакциях выполняются:
а) закон сохранения зарядового числа (закон сохранения электрического заряда:
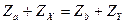 ;
б) закон сохранения суммарного числа нуклонов (закон сохранения барионного заряда): ;
б) закон сохранения суммарного числа нуклонов (закон сохранения барионного заряда):
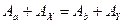 ;
в) закон сохранения импульса: ;
в) закон сохранения импульса: 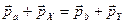 ;
г) закон сохранения энергии ;
г) закон сохранения энергии 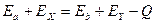 ,
где ,
где 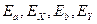 − кинетические энергии частиц до и после взаимодействия; − кинетические энергии частиц до и после взаимодействия;
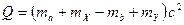 − энергия ядерной реакции.
Если − энергия ядерной реакции.
Если 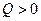 , то реакция называется экзоэнергетической, т. е. сопровождается выделением энергии (за счет уменьшения энергии покоя).
Если , то реакция называется экзоэнергетической, т. е. сопровождается выделением энергии (за счет уменьшения энергии покоя).
Если 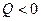 , то реакция называется эндоэнергетической, т. е. сопровождается поглощением энергии (за счет уменьшения кинетической энергии начальных частиц).
Эффективное сечение ядерной реакции: , то реакция называется эндоэнергетической, т. е. сопровождается поглощением энергии (за счет уменьшения кинетической энергии начальных частиц).
Эффективное сечение ядерной реакции:
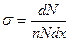 ,
где ,
где 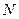 − число частиц, падающих за единицу времени на единицу площади поперечного сечения вещества, − число частиц, падающих за единицу времени на единицу площади поперечного сечения вещества, 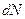 − число этих частиц, вступающих в ядерную реакцию в слое толщиной − число этих частиц, вступающих в ядерную реакцию в слое толщиной 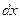 , ,  − концентрация ядер в веществе (количество ядер в в единице объема). Эффективное сечение − концентрация ядер в веществе (количество ядер в в единице объема). Эффективное сечение 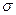 имеет размерность площади и характеризует вероятность того, что при падении пучка частиц на вещество произойдет ядерная реакция. имеет размерность площади и характеризует вероятность того, что при падении пучка частиц на вещество произойдет ядерная реакция.
|
| 38. | Классификация ядерных реакций. Реакции, идущие через составное ядро. Прямые ядерные реакции.
Ядерные реакции классифицируются по следующим признакам:
1) по роду участвующих в них частиц — реакции под действием нейтронов; реакции под действием заряженных частиц (например, протонов, дейтронов, a-частиц); реакции под действием g-квантов;
2) по энергии вызывающих их частиц — реакции при малых энергиях (порядка эВ), происходящие в основном с участием нейтронов; реакции при средних энергиях (до нескольких МэВ), происходящие с участием g-квантов и заряженных частиц (протоны, a-частицы); реакции при высоких энергиях (сотни и тысячи МэВ), приводящие к рождению отсутствующих в свободном состоянии элементарных частиц;
3) по роду участвующих в них ядер — реакции на легких ядрах (A< 50); реакции на средних ядрах (50< A< 100); реакции на тяжелых ядрах (А> 100);
4) по характеру происходящих ядерных превращений — реакции с испусканием нейтронов; реакции с испусканием заряженных частиц; реакции захвата (в случае этих реакций составное ядро не испускает никаких частиц, а переходит в основное состояние, излучая один или несколько 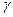 -квантов).
Механизм протекания ядерной реакции через составное ядро:
реакция протекает в два этапа -квантов).
Механизм протекания ядерной реакции через составное ядро:
реакция протекает в два этапа 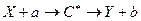 .
На первом этапе ядро мишени .
На первом этапе ядро мишени 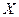 захватывает налетающую частицу захватывает налетающую частицу 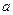 и образуется составное ядро (компаунд-ядро) и образуется составное ядро (компаунд-ядро) 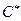 в возбужденном состоянии. Процесс захвата частицы и распределения избыточной энергии между нуклонами составного ядра продолжается короткое время (порядка ядерного времени) ~ в возбужденном состоянии. Процесс захвата частицы и распределения избыточной энергии между нуклонами составного ядра продолжается короткое время (порядка ядерного времени) ~ 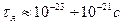 . После этого составное ядро распадается одним из возможных способов: либо избыточная энергия случайным образом концентрируется на одной частице (нуклоне или группе нуклонов) и она вылетает из ядра, либо ядро излучает . После этого составное ядро распадается одним из возможных способов: либо избыточная энергия случайным образом концентрируется на одной частице (нуклоне или группе нуклонов) и она вылетает из ядра, либо ядро излучает 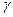 -квант, либо ядро делится.
Механизм протекания прямой ядерной реакции:
В прямых ядерных реакциях налетающая частица взаимодействует не с ядром в целом, а с одним нуклоном или небольшой группой нуклонов в ядре, передавая им энергию в течении малого (ядерного) времени -квант, либо ядро делится.
Механизм протекания прямой ядерной реакции:
В прямых ядерных реакциях налетающая частица взаимодействует не с ядром в целом, а с одним нуклоном или небольшой группой нуклонов в ядре, передавая им энергию в течении малого (ядерного) времени 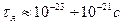 . К таким процессам относятся, например реакции срыва . К таким процессам относятся, например реакции срыва 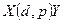 , , 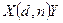 и реакции подхвата и реакции подхвата 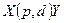 , , 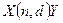 . .
|
| 39. | Сущность явления радиоактивности. Закон радиоактивного распада. Активность.
Радиоактивностью называется самопроизвольное (спонтанное) испускание ядром одной или нескольких частиц, сопровождающееся его превращением в другое ядро. Ядро, претерпевающее радиоактивный распад, называется материнским, а образовавшееся ядро − дочерним.
Основные виды радиоактивности −  -распад, -распад, 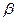 -распад и -распад и 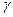 -излучение.
Теория радиоактивного распада строится на предположении о том, что радиоактивный распад является спонтанным процессом, подчиняющимся законам статистики. Поскольку отдельные радиоактивные ядра распадаются независимо друг от друга, можно считать, что число ядер, распадающихся в веществе за единицу времени -излучение.
Теория радиоактивного распада строится на предположении о том, что радиоактивный распад является спонтанным процессом, подчиняющимся законам статистики. Поскольку отдельные радиоактивные ядра распадаются независимо друг от друга, можно считать, что число ядер, распадающихся в веществе за единицу времени 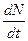 прямо пропорционально количеству ядер прямо пропорционально количеству ядер 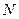 подверженных распаду в данный момент времени: подверженных распаду в данный момент времени:
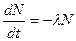 ,
где ,
где 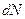 − число ядер, распадающихся в веществе за интервал времени − число ядер, распадающихся в веществе за интервал времени 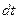 , , 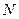 − количество не распавшихся ядер к данному моменту времени, − количество не распавшихся ядер к данному моменту времени, 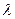 − постоянная радиоактивного распададанного нуклида (определяет вероятность распада ядра за единицу времени); знак минус указывает, что общее число радиоактивных ядер в процессе распада уменьшается.
Закон радиоактивного распада: количество не распавшихся ядер в веществе убывает со временем экспоненциально − постоянная радиоактивного распададанного нуклида (определяет вероятность распада ядра за единицу времени); знак минус указывает, что общее число радиоактивных ядер в процессе распада уменьшается.
Закон радиоактивного распада: количество не распавшихся ядер в веществе убывает со временем экспоненциально
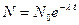 , ,
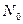 и и 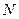 – число ядер данного сорта подверженных радиоактивному распаду в начальный момент времени – число ядер данного сорта подверженных радиоактивному распаду в начальный момент времени 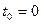 и в момент времени и в момент времени  .
Постоянная распада .
Постоянная распада 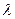 определяет вероятность распада ядра за единицу времени: определяет вероятность распада ядра за единицу времени:
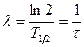 .
Период полураспада .
Период полураспада 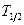 − время, за которое распадается половина ядер подверженных распаду в веществе: − время, за которое распадается половина ядер подверженных распаду в веществе: 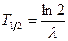 .
Среднее время жизни .
Среднее время жизни 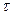 ядра: ядра: 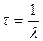 .
Активностью радиоактивного образца называют число ядер, распадающихся в образце в единицу времени: .
Активностью радиоактивного образца называют число ядер, распадающихся в образце в единицу времени:
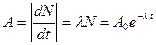 ,
где ,
где  − активность образца в начальный момент времени. − активность образца в начальный момент времени.
|
| 40. |  и и  -распады ядер атомов, -распады ядер атомов, 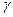 -излучение. -излучение.
 -распад ядра: -распад ядра: 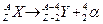 .
где .
где 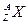 — материнское ядро, — материнское ядро, 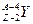 — дочернее ядро, — дочернее ядро, 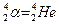 — — 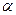 -частица (ядро гелия). -частица (ядро гелия). 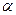 -распад наблюдается только у тяжелых ядер (в основном с -распад наблюдается только у тяжелых ядер (в основном с 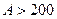 ).
При ).
При  -распаде из ядра выбрасывается -распаде из ядра выбрасывается  -частица, кинетическая энергия которой колеблется для разных ядер в пределах -частица, кинетическая энергия которой колеблется для разных ядер в пределах 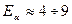 МэВ. МэВ.
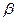 -распад ядра:
а) электронный -распад ядра:
а) электронный 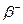 -распад -распад 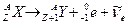 (при распаде из ядра выбрасываются электрон (при распаде из ядра выбрасываются электрон 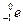 и электронное антинейтрино и электронное антинейтрино 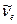 );
б) электронный );
б) электронный 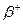 -распад -распад 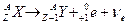 (при распаде из ядра выбрасываются позитрон (при распаде из ядра выбрасываются позитрон 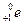 и электронное нейтрино и электронное нейтрино 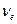 );
б) электронный захват );
б) электронный захват 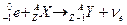 (при электронном захвате ядро поглощает электрон из электронной оболочки атома (обычно из (при электронном захвате ядро поглощает электрон из электронной оболочки атома (обычно из 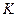 -оболочки), поэтому этот процесс также называют -оболочки), поэтому этот процесс также называют 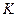 -захватом.
При -захватом.
При 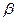 -распаде, испускаемые ядром электроны, имеют непрерывный спектр энергии, поскольку энергия, выделяющаяся при распаде ядра произвольно перераспределяется между тремя частицами: дочерним ядром -распаде, испускаемые ядром электроны, имеют непрерывный спектр энергии, поскольку энергия, выделяющаяся при распаде ядра произвольно перераспределяется между тремя частицами: дочерним ядром 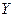 , электроном , электроном 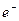 и электронным антинейтрино и электронным антинейтрино 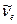 . .
 -излучение наблюдается при переходах ядра атома из возбужденного состояния в основное (без изменения зарядового -излучение наблюдается при переходах ядра атома из возбужденного состояния в основное (без изменения зарядового  и массового и массового  чисел), но с испусканием чисел), но с испусканием  -квантов: -квантов:
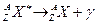 . .
|
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|