
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Тема: Основные понятия и законы термодинамики
Тема: Основные понятия и законы термодинамики
Вид учебного занятия: лекция
Цель учебного занятия: Ознакомится с основными понятиями и законом термодинамики
План лекции
1. Основные понятия термодинамики.
2. Первый закон термодинамики.
1. Основные понятия термодинамики
Термодинамика– наука, которая изучает общие законы взаимного превращения энергии из одной формы в другую.
Химическая термодинамика количественно определяет тепловые эффекты различных процессов, выясняет принципиальную возможность самопроизвольного течения химических реакций и условия, при которых химические реакции могут находиться в состоянии равновесия.
Объектом изучения в термодинамике является система – тело или группа тел, фактически или мысленно отделенных от окружающей среды. Системой можно назвать кристалл минерала, раствор любого вещества в какой-либо емкости, газ в баллоне и т. д.
Систему называюттермодинамической, если между телами, ее составляющими, может происходить обмен теплотой, веществом и если система описывается полностью термодинамическими параметрами.
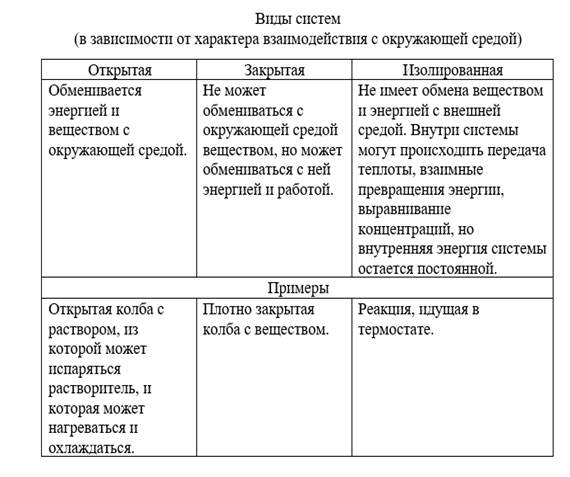
Система может быть гомогенной – состоит из одной фаза (воздух, кристалл, соли) и гетерогенной – состоит из нескольких фаз (лед-вода, вода-бензол).
Фаза – часть гетерогенной системы, отделенная поверхностями раздела и характеризующаяся одинаковыми физическими свойствами во всех своих точках.
Окружающая среда– это все, что находится в прямом или косвенном контакте с системой. Принято считать, что окружающая среда имеет такой большой размер, что отдача или приобретение ею теплоты не изменяет ее температуру.
Состояние термодинамической системы определяется массой, объемом, давлением, составом, теплоемкостью и др. характеристикам, которые называются параметрами состояния.
Если параметры состояния системы со временем не изменяются, то такое состояние считается равновесным. В равновесной термодинамической системе параметры состояния связаны между собой определенными математическими уравнениями – уравнениями состояния (например, уравнение Клапейрона-Менделеева для состояния идеального газа).
Параметры, которые поддаются непосредственному измерению, называют основными параметрами состояния. Параметры состояния, которые не поддаются непосредственному измерению (внутренняя энергия, энтальпия, энтропия, термодинамические потенциалы), рассматривают как функции основных параметров состояния.
Термодинамические процессы – изменения параметров состояния системы:
· изотермический (Т=const);
· изобарный (Р=const);
· изохорный (V=const).
Все тела в природе независимо от агрегатного состояния обладают определенным запасом внутренней энергии.
Энергия складывается из кинетической энергии молекул, включающей энергию поступательного и вращательного движения, энергии движения атомов в молекулы, электронов в атомах, внутриядерной энергии, энергии взаимодействия частиц друг с другом и т. п. Кинетическая и потенциальная энергия самого тела во внутреннюю энергию не входит. Внутренняя энергия является функцией состояния. Абсолютное значение внутренней энергии определить нельзя, можно только измерить изменение внутренней энергии (DU). Изменение внутренней энергии не зависит от пути перехода, а зависит только от начального и конечного состояния системы.
Теплота (Q) (или тепловой эффект процесса) – это количественная характеристика энергии, которую система в ходе данного процесса получает (отдает) от окружающей среды. Теплота является формой передачи энергии, реализуемой путем изменения кинетической энергии теплового (хаотического) движения частиц (атомов, молекул). Если процесс сопровождается переходом энергии от окружающей среды к системе, он называется эндотермическим, в противном случае – экзотермическим. Любая экзотермическая реакция в прямом направлении становится эндотермической, если она идет в обратном направлении, и наоборот.
Работа (А), совершаемая системой, обусловлена взаимодействием системы с внешней средой, в результате чего преодолеваются внешние силы, т. е. работа является одной из форм обмена энергией с окружающей средой и служит количественной характеристикой переданной энергии, причем передача энергии реализуется путем упорядоченного (организованного) движения молекул под действием определенной силы.
2. Первый закон (первое начало) термодинамики. Это всеобщий закон природы, закон сохранения и превращения энергии, соответствующий основному положению диалектического материализма о вечности и неуничтожимости движения. Впервые этот закон в 1842 г. сформулировал выдающийся немецкий физик Ю. Мейер.
Энергия не исчезает и не возникает из ничего, а только превращается из одного вида в другой в строго эквивалентных соотношениях.

В зависимости от вида системы первый закон термодинамики имеет различные формулировки.

Для закрытой системы этот закон термодинамики устанавливает связь между теплотой, полученной или выделенной системой в некотором процессе, изменением внутренней энергии системы и произведенной при этом работой.
В изобарно-изотермических условиях, в которых функционируют живые организмы:

Вопросы для самоконтроля
1. Что изучает термодинамика?
2. Какая система называется термодинамической?
3. Дайте характеристику термодинамических системам в зависимости от характера взаимодействия с окружающей средой
4. Перечислите основные параметры термодинамического процесса.
5. Сформулируйте первый закон термодинамики
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|