
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции
Окисление (отдача)
Восстановление (присоединение)
Типичные окислители: 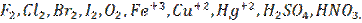
Типичные восстановители: K, Li, Na, Ca, Mg, Zn, Al, Fe, HCl,  .
.
Электрохимический процесс – процесс превращения химической и электрической энергии.
Электролиз – процесс превращения электрической энергии в химическую энергию.
Гальванический элемент (хим. энергия → электрическая энергия) – устройство, в котором хим. энергия ОВР превращается в электрическую.
Наиболее распространенным является гальванический элемент, состоящий из двух электродов, представляющих собой металлические пластины, погруженные в раствор электролита.
(-)…│ …р-ор│ │ р-ор│ … (+)
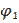
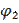
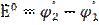
Уравнение Нернста
 , где
, где
n – число принятых или отданных электронов
F - число Фарадея (≈ 96500 Кл/моль)
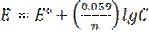
Пример. Определить ЭДС элемента, в котором протекает реакция
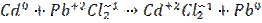
при 298 К, если концентрация раствора 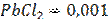 , а раствора
, а раствора 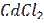 =0, 005.
=0, 005.
1)Составить гальваническую схему, найти ЭДС и константу равновесия
|


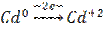 2
2
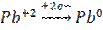 2
2
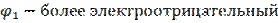

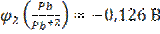
(-)Cd│ 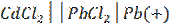
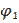
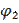
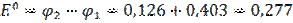 В
В
Е = 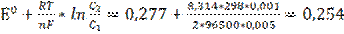 В
В
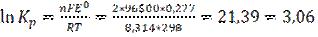
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|