
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Химический эквивалент. При определении числа эквивалентов вещества необходимо исходить из конкретной реакции, в которой участвует данное вещество. Например, из уравнения реакции
Химический эквивалент
Эквивалент (Э) – это реальная или условная частица вещества, способная соединить или заместить один моль ионов водорода в реакциях присоединения и замещения или ионообменных реакциях или принять (отдать) один моль электронов в окислительно-восстановительных реакциях. Эквивалент – безразмерная величина, состав которой выражают с помощью химических формул и символов.
Моль эквивалентов – количество вещества, содержащего 6, 02× 1023 эквивалентов. Массу одного моля эквивалентов называют молярной массой эквивалентов вещества (Мэ). Единица измерения – г/моль. Молярная масса эквивалентов рассчитывается по формуле
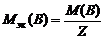 ,
,
где – Z эквивалентное число.
При определении числа эквивалентов вещества необходимо исходить из конкретной реакции, в которой участвует данное вещество. Например, из уравнения реакции
3NaOH + H3PO4 = Na3PO4 + 3H2O
следует, что одному иону водорода соответствует одна молекула NaOH, одна молекула Н2О, 1/3 молекулы Н3РО4 и 1/3 молекулы Na3РО4.
Следовательно, Мэ(NaOH) = М(NaOH) = 40 г/моль; Мэ(Н3РО4) = 1/3 М(Н3РО4) = 32, 67г/моль; Мэ(Na3PO4) = 1/3 M(Na3PO4) = 54, 67 г/моль.
Число, обозначающее, какая доля от реальной частицы эквивалентна одному иону водорода или одному электрону, называют фактором эквивалентности (fэ). В рассмотренном примере fэ(NaOH) = 1, fэ(Н3РО4) = fэ(Na3РО4) = 1/3.
Для окислительно-восстановительных реакций используют понятие «эквивалентное число» (Z), которое равно числу электронов, присоединенных одной молекулой окислителя или отданных одной молекуле восстановителя.
Для расчета молярной массы эквивалентов вещества используют следующие формулы:
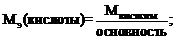
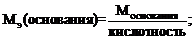
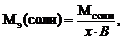
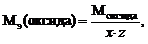
где х – число атомов металла или неметалла; z – основность кислоты или кислотность основания, соответствующие кислотному или основному оксиду. В – валентность металла.
Для вычисления объема моля эквивалентов (Vэ)газов необходимо знать число молей эквивалентов в одном моле газа. Так, Мэ(Н2) = 1 г/моль, что в два раза меньше массы моля, следовательно, объем моля эквивалентов водорода в два раза меньше объема моля (при н. у. ) и составит Vэ(Н2) = Vm: 2 = 11, 2 л. Аналогично, МэК(О2) = ¼ М(О2) = 32: 4 = 8 г/моль, отсюда объем одного моля эквивалентов кислорода в четыре раза меньше его молярного объема и составляет 5, 6 л.
Суть закона эквивалентов заключается в том, что вещества взаимодействуют друг с другом в эквивалентных соотношениях:
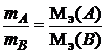 .
.
Для реагирующих веществ, находящихся в растворе, закон эквивалентов удобно представить в виде
Сэ(А) V(A) = Cэ(В) V(В),
где Сэ(А)и Сэ(В) – молярные концентрации эквивалентов растворов А и В, моль/л; V(A)и V(B) – объемы реагирующих веществ, л.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|