
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Тема урока: Химическое равновесие. Способы смещения химического равновесия
Тема урока: " Химическое равновесие. Способы смещения химического равновесия"
Химическое равновесие - это состояние обратимого химического процесса, при котором скорости прямой и обратной реакции равны между собой.
|
|
 |
υ пр = υ обр наступает химическое равновесие
С наступлением химического равновесия реакция не прекращается, и это состояние может тянуться достаточно долго, если поддерживать в системе постоянные условия: концентрации реагирующих веществ и продуктов реакции, температуру, давление (если среди реагирующих веществ или продуктов реакции присутствуют газы).
Химическое равновесие называют динамическим.
Во многих случаях хим. равновесие является фактором нежелательным, поэтому необходимо сместить его в сторону наиболее необходимого продукта реакции, например, в сторону аммиака.
Факторы, влияющие на смещение химического равновесия.
1. Температура.
СаСО3↔ СаО + СО2 - Q
Если реакция эндотермична, то при повышении температуры химическое равновесие смещается в сторону конечных продуктов реакции.
2SO2 + O2 ↔ 2SO3 + Q
Если реакция экзотермична, то при повышении температуры химическое равновесие смещается в сторону исходных веществ.
2. Давление.
N2 + 3H2 ↔ 2NH3
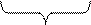 1 об 3об 2 об
1 об 3об 2 об
4 об
Если реакция идет с уменьшением объема, то при повышении давления химическое равновесие смещается в сторону меньшего объема.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|