
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Химические свойства
Алкины
Ненасыщенные углеводороды, содержащие тройную связь 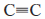 и образующие гомологический ряд общей формулы С nН 2n-2 называют алкинами.
и образующие гомологический ряд общей формулы С nН 2n-2 называют алкинами.
6. 1. НОМЕНКЛАТУРА
По номенклатуре ИЮПАК названия алкинов образуют заменой окончания - aн в названиях соответствующих алканов на - ин. Положение тройное связи указывают цифрой аналогично тому, как это делают в алкенах. При наличии в молекуле двойной и тройной связей двойная связь имеет предпочтение (меньший номер). Ниже показаны примеры названий по номенклатуре ИЮПАК (тривиальные названия даны в скобках).
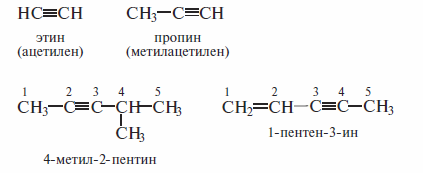

СПОСОБЫ ПОЛУЧЕНИЯ
Карбидный метол получения ацетилена
Ацетилен впервые был получен карбидным методом немецким химиком Ф. Вёлером в 1862 г. Его широкое применение, в том числе в качестве сырья в органическом синтезе, стало возможным в последней декаде XIX в., после внедрения карбидного метола в промышленное производство. И до настоящего времени этот метод является одним из промышленных источников ацетилена.
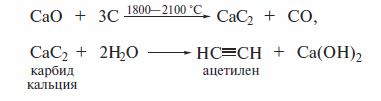
Пиролиз этилена и метана
Пиролиз и этилена, и метана при очень высокой температуре ведет к получению ацетилена. В этих условиях ацетилен термодинамически нестабилен, поэтому пиролиз проводят очень быстро (за сотые доли секунды).
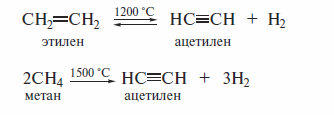
Термодинамическая нестабильность ацетилена следует из высокого положительного значения теплоты его образования из элементов
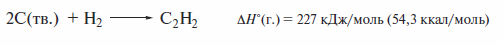
и создает определенные трудности при хранении ацетилена и работе с ним. Эти трудности преодолевают следующим образом. Так как ацетилен легко сжижается и в сжиженном виде обладает очень высокой растворимостью вацетоне, раствор ацетилена в ацетоне хранят в баллонах, заполненных пемзой, что предотвращает возможность взрыва.
Дегидрогалогенирование дигалогенидов и галогеналкенов
Дегидрогалогенирование каквицинальных, так и геминальныхдигалогени-дов применяют в лабораторной практике для получения алкинов:
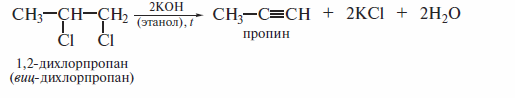
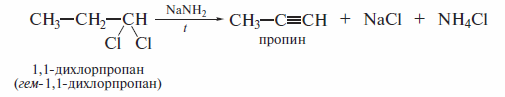
В присутствии спиртовой щелочи реакция дегидрогалогенирования идет в две стадии:
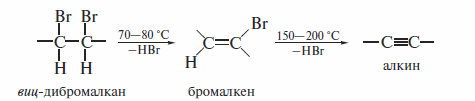
При умеренных температурах (70—80 °С) реакция останавливается на стадии получения винилгалогенида. Если реакция протекает в жестких условиях (150—200 º С), конечным продуктом является алкин. При этом вместо спиртового раствора КОН применяют раствор КОН в ди- или три-этиленгликоле.
Дегидрогалогенирование ариллгалогеналкенов идет значительно легче. В этом случае, как правило, достаточно нагревания при температуре кипения соответствующего спирта.
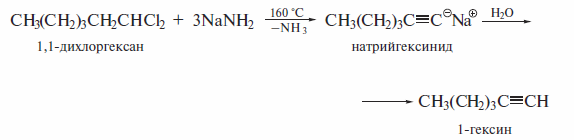
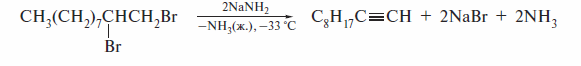
Физические свойства
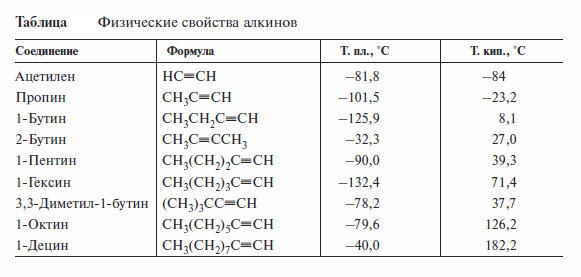
Физические свойства алкинов подобны свойствам соответствующих алкенов. Низшие алкины — газы, не обладающие ни цветом, ни запахом. Они имеют более высокие температуры кипения, чем алкены. Алкины с концевой тройной связью кипят ниже, чем изомеры с внутренней тройной связью (см. табл. ).
Пространственноеи электронное строение
Для атомов углерода в ацетилене характерна sp-гибридизация его орбиталей. При этом смешиванию подвергаются одна 2s- и одна 2p-орбитали атома углерода. В соответствии с этим все атомы в молекуле ацетилена лежат на одной прямой, углы между связями равны 180°, а атомы углерода находятся в sp- гибридизации. Ниже представлена схема формирования sp-гибридных орбиталей атома углерода и атомно-орбитальная модель ацетилена
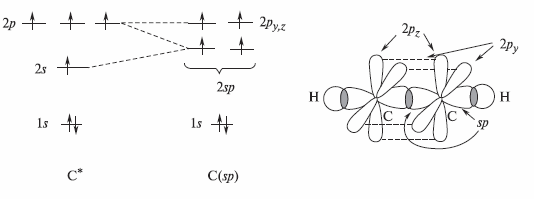
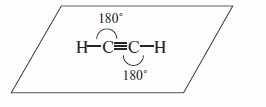
Молекула ацетилена линейна. Длина связи тройной СС связи равна 0, 120 нм. Длина С- Н-связи меньше, чем в этилене и этане и равна 0, 106 нм.
σ -Связь между атомами углерода в молекуле ацетилена возникает при перекрывании sр-орбиталей. Негибридизованные 2pz- и 2рy-орбитали атомов углерода образуют две π -связи, ориентированные во взаимно перпендикулярных плоскостях.
Согласно электронной структуре, уменьшение длин связей в молекуле ацетилена объясняется повышенным s-характером атомных орбиталей углерода в этой молекуле. Поскольку атомы углерода, образующие тройную связь, находятся в состоянии sp-гибридизации, s-характер их орбиталей достигает 50% (против 25% в молекулах алканов).
sp-Гибридизованный атом углерода значительно более электроотрицателен, чем углеродные атомы в состоянии sp3-гибридизации:

Химические свойства
Кислотность алкинов и нуклеофильные свойства ацетиленидов
Алкины, имеющие атомы водорода при sp-гибридизованном атоме углерода (концевая тройная связь), являются СН-кислотами, причем более сильными, чем алкены, алканы и аммиак, но более слабыми, чем, например, вода и спирты. Соответствующие значения рКа сравниваются ниже.

Причина более высокой кислотности алкинов по сравнению с алкенами и алканами заключается в большей устойчивости соответствующего карбаниона вследствие уже отмеченного выше роста электроотрицательности углеродного атома при изменении его гибридизации от sp3- к sp2- и sp-.
Несмотря на повышенную кислотность алкинов, не каждое сильное основание способно их полностью ионизировать. К такой ионизации не способен, в частности, гидроксид-ион:
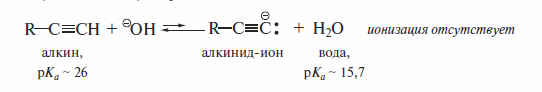
При действии очень сильных оснований алкины, имеющие концевую тройную связь, полностью ионизируются и образуют соли, которые называют ацетиленидами. Например, при пропускании над металлическим натрием, нагретым до 150 °С, ацетилен превращается в натрийацетиленид:
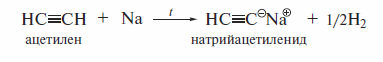
Ацетилениды натрия и калия получают и при низкой температуре действием соответствующих амидов:
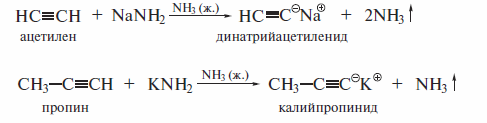
Кислотные свойства алкинов с концевой тройной связью обнаруживаются и при их взаимодействии с металлоорганическими соединениями, которые также являются очень сильными основаниями:
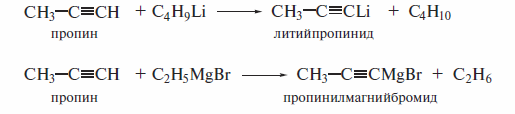
Получение алкинилмагнийгалогенида действием реактива Гриньяра на ацетилен с концевой тройной связью известно как реакция Иоцнча (1902 г. ). Взаимодействие алкинов с растворами аммиакатов серебра и меди является качественной реакцией на концевую тройную связь. При наличии такой связи образуется нерастворимый в воде алкинид, цвет которого определяется природой металла.
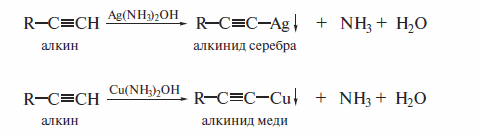
Пропинид серебра представляет собой осадок белого цвета, а пропинид меди — желтого цвета. При пропускании ацетилена в аммиачный раствор одновалентной меди выпадает аморфный красно-фиолетовый осадок аце-тиленида меди Cu2С2
Алкинид-ионы в составе металлических солей ацетилена и его гомологов являются сильными нуклеофилами. В реакциях с первичными галогенал килами они находят широкое применение в органическом синтезе, в частности для получения гомологов ацетилена. Соответствующие реакции рекомендуется проводить в среде диполярных апротонных растворителей(гексаметилфосфотриамид, диметилсульфоксид) или в жидком аммиаке, который применяется при получении ацетиленида.
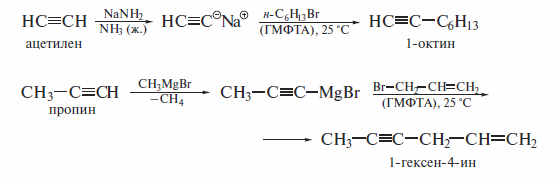
Однако, поскольку ацетиленид-ионы являются и очень сильными основаниями, показанные выше реакции гладко идут лишь с первичными галогеналканами. Вторичные и третичные галогеналканы подвергаются элиминированию.
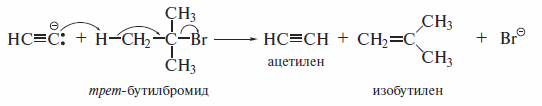
Электрофильное присоединение
Галогенирование
Электрофильное присоединение галогенов (AdЕ) по тройной связи идет как анти-присоединение и в общих чертах аналогично присоединению галогенов к алкенам. Например, бромирование алкинов, как и алкенов, можно проводить в уксусной кислоте: 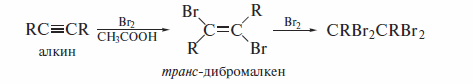
Присоединение галогена по двойной связи идет легче, чем по тройной связи. Различие в реакционной способности алкенов и алкинов достаточно для возможности избирательного присоединения галогенов к углеводородам, содержащим одновременно двойную и тройную связи: 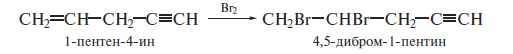
Гидрогалогенирование
Алкины реагируют с НСl и НВг подобно алкенам. Галогеноводороды присоединяются к ацетиленовым углеводородам в две стадии по правилу Марковникова: 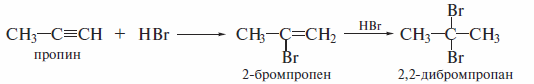
3, 3, 3-трифторпропин присоединяет бромистый водород против правила Марковникова:

В присутствии пероксидов наблюдается перекисный эффект Хараша. Реакция идет по радикальному механизму. Вследствие этого бромоводород присоединяется калкину против правила Марковникова:
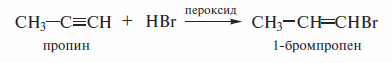
Гидратация. Реакция Кучерова
Алкины присоединяют воду в присутствии серной кислоты и солей рту-ти(П). Это превращение известно как реакция Кучерова(1881 г. ). Ацетилен при гидратации дает альдегид, а именно ацетальдегид.
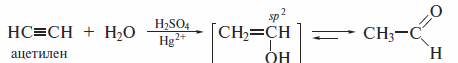
Нуклеофильное присоединение
В отличие от алкенов алкины могут вступать и в реакции нуклеофильного присоединения. Нуклеофильным присоединением (реакции типа AdN) называют реакции присоединения, в скоростьлимитирующей стадии которых атакующей частицей является нуклеофил. Примером нуклеофильного присоединения служит присоединение спиртов к алкинам в присутствии щелочей. Реакция протекает в жестких условиях:
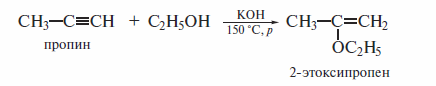
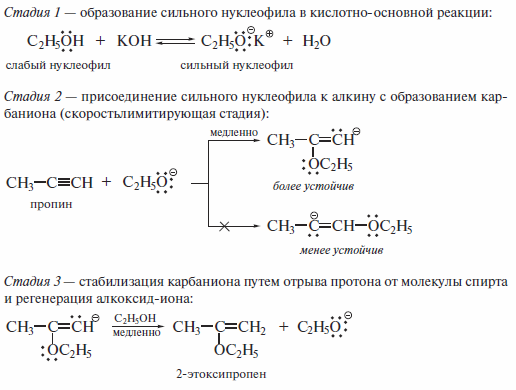
Механизм реакции приведен ниже.
Среди других реакции нуклеофильного присоединения следует назвать реакции алкинов с синильной кислотой и тиолят-ионами:
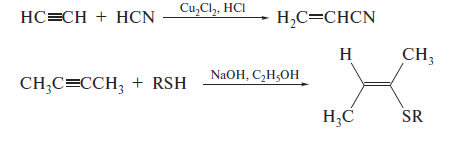
На основании рассмотрения реакций присоединения по тройной связи, видно, что как электрофильные, так и нуклеофильные реагенты присоединяются к ацетилену с образованием соединений общей формулы СН2=СН—X. Такие реакции носят название «реакции винилирования».
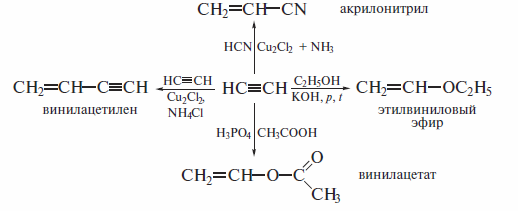
Стереоселективное восстановление
Син-присоединение
Вусловиях гетерогенного катализа алкины реагируют с водородом аналогично алкенам:
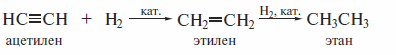
В качестве катализаторов, как и при гидрировании алкенов, применяют металлы: Pd, Pt, Ni. С этими катализаторами гидрирование алкена протекает значительно быстрее, чем гидрирование алкина. Чтобы замедлить вторую стадию и провести избирательное гидрирование алкина до алкена, применяют специальные дезактивированные {«отравленные») катализаторы.
Катализатор, состоящий из палладия, оксида или ацетата свинца(II) и карбоната кальция, носит название «катализатор Линдлара». Поскольку гидрирование на таком катализаторе является гетерогенным процессом, превращение алкина в алкен идет стереоселективно по механизму син-присоединения:
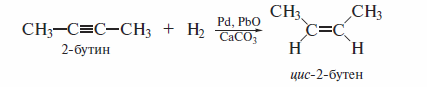
Из других специальных катализаторов можно отметить палладий, нанесенный на сульфат бария и «отравленный» хинолином, а также боргидрид никеля, который готовят реакцией соли никеля с NaBH4
Анти-присоединение
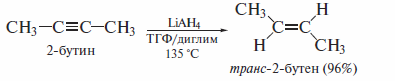
Гидрирование алкинов можно проводить и по схеме анти-присоединения. По такому механизму алкины восстанавливают натрием в жидком аммиаке.
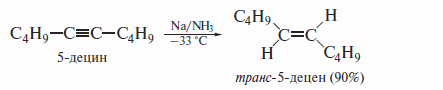
Также по схеме анти-присоединения алкины восстанавливают литийалюминийгидридом:
Окисление
В очень мягких условиях (вода, рН 7-8, О °С) алкины с неконцевой тройной связьюудается гладкоокислитьдо α -дикетоновдействием перманга-
ната калия:
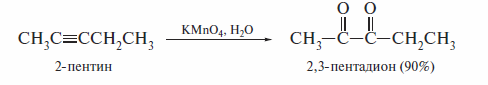
Окислительное растепление алкинов проводят теми же реагентами, что и в случае алкенов, но в более жестких условиях. При этом образуются карбо-новые кислоты:
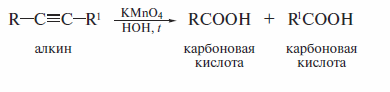
Аналогичный результат дает озонирование алкина с последующим окислительным расщеплением озонида:
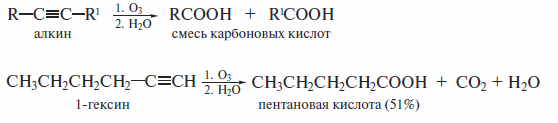
Своеобразным примером окисления алкинов является окислительное сочетание 1-алкинов, катализируемое солями меди. На первой стадии действием хлорида меди(1) в спиртовом растворе аммиака получают аце-тиленид меди, а затем окисляют его кислородом воздуха с образованием 1, 3-диина ( реакция Глазера, 1870 г. ):
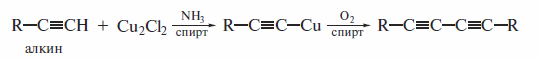
Ацетилениды меди можно окислять также хлоридом меди(1) или ферро-цианидом калия. Этим методом были получены многие полиины, которые затем были использованы в синтезах каротина и других природных соединений.
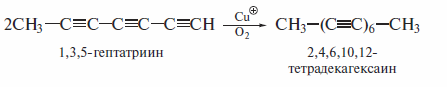 Олигомеризация и полимеризация
Олигомеризация и полимеризация
Окислительное сочетание ацетиленидов меди (а также ацетиленидов других металлов) следует отличать от реакций олигомеризации, которые алкины претерпевают в присутствии ионов Сu+ в кислой среде:
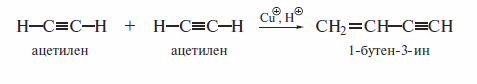
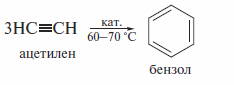
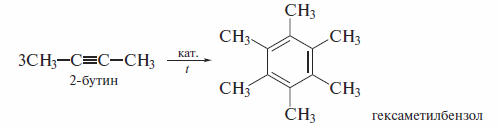
Особый интерес представляют реакции циклотримеризации ацетилена и его гомологов. Впервые циклотримеризацию ацетилена провел М. Бертло еще в 1868 г., однако он сообщил лишь о весьма низком выходе бензола. Более высокие результаты были достигнуты в реакции, проведенной в присутствии активированного угля. С выходом около 90% бензол образуется при использовании в качестве катализатора комплекса (СО)2Ni[Р(С6Н5)3]2. полученного из тетракарбонила никеля и трифенилфосфина {реакции Реппе, 1948 г. ).
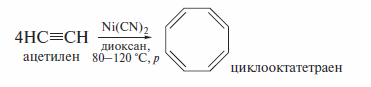
В присутствии Ni(CN)2 ацетилен может претерпевать и циклотетраме-ризацию, причем также с высоким выходом (ло 80—90%) продукта –циклооктатетраена:
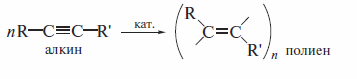
Наконец, алкины способны к полимеризации с образованием сопряженных полиенов:
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|