
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
18. Установите соответствие между реагирующими веществами и продуктами, которые преимущественно образуются при взаимодействии этих веществ
1. В каком из соединений: N2O5; NH3; HNO3; NO, химический элемент азот проявляет наименьшую степень окисления?
2. Укажите степень окисления азота в соединениях, которые образуются при взаимодействии азота с активными металлами.
3. Напишите общую формулу оксидов элементов V группы периодической системы Д. И. Менделеева.
4. Напишите общую формулу водородных соединений, которые образуются при взаимодействии химических элементов VA группы периодической системы с водородом.
5. Какая из предложенных молекул: Н2, N2, F2, О2 имеет наиболее прочную химическую связь в молекуле?
6. Запишите в ответе уравнение реакции разложения, в результате которой образуются и простые и сложные вещества:
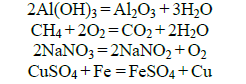
7. Определите вещество Х и запишите в ответе его название:
4NH3 + 5O2 = 4Х + 6H2O
8. Вычислите, сколько молекул содержится в 3, 4 г аммиака.
9. Составьте уравнение химической реакции термического разложения нитрата серебра. В ответе укажите коэффициент возле формулы твердого продукта реакции.
10. Определите объем водорода (н. у. ), который вступит в реакцию с азотом с образованием 10 л аммиака.
11. Определите, увеличится ли количество фторида азота (ІІІ) при повышении давления в системе:
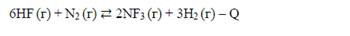
12. В результате реакции, термохимическое уравнение которой NН4NO2 = N2 + 2H2O + 316 кДж
выделилось 94, 8 кДж теплоты. Определите массу разложившейся соли.
13. Выберите области применения аммиака:
А) в медицине Б) производство маргарина
В) получение азота в промышленности Г) производство минеральных удобрений
Д) получение азотной кислоты Е) производство синтетического каучука
Ж) не находит широкого применения, применяется только для лабораторных целей
14. Выберите области применения азотной кислоты:
А) получение этаналя Б) производство лекарств
B) производство взрывчатых веществ Г) производство поваренной соли
Д) производство резины Е) доменный процесс производства чугуна
Ж) травление металлов
15. С раствором азотной кислоты реагируют:
А) оксид кремния (IV) Д) ацетат натрия
Б) карбонат аммония Е) оксид углерода (IV)
B) хлорид бария Ж) азот
Г) медь
16. Определите ошибочные утверждения: В процессе синтеза аммиака…
А) азот получают глубоким охлаждением с последующим разделением жидкого воздуха ректификацией
Б) азото-водородную смесь подвергают сжатию перед подачей в колонну синтеза
В) азот получают из минерального сырья, а водород – из метана
Г) азот получают перегонкой сжиженного воздуха, а водород – действием на цинк соляной кислоты
Д) водород получают при конверсии метана – основного компонента природного газа
Е) непрореагировавшее сырье вновь возвращают в производственный цикл
Ж) азот и водород получают при термическом разложении нитрита аммония
17. Установите соответствие между схемой реакции и веществом-окислителем:
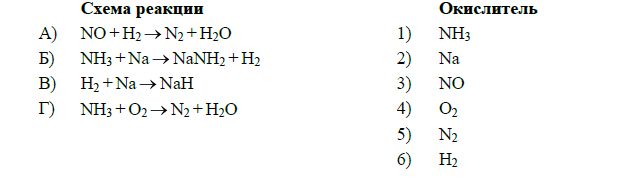
18. Установите соответствие между реагирующими веществами и продуктами, которые преимущественно образуются при взаимодействии этих веществ



22. Установите генетическую цепочку получения оксида азота (I):
А) аммиак Б) водород В) вода Г) нитрат аммония
23. Установите генетическую цепочку получения азотной кислоты:
А) аммиак Б) оксид азота (IV) В) оксид азота (II) Г) азот
24. Используя метод электронного баланса, укажите окислитель, восстановитель, расставьте коэффициенты.
MnO2 + N2H4 + H2SO4 = MnSO4 + N2 + H2O
25. К раствору сульфата аммония прилили раствор нитрата свинца (II). Образовался осадок, который отфильтровали. К оставшемуся раствору прилили избыток раствора гидроксида натрия и нагрели. Выделившийся при этом газ окислили кислородом на платиновом катализаторе. Образовавшийся бесцветный газ прореагировал с кислородом воздуха. При этом образовался другой газ, окрашенный в коричневый цвет.
26. Оксид азота (II) прореагировал с кислородом. Образовавшееся при этом вещество смешали с кислородом и пропустили через воду, при этом образовалась кислота. В концентрированный раствор этой кислоты поместили оксид железа (III). Образовавшуюся соль железа выделили и прилили избыток раствора гидроксида бария.
27. Смесь азота и водорода последовательно пропустили над нагретой платиной и через раствор серной кислоты. В раствор добавили хлорид бария. После отделения выпавшего осадка к раствору добавили гидроксид кальция и нагрели.
28. Смесь нитрата калия и бромида калия массой 20, 2 г нагрели. В результате реакции выделилось 1, 12 л газа (н. у. ). Определите массовые доли (в %) солей в исходной смеси.
В решении запишите уравнение реакции, указанное в условии задачи, и приведите все необходимые вычисления. В ответе приведите полученные числовые значения.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|