
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Приборы и принадлежности. Теоретическое введение. Выполнение работы
Приборы и принадлежности
источник постоянного напряжения (аккумулятор на 6…8 В или выпрямитель с хорошим фильтром), амперметр, весы с разновесами, электролит (раствор CuSO4), реостат на 30 Ом, секундомер, сосуд для электролита, соединительные провода.
Теоретическое введение
Фарадей показал, что происхождение тока через электролит сопровождается выделением вещества, причём масса выделившегося вещества
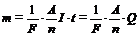 , (1)
, (1)
где Q – заряд прошедший через электролит;
A – атомарный вес иона;
n – его валентность.
Коэффициент пропорциональности F называют числом Фарадея: F = 9, 654× 107 Кл/кг-экв, т. е. заряд, связанный с одним килограмм-эквивалентом вещества. В 1888 году Гельмгольц указал, что отсюда можно найти средний заряд иона
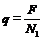 ,
,
где N1 – число атомов в килограмм-эквиваленте. После определения числа Авогадро (число атомов в килограмм - атоме вещества) оказавшегося равным NA = 6, 02× 1026 Кл 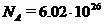 1/кг-атом, можно было оценить заряд n валентного иона
1/кг-атом, можно было оценить заряд n валентного иона
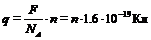 .
.
Он оказался кратным заряду электрона.
Найдя из опыта постоянную Фарадея и зная число Авогадро, можно вычислить заряд одновалентного иона, равный заряду электрона по формуле:
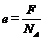 . (2)
. (2)
Выполнение работы
1. Ознакомившись с инструкцией и приборами, собирают схему по рис. 1.

Рис. 1
2. Сосуд заполняют электролитом и помещают в него медные электроды.
3. Предварительно высушенную катодную пластинку, взвешивают на весах, находят М1.
4. Устанавливают катодную пластинку, замыкают цепь и при помощи реостата устанавливают ток равный 1, 5 А. При этом одновременно включают секундомер. Время пропускания тока 15-30 мин.
5. Разомкнув цепь, вынимают катодную пластинку, просушивают её и снова взвешивают. Находят М2. Разность (М2 – М1) = m дает массу вещества, выделившегося на катоде при электролизе.
6. По формуле m = Ikt вычисляют электрохимический эквивалент вещества. По формуле 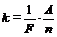 вычисляют число Фарадея; по формуле (2) определяют заряд электрона.
вычисляют число Фарадея; по формуле (2) определяют заряд электрона.
7. Заполняют таблицу:
| № п. п | Измерено | Вычислено | |||||||||
| М1, кг | М2, кг | m, кг | I, A | t, c | k, мг/Кл | kср, мг/Кл | Dk, мг/Кл | Е, % | F, Кл/(кг× моль) | е, Кл | |
| 1. 2. 3. 4. 5. | |||||||||||
Примечание: в соединении CuSO4 медь двухвалентная n = 2. Масса грамм–атома меди A = 63, 54 г = 63, 54× 10–3 кг/моль.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|