
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Приложение А
| № варианта | Задача 1 | Задача 2 | Задача 3 |
| Рассчитать: 1. содержание железа, серы, фосфора в железной руде, 2. основность железной руды, 3. выход концентрата и хвостов, 4. степень извлечения железа в концентрат и в хвосты, 5. коэффициент обогащения, 6. коэффициент сокращения | Рассчитать растворимость азотав расплаве при 1900°С и 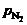 =1000Па
Исходные данные. 1. Состав стали: =1000Па
Исходные данные. 1. Состав стали: 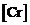 = 10 %; = 10 %; 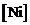 = 5 %; = 5 %; 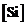 = 0, 87 %; = 0, 87 %;  = 2, 1 %. = 2, 1 %.
| После проведения окислительного периода железоуглеродистый расплав содержит 0, 1 % углерода. Температура металла 1750 ОС. Термодинамическим расчетом определить концентрацию кислорода в металле после раскисления его марганцем. Остаточная концентрация марганца в растворе – 0, 01 %. Определить также количество включений MnO % масс, образовавшихся при раскислении металла. Как изменится эта величина при охлаждении расплавa до 1900 °С?
Принять, что компоненты металла образуют идеальный разбавленный раствор.
Исходные данные
1. [Mn] + [O] = MnO(тв 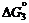 = =408400– 90T, Дж/г-ат. = =408400– 90T, Дж/г-ат.
| |
| Состав руды: 500 кг сидерита, 200 ильменита, 1050 кг приходится на сумму гематита и магнетита (соотношение 2: 3). Выход концентрата равен 0, 6, коэффициент обогащения равен 1, 73. Найти: содержание железа в исходной руде, выход хвостов, коэффициент сокращения, степень извлечения железа в концентрат и в хвосты. | Термодинамическим расчетом определить, при какой концентрации титана в стали 12Х10Н9Т при 1800 °С и 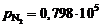 Па (0, 79 атм) образуются нитриды. Па (0, 79 атм) образуются нитриды.
| После проведения окислительного периода железоуглеродистый расплав содержит 0, 08 % углерода. Температура металла 1700 К. Термодинамическим расчетом определить концентрацию кислорода в металле после раскисления его алюминием. Остаточная концентрация алюминия в растворе – 0, 04 %. Определить также количество включений Al2O3 % масс, образовавшихся при раскислении металла.
Принять, что компоненты металла образуют идеальный разбавленный раствор.
Исходные данные
1. 2Al  + + 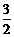 O O  = Al = Al 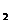 O O 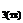 ; ; 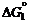 = –1676110 + 320, 08 T, Дж/г-ат.
2. Al = –1676110 + 320, 08 T, Дж/г-ат.
2. Al  = Al(1% в Fe); = Al(1% в Fe); 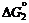 = –62760 – 23, 85 T, Дж/г-ат.
3. = –62760 – 23, 85 T, Дж/г-ат.
3. 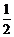 O O 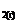 = [O](1% в Fe); = [O](1% в Fe);
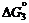 = –117150 – 2, 89 T, Дж/г-ат. = –117150 – 2, 89 T, Дж/г-ат. 
| |
| Известно, что содержание железа в агломерате равно 55, 23%, при этом степень его восстановления 0, 995. Состав чугуна: углерод – 4, 1%, кремний – 0, 31%, марганец -0, 32%, сера – 0, 03%, фосфор- 0, 1%. Масса железа, перешедшего в чугун из кокса 0, 612 кг. Найти: расход агломерата на выплавку 1 т чугуна. | Рассчитать растворимость водорода в легированной стали при заданных температуре и давлении.
Исходные данные. 1. Состав стали: 18 % Сr; 9 %Ni; 0, 5 %Si; 1, 5 % Mn.
2. Температура 1923 К.
3. Давление газов: рH2= 0, 25 атм.
4. 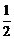 H2 (г)= [H](1 % вFe); lgKH= H2 (г)= [H](1 % вFe); lgKH= 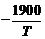 - 1, 577. - 1, 577.
| Температура металла 1590 °С. Термодинамическим расчетом определить концентрацию кислорода в металле после раскисления его углеродом. Остаточная концентрация углерода в растворе – 0, 1 %.
2. [C] + [O] = CO(г); lgK4 = 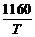 + 2, 0. + 2, 0.
| |
| В состав руды входит 4 минерала сидерит, магнетит, ильменит и вьюстит в количестве 20, 500, 70 и 300 кг соответственно. Содержание железа в хвостах 12%, а степень извлечения в хвосты 0, 13(13%). Найти: содержание железа в исходной руде, содержание железа в концентрате, степень извлечения в концентрат, коэффициент обогащения и коэффициент сокращения. | Рассчитать растворимость азотав расплаве при 1800°С и 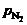 =100Па
Исходные данные. 1. Состав стали: =100Па
Исходные данные. 1. Состав стали: 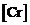 = 9 %; = 9 %; 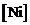 = 5 %; = 5 %; 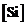 = 0, 87 %; = 0, 87 %;  = 3, 1 %. = 3, 1 %.
| Температура металла 1800 К. Термодинамическим расчетом определить концентрацию кислорода в металле после раскисления его кремнием. Остаточная концентрация кремния в растворе – 0, 13 %.
2. [Si] + 2[O] = SiO2(тв); lgK2 = 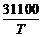 – 12, 0. – 12, 0.
| |
| Известно, что расход известняка на производство составляет 16, 2 кг/100 кг, расход концентрата – 99, 8 кг/100 кг. Расход кокса составляет 1/5 расхода известняка. При этом потери компонентов в процессе спекания составляют: концентрата -1, 99, а потери кокса в 2, 1 раза больше, чем потери известняка. Найти чему равны потери при спекании для кокса и известняка и расход кокса *расчет на 100 кг агломерата | Термодинамическим расчетом определить, при какой концентрации титана в стали Х18Н9Т при 1700 °С и 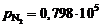 Па (0, 79 атм) образуются нитриды. Па (0, 79 атм) образуются нитриды.
| Температура металла 1700 °С. Термодинамическим расчетом определить концентрацию кислорода в металле после раскисления его углеродом. Остаточная концентрация углерода в растворе – 0, 09 %.
2. [C] + [O] = CO(г); lgK4 = 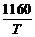 + 2, 0. + 2, 0.
| |
| Рассчитать: 1. содержание железа, серы, фосфора в железной руде, 2. основность железной руды, 3. выход концентрата и хвостов, 4. степень извлечения железа в концентрат и в хвосты, 5. коэффициент обогащения, 6. коэффициент сокращения | Рассчитать растворимость водорода в легированной стали при заданных температуре и давлении.
Исходные данные. 1. Состав стали: 13 % Сr; 10 %Ni; 1 %Si;
2. Температура 1903 К.
3. Давление газов: рH2= 0, 55 атм.
4. 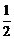 H2 (г)= [H](1 % вFe); lgKH= H2 (г)= [H](1 % вFe); lgKH= 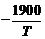 - 1, 577. - 1, 577.
| Температура металла 1780 °С. Термодинамическим расчетом определить концентрацию кислорода в металле после раскисления его углеродом. Остаточная концентрация углерода в растворе – 0, 12 %.
2. [C] + [O] = CO(г); lgK4 = 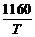 + 2, 0 + 2, 0
| |
| Известно, что содержание железа в агломерате равно 60, 4%, при этом степень его восстановления 0, 997. Состав чугуна: углерод – 4, 2%, кремний – 0, 43%, марганец -0, 35%, сера – 0, 04%, фосфор- 0, 2%. Масса железа, перешедшего в чугун из кокса 0, 553 кг. Найти: расход агломерата на выплавку 1 т чугуна. | Рассчитать растворимость азотав расплаве при 1820°С и 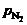 =10кПа
Исходные данные. 1. Состав стали: =10кПа
Исходные данные. 1. Состав стали: 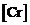 = 12 %; = 12 %; 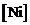 = 5 %; = 5 %; 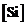 = 3 %; = 3 %;  = 2, 1 %. = 2, 1 %.
| После проведения окислительного периода железоуглеродистый расплав содержит 0, 11 % углерода. Температура металла 1893 К. Термодинамическим расчетом определить концентрацию кислорода в металле после раскисления его алюминием. Остаточная концентрация алюминия в растворе – 0, 03 %. Определить также количество включений Al2O3 % масс, образовавшихся при раскислении металла.
Принять, что компоненты металла образуют идеальный разбавленный раствор.
Исходные данные
1. 2Al  + + 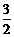 O O 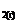 = Al = Al 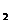 O O 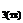 ; ; 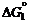 = –1676110 + 320, 08 T, Дж/г-ат.
2. Al = –1676110 + 320, 08 T, Дж/г-ат.
2. Al  = Al(1% в Fe); = Al(1% в Fe); 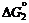 = –62760 – 23, 85 T, Дж/г-ат.
3. = –62760 – 23, 85 T, Дж/г-ат.
3. 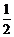 O O 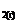 = [O](1% в Fe); = [O](1% в Fe);
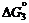 = –117150 – 2, 89 T, Дж/г-ат. = –117150 – 2, 89 T, Дж/г-ат.
| |
| Рассчитать: 1. содержание железа, серы, фосфора в железной руде, 2. основность железной руды, 3. выход концентрата и хвостов, 4. степень извлечения железа в концентрат и в хвосты, 5. коэффициент обогащения, 6. коэффициент сокращения | Термодинамическим расчетом определить, при какой концентрации титана в стали 30ХГСА при 1780 °С и давлении 100Па образуются нитриды. | Температура металла 1680 °С. Термодинамическим расчетом определить концентрацию кислорода в металле после раскисления его кремнием. Остаточная концентрация кремния в растворе – 0, 15 %.
2. [Si] + 2[O] = SiO2(тв); lgK2 = 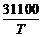 – 12, 0. – 12, 0.
| |
| В руде присутствует 25% железа (из гематита и магнетита) и 60% вюстита. Коэффициент обогащения равен 1, 77, а коэффициент сокращения равен 1, 9. Найти: Общее содержание железа в руде и концентрате. Выход концентрата и хвостов | Рассчитать растворимость водорода в легированной стали при заданных температуре и давлении.
Исходные данные. 1. Состав стали: 15 % Сr; 12 %Ni; 1, 5 %Si; 3, 5 % Mn.
2. Температура 1943 К.
3. Давление газов: рH2=1 атм.
4. 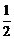 H2 (г)= [H](1 % вFe); lgKH= H2 (г)= [H](1 % вFe); lgKH= 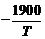 - 1, 577. - 1, 577.
| Расплав Fе–Cr–Ni продувают кислородом в открытой электродуговой печи. Вычислить конечную концентрацию углерода, которую можно получить до начала интенсивного окисления хрома при 2353 К. Определить изменение этой концентрации углерода: 1) при понижении температуры до 1973 К. Концентрация легирующих в расплаве: 17 % [Cr], 9 % [Ni]. Влиянием [%С] на fC пренебречь. Температурную зависимость коэффициента активности оценить, используя ТРР: lgfC(T )= 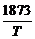 lgfC(1873)
Окисление углерода и хрома в расплавах, содержащих более 9 % хрома, описывается следующими уравнениями:
Сr3O4(т)+ 4[С] = 3[Cr] + 4СО(г);
DG = 882500 - 585T, Дж;
lgK1/4=lg([Cr]3/4 pCO /fC [C])=-(11520/T ) + 7, 64. lgfC(1873)
Окисление углерода и хрома в расплавах, содержащих более 9 % хрома, описывается следующими уравнениями:
Сr3O4(т)+ 4[С] = 3[Cr] + 4СО(г);
DG = 882500 - 585T, Дж;
lgK1/4=lg([Cr]3/4 pCO /fC [C])=-(11520/T ) + 7, 64.
| |
| Рассчитать: 1. содержание железа, серы, фосфора в железной руде, 2. основность железной руды, 3. выход концентрата и хвостов, 4. степень извлечения железа в концентрат и в хвосты, 5. коэффициент обогащения, 6. коэффициент сокращения | Рассчитать растворимость азотав расплаве при 1800°С и 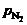 =100кПа
Исходные данные. 1. Состав стали: =100кПа
Исходные данные. 1. Состав стали: 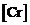 = 14 %; = 14 %; 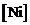 = 10 %; = 10 %; 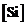 = 0, 87 %; = 0, 87 %;  = 2, 1 %. = 2, 1 %.
| После проведения окислительного периода железоуглеродистый расплав содержит 0, 1 % углерода. Температура металла 1720 ОС. Термодинамическим расчетом определить концентрацию кислорода в металле после раскисления его марганцем. Остаточная концентрация марганца в растворе – 0, 01 %. Определить также количество включений MnO % масс, образовавшихся при раскислении металла. Как изменится эта величина при охлаждении расплавa до 1900 °С?
Принять, что компоненты металла образуют идеальный разбавленный раствор.
Исходные данные
[Mn] + [O] = MnO(тв 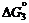 = =408400– 90T, Дж/г-ат. = =408400– 90T, Дж/г-ат.
| |
| Известно, что содержание железа в агломерате равно 62%, при этом степень его восстановления 0, 997. Состав чугуна: углерод – 4, 5%, кремний – 0, 36%, марганец -0, 42%, сера – 0, 04%, фосфор- 0, 12%. Масса железа, перешедшего в чугун из кокса 0, 564 кг. Найти: расход агломерата на выплавку 1 т чугуна. | Термодинамическим расчетом определить, при какой концентрации титана в стали 09Г2С при 1900 °С и давлении 0, 79 атмобразуются нитриды. | Температура металла 1705 °С. Термодинамическим расчетом определить концентрацию кислорода в металле после раскисления его кремнием. Остаточная концентрация кремния в растворе – 0, 11 %.
2. [Si] + 2[O] = SiO2(тв); lgK2 = 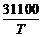 – 12, 0. – 12, 0.
| |
| Исходный состав руды: магнетит, гематит и сидерит. Количество гематит 740 кг, а суммарная масса двух оставшихся оксидов железа 920 кг, при этом известно, что содержание магнетита в 3 раза превышает содержание сидерита. Известно, что степень извлечения железа в хвосты равна 0, 135 (13, 5%), а коэффициент сокращения равен 2, 2. Найти: содержание железа в исходной руде (в процентах), степень извлечения железа в концентрат, коэффициент обогащения, выход концентрата и хвостов. | Рассчитать растворимость водорода в легированной стали при заданных температуре и давлении.
Исходные данные. 1. Состав стали: 15 % Сr; 10 %Ni; 2 %Si; 1, 5 % Mn.
2. Температура2045 К.
3. Давление газов: рH2=0, 75 атм.
4. 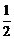 H2 (г)= [H](1 % вFe); lgKH= H2 (г)= [H](1 % вFe); lgKH= 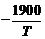 - 1, 577. - 1, 577.
| После проведения окислительного периода железоуглеродистый расплав содержит 0, 12 % углерода. Температура металла 1690 ОС. Термодинамическим расчетом определить концентрацию кислорода в металле после раскисления его марганцем. Остаточная концентрация марганца в растворе – 0, 12 %. Определить также количество включений MnO % масс, образовавшихся при раскислении металла. Как изменится эта величина при охлаждении расплавa до 1800 °С?
Принять, что компоненты металла образуют идеальный разбавленный раствор.
Исходные данные
[Mn] + [O] = MnO(тв 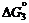 = =408400– 90T, Дж/г-ат. = =408400– 90T, Дж/г-ат.
| |
| Известно, что расход известняка на производство составляет 30 кг/100 кг, расход концентрата – 97, 8 кг/100 кг. Расход кокса в 6, 4 раза меньше, чем расход известняка. При этом потери компонентов в процессе спекания составляют: концентрата 1, 9, а потери кокса в 1, 88 раз больше, чем потери известняка. Найти чему равны потери при спекании для кокса и известняка, расход кокса *расчет на 100 кг агломерата | Рассчитать растворимость азотав расплаве при 1950°С и 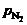 =1атм.
Исходные данные. 1. Состав стали: =1атм.
Исходные данные. 1. Состав стали: 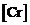 = 15 %; = 15 %; 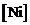 = 9 %; = 9 %; 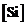 = 2 %; = 2 %;  = 1, 8 %. = 1, 8 %.
| Расплав Fе–Cr–Ni продувают кислородом в открытой электродуговой печи. Вычислить конечную концентрацию углерода, которую можно получить до начала интенсивного окисления хрома при 2240 К. Определить изменение этой концентрации углерода: 1) при понижении температуры до 1973 К. Концентрация легирующих в расплаве: 16 % [Cr], 8 %[Ni]. Влиянием [%С] на fC пренебречь. Температурную зависимость коэффициента активности оценить, используя ТРР: lgfC(T )= 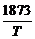 lgfC(1873)
Окисление углерода и хрома в расплавах, содержащих более 9 % хрома, описывается следующими уравнениями:
Сr3O4(т)+ 4[С] = 3[Cr] + 4СО(г);
DG = 882500 - 585T, Дж;
lgK1/4=lg([Cr]3/4 pCO /fC [C])=-(11520/T ) + 7, 64. lgfC(1873)
Окисление углерода и хрома в расплавах, содержащих более 9 % хрома, описывается следующими уравнениями:
Сr3O4(т)+ 4[С] = 3[Cr] + 4СО(г);
DG = 882500 - 585T, Дж;
lgK1/4=lg([Cr]3/4 pCO /fC [C])=-(11520/T ) + 7, 64.
| |
| В исходном составе руды присутствует сидерит в количестве 23%, гематит в количестве 18%, 8% пустой породы, а остальное -магнетит. Коэффициент сокращения равен 1, 8. Найти: содержание железа в исходной руде, выход концентрата и хвостов. | Термодинамическим расчетом определить, при какой концентрации титана в стали 08Х18Н12Т при 1700 °С и давлении 1 атм образуются нитриды. | Температура металла 1725 °С. Термодинамическим расчетом определить концентрацию кислорода в металле после раскисления его кремнием. Остаточная концентрация кремния в растворе – 0, 12 %.
2. [Si] + 2[O] = SiO2(тв); lgK2 = 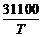 – 12, 0 – 12, 0
| |
| Известно, что содержание железа в агломерате равно 58, 9%, при этом степень его восстановления 0, 996. Состав чугуна: углерод – 4%, кремний – 0, 47%, марганец -0, 51%, сера – 0, 03%, фосфор- 0, 2%. Масса железа, перешедшего в чугун из кокса 0, 603 кг. Найти: расход агломерата на выплавку 1 т чугуна. | Рассчитать растворимость водорода в легированной стали при заданных температуре и давлении.
Исходные данные. 1. Состав стали: 15 % Сr; 12 %Ni; 0, 5 %Si; 1, 5 % Mn.
2. Температура2023 К.
3. Давление газов: рH2= 0, 5 атм.
4. 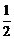 H2 (г)= [H](1 % вFe); lgKH= H2 (г)= [H](1 % вFe); lgKH= 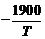 - 1, 577. - 1, 577.
| После проведения окислительного периода железоуглеродистый расплав содержит 0, 13 % углерода. Температура металла 1705ОС. Термодинамическим расчетом определить концентрацию кислорода в металле после раскисления его марганцем. Остаточная концентрация марганца в растворе – 0, 1 %. Определить также количество включений MnO % масс, образовавшихся при раскислении металла. Как изменится эта величина при охлаждении расплавa до 1870 °С?
Принять, что компоненты металла образуют идеальный разбавленный раствор.
Исходные данные
[Mn] + [O] = MnO(тв 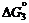 = =408400– 90T, Дж/г-ат. = =408400– 90T, Дж/г-ат.
| |
| Рассчитать: 1. содержание железа, серы, фосфора в железной руде, 2. основность железной руды, 3. выход концентрата и хвостов, 4. степень извлечения железа в концентрат и в хвосты, 5. коэффициент обогащения, 6. коэффициент сокращения | Рассчитать растворимость азотав расплаве при 1950°С и 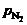 =100Па
Исходные данные. 1. Состав стали: =100Па
Исходные данные. 1. Состав стали: 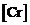 = 12 %; = 12 %; 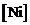 = 15 %; = 15 %; 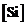 = 0, 91 %; = 0, 91 %;  = 3 %. = 3 %.
| Температура металла 1740 °С. Термодинамическим расчетом определить концентрацию кислорода в металле после раскисления его кремнием. Остаточная концентрация кремния в растворе – 0, 09 %.
2. [Si] + 2[O] = SiO2(тв); lgK2 = 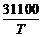 – 12, 0 – 12, 0
| |
| Известно, что расход известняка на производство составляет 17, 89 кг/100 кг, расход концентрата – 99, 5 кг/100 кг. Расход кокса в 29 раз меньше, чем расход концентрата. При этом потери: концентрата в процессе спекания в 45 раз меньше потерь кокса, и в 21 раз меньше потерь известняка. Найти чему равны потери при спекании для кокса и известняка и расход кокса *расчет на 100 кг агломерата | Термодинамическим расчетом определить, при какой концентрации титана в стали 05Х18Н10Т при 1800 °С и 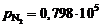 Па (0, 79 атм) образуются нитриды. Па (0, 79 атм) образуются нитриды.
| Расплав Fе–Cr–Ni продувают кислородом в открытой электродуговой печи. Вычислить конечную концентрацию углерода, которую можно получить до начала интенсивного окисления хрома при 2383 К. Определить изменение этой концентрации углерода: 1) при понижении температуры до2003 К. Концентрация легирующих в расплаве: 18 % [Cr], 7 % [Ni]. Влиянием [%С] на fC пренебречь. Температурную зависимость коэффициента активности оценить, используя ТРР: lgfC(T ) 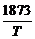 lgfC(1873)
Окисление углерода и хрома в расплавах, содержащих более 9 % хрома, описывается следующими уравнениями:
Сr3O4(т)+ 4[С] = 3[Cr] + 4СО(г);
DG = 882500 - 585T, Дж;
lgK1/4=lg([Cr]3/4 pCO /fC [C])=-(11520/T ) + 7, 64. lgfC(1873)
Окисление углерода и хрома в расплавах, содержащих более 9 % хрома, описывается следующими уравнениями:
Сr3O4(т)+ 4[С] = 3[Cr] + 4СО(г);
DG = 882500 - 585T, Дж;
lgK1/4=lg([Cr]3/4 pCO /fC [C])=-(11520/T ) + 7, 64.
| |
| Руда состоит из 15% магнетита, 900 кг гематита и 50 кг сидерита. Содержание железа в концентрате 60%, степень извлечения железа в концентрат 0, 7. Найти: содержание железа в исходной руде, выход концентрата и хвостов, коэффициент обогащения и коэффициент сокращения | Рассчитать растворимость водорода в легированной стали при заданных температуре и давлении.
Исходные данные. 1. Состав стали: 14 % Сr; 12 %Ni; 0, 55 %Si; 1, 65 % Mn.
2. Температура 1953 К.
3. Давление газов: рH2= 0, 25 атм.
4. 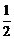 H2 (г)= [H](1 % вFe); lgKH= H2 (г)= [H](1 % вFe); lgKH= 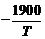 - 1, 577. - 1, 577.
| Температура металла 1752 °С. Термодинамическим расчетом определить концентрацию кислорода в металле после раскисления его кремнием. Остаточная концентрация кремния в растворе – 0, 14 %.
2. [Si] + 2[O] = SiO2(тв); lgK2 = 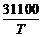 – 12, 0 – 12, 0
| |
| Рассчитать: 1. содержание железа, серы, фосфора в железной руде, 2. основность железной руды, 3. выход концентрата и хвостов, 4. степень извлечения железа в концентрат и в хвосты, 5. коэффициент обогащения, 6. коэффициент сокращения | Рассчитать растворимость азотав расплаве при 1900°С и 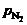 =1000Па
Исходные данные. 1. Состав стали: =1000Па
Исходные данные. 1. Состав стали: 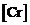 = 12 %; = 12 %; 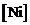 = 12 %; = 12 %; 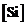 = 0, 77 %; = 0, 77 %;  = 1, 8 %. = 1, 8 %.
| Температура металла 1700 °С. Термодинамическим расчетом определить концентрацию кислорода в металле после раскисления его углеродом. Остаточная концентрация углерода в растворе – 0, 13 %.
2. [C] + [O] = CO(г); lgK4 = 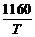 + 2, 0. + 2, 0.
| |
| Рассчитать: 1. содержание железа, серы, фосфора в железной руде, 2. основность железной руды, 3. выход концентрата и хвостов, 4. степень извлечения железа в концентрат и в хвосты, 5. коэффициент обогащения, коэффициент сокращения | Термодинамическим расчетом определить, при какой концентрации титана в стали 12Х10Н10 при 1670 °С и 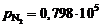 Па (0, 79 атм) образуются нитриды. Па (0, 79 атм) образуются нитриды.
| Расплав Fе–Cr–Ni продувают кислородом в открытой электродуговой печи. Вычислить конечную концентрацию углерода, которую можно получить до начала интенсивного окисления хрома при1700ОС. Определить изменение этой концентрации углерода: 1) при понижении температуры до 1973 К. Концентрация легирующих в расплаве: 13 % [Cr], 10 % [Ni]. Влиянием [%С] на fC пренебречь. Температурную зависимость коэффициента активности оценить, используя ТРР: lgfC(T )= 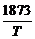 lgfC(1873)
Окисление углерода и хрома в расплавах, содержащих более 9 % хрома, описывается следующими уравнениями:
Сr3O4(т)+ 4[С] = 3[Cr] + 4СО(г);
DG = 882500 - 585T, Дж;
lgK1/4=lg([Cr]3/4 pCO /fC [C])=-(11520/T ) + 7, 64. lgfC(1873)
Окисление углерода и хрома в расплавах, содержащих более 9 % хрома, описывается следующими уравнениями:
Сr3O4(т)+ 4[С] = 3[Cr] + 4СО(г);
DG = 882500 - 585T, Дж;
lgK1/4=lg([Cr]3/4 pCO /fC [C])=-(11520/T ) + 7, 64.
| |
| Рассчитать: 1. содержание железа, серы, фосфора в железной руде, 2. основность железной руды, 3. выход концентрата и хвостов, 4. степень извлечения железа в концентрат и в хвосты, 5. коэффициент обогащения, 6. коэффициент сокращения | Рассчитать растворимость водорода в легированной стали при заданных температуре и давлении.
Исходные данные. 1. Состав стали: 17 % Сr; 11 %Ni; 1, 5 %Si; 2 % Mn.
2. Температура 1913 К.
3. Давление газов: рH2= 0, 25 атм.
4. 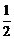 H2 (г)= [H](1 % вFe); lgKH= H2 (г)= [H](1 % вFe); lgKH= 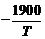 - 1, 577. - 1, 577.
| Температура металла 1690 °С. Термодинамическим расчетом определить концентрацию кислорода в металле после раскисления его кремнием. Остаточная концентрация кремния в растворе – 0, 12 %.
2. [Si] + 2[O] = SiO2(тв); lgK2 = 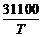 – 12, 0 – 12, 0
| |
| В состав руды входит вьюстит и ильменит в соотношении 5 к 1, 10% пустой породы и 60% магнетита. Выход хвостов равен 0, 2, а коэффициент обогащения равен 1, 7. Найти: содержание железа в исходной руде, выход концентрата, коэффициент сокращения. | Рассчитать растворимость азотав расплаве при 1840°С и 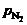 =1000Па
Исходные данные. 1. Состав стали: =1000Па
Исходные данные. 1. Состав стали: 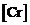 = 12 %; = 12 %; 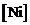 = 10 %; = 10 %; 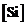 = 0, 67 %; = 0, 67 %;  = 1, 9 %. = 1, 9 %.
| Температура металла 1650 °С. Термодинамическим расчетом определить концентрацию кислорода в металле после раскисления его углеродом. Остаточная концентрация углерода в растворе – 0, 11 %.
2. [C] + [O] = CO(г); lgK4 = 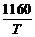 + 2, 0. + 2, 0.
|
|
Приложение А | |||||||||||||
| № варианта | Тип рудного минерала | Состав железной руды, % (пересчет на сухую массу) | Содержание Fe в концентрате и хвостах, % | ||||||||||
| FeO | Fe2O3 | MnO | SiO2 | Al2O3 | CaO | MgO | SO3 | P2O5 | ППП | (Fe)конц. | (Fe)хв. | ||
| МГ | 10. 7 | 30. 8 | 0. 06 | 49. 3 | 2. 6 | 2. 4 | 2. 4 | 0. 1 | 0. 06 | 1. 58 | |||
| МГ | 11. 5 | 24. 4 | 2. 8 | 18. 7 | 15. 9 | 14. 3 | 2. 3 | 0. 8 | 0. 1 | 9. 2 | |||
| МГ | 15. 3 | 27. 4 | 0. 1 | 49. 5 | 2. 2 | 1. 3 | 1. 8 | 0. 6 | 0. 2 | 1. 6 | |||
| МГ | 11. 5 | 34. 6 | 0. 2 | 3. 9 | 2. 3 | 2. 1 | 0. 2 | 0. 03 | 1. 17 | ||||
| ГГМ | 1. 56 | 69. 9 | 1. 6 | 10. 1 | 3. 6 | 0. 5 | 1. 2 | 0. 08 | 0. 08 | 11. 38 | |||
| С | 36. 9 | 1. 27 | 9. 5 | 2. 8 | 3. 2 | 9. 8 | 0. 4 | 0. 03 | 34. 1 | ||||
| ГГМ | 0. 2 | 55. 9 | 0. 42 | 15. 7 | 1. 1 | 1. 2 | 0. 1 | 0. 18 | 12. 2 | ||||
| ГГМ | 56. 2 | 0. 27 | 4. 6 | 1. 3 | 0. 3 | 0. 1 | 0. 23 | ||||||
| ГГМ | -- | 67. 2 | 2. 2 | 9. 9 | 0. 7 | 4. 4 | 1. 1 | 0. 09 | 0. 26 | 14. 15 | |||
| Примечание: МГ - магнетит; ГМ - гематит; ГГМ - гидрогематит; С - сидерит | |||||||||||||
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|