
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
1.3. Химические свойства
Слайд 1:
Введение
В живых организмах обнаруживается свыше 60 химических элементов. Среди этих элементов выделяют несколько важных, которые встречаются наиболее часто, чем другие. К ним относят C, N, H, O, S, P, Na, K, Ca, Mg, Zn, Fe, Mn и др. Первым шести элементам приписывают исключительную роль в биосистемах, так как из этих элементов построены важнейшие соединения, которые составляют основу живого организма – белки, нуклеоиновые кислоты, углеводы, липиды и др.
Примерно 75% организма составляет вода. Вторым по количественному содержанию и первым по значению классом соединений идут белки. Белки состоят из мономерныхединий, т. е. белков.
Аминокислоты (аминокарбоновые кислоты) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.
Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминные группы.
Цель работы: подробное рассмотрение аминокислот и белков.
Задачи:
1. Провести изучение литературы
2. Рассмотреть основные понятия
3. Рассмотреть строение, способы получения и химические свойства аминокислот и белков
Слайд 2:
АМИНОКИСЛОТЫ - Органические соединения, содержащие в молекуле карбоксильную и аминогруппы, называются аминокислотами. Из остатков аминокислот построены белки – основной материал, из которого состоят объекты живой природы. Поэтому аминокислоты имеют огромное значение.
Слайд 3:
В зависимости от положения аминогруппы по отношению к карбоксильной группе в углеродной цепи различают α, β, γ аминокислоты.
Аминокислоты могут содержать в молекуле не только обычную углеродную цепь, но и циклы.
Аминокислоты делят на природные (содержатся в растительных и животных организмах) и синтетические (не встречаются в природе).
В настоящее время известно свыше 150 аминокислот, но только 26 из них входят в состав белков. Некоторые из этих аминокислот (валин, лейцин, изолейцин, лизин, метионин, треонин, фенилаланин и триптофан) являются незаменимыми. Они не вырабатываются в живом организме, а поступают в него с пищей.
Слайд 4:
Получение α -аминокислот:
Действием аммиака на α -галоидкарбоновые кислоты:
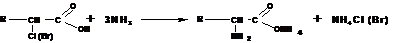
Получение по методу Штреккера-Зелинского:
По этому методу альдегид обрабатывают водным раствором смеси цианистого калия и хлорида аммония:
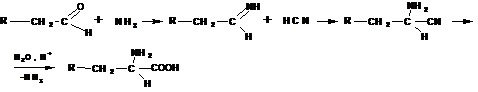
слайд 5:
Получение β -аминокислот:
Присоединение аммиака к α, β -ненасыщенным кислотам:
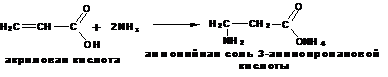
Получение по методу Родионова:
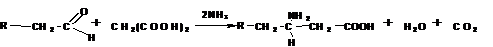
Слайд 6:
Получение γ -аминокислоты из левулиновой кислоты:
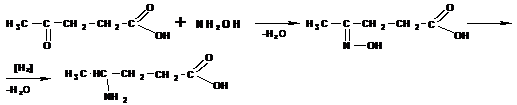
Ароматические аминокислоты
пара- и мета-Аминобейзойные кислоты получают восстановлением соответствующих нитробензойных кислот:

орто-Изомер., так называемую антраниловую кислоту получают из фталевого ангидрида, через фталимид действием гипобромита:

Слайд 7:
1. 3. Химические свойства
Аминокислоты – бесцветные кристаллические вещества с высокими температурами плавления, которые мало отличаются для разных аминокислот и поэтому не характерны. Плавление сопровождается разложением вещества. Плавление с разложением характерно для солей. Будучи солями аминокислоты хорошо растворимы в воде. Водный раствор аминокислот имеет нейтральную реакцию, что также характерно для солей. Аминокислоты представляют собой так называемые внутренние соли (биполярные ионы):
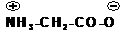
Такой ион в кислой среде ведет себя как катион, так как подавляется диссоциация карбоксильной группы, а в щелочной среде аминокислота ведет себя как анион:
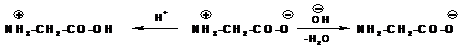
Значение рH при котором достигается максимальная концентрация биполярного иона – называется изоэлектрической точкой.
Слайд 8:
Подобно другим соединениям со смешанными функциями, аминокислоты проявляют свойства кислот и аминов.
Аминокислоты образуют соли с основаниями. Соли α -аминокислот с тяжелыми металлами могут иметь комплексный характер:
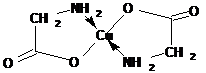
соль имеет интенсивно синее окрашивание.
Аминокислоты образуют соли с неорганическими кислотами:
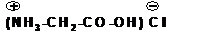
Слайд 9:
Подобно другим кислотам, аминокислоты образуют сложные эфиры, хлорангидриды, амиды и т. д:

Слайд 10:
При действии азотистой кислоты аминокислоты образуют гидроксикислоты:

Аминогруппа в аминокислотах легко ацилируется при действии ангидридов и хлорангидридов кислот:
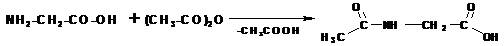
При алкилировании аминогруппы получаются вторичные и третичные аминокислоты. В избытке галоидного алкила образуются четырехзамещенные аммонийные основания. Внутренние соли таких оснований называются бетаинами:
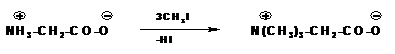
Слайд 11:
Поведение α, β и γ -аминокислот при нагревании:
α -аминокислоты межмолекулярно образуют циклические амиды – дикетопиперазины:

β -аминокислоты при нагревании отщепляют молекулу аммиака с образованием α, β -ненасыщенных кислот (аммонийная соль ):
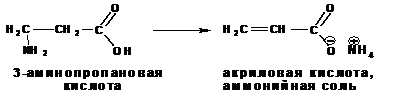
Слайд 12:
γ и δ -аминокислоты при нагревании отщепляют воду и образуют внутримолекулярные циклические амиды – лактамы:

Слайд 13:
Белки – это сложные высокомолекулярные органические соединения, построенные из остатков аминокислот, соединенных между собой амидными связями.
По составу белки делят на протеины – простые белки, состоящие только из остатков аминокислот, и протеиды – сложные белковые образования, в состав которых кроме белковых веществ входят небелковые соединения (фосфорная кислота, улеводы, липиды и др. )
Слайд 14:
2. 2. Получение
Растения синтезируют белки из оксида углерода и воды за счет фотосинтеза, усваивая остальные элементы белков (азот, фосфор, серу и др. ) из растворимых солей, содержащихся в почве. Человек и животные получают готовые аминокислоты с пищей, из которых строят белки, свойственные только данному организму.
Слайд 15:
2. 3. Химические свойства
Как и аминокислоты, белки обладают амфотерными свойствами. В щелочной среде они проявляют кислотные свойства, а в кислой – основные. Многие белки растворяются в воде, в кислотах и щелочах. Водные растворы белков представляют собой высокомолекулярные коллоиды. Если белки нагреть до 100℃ илиподействоватьнаихкислотами, щелочамиилирастворами некоторых солей, то в их молекулах происходят необратимые изменения, которые называют денатурацией. В денатурированном белке изменяются физические, химические и биологические свойства. Это связано с тем, что процесс денатурации приводит к разрушению водородных и некоторых ковалентных связей, создающих вторичную и третичную структуры. С процессом денатурации часто сталкиваются при горячем приготовлении пищи.
Существует ряд качественных цветных реакций на белки:
1. Ксантопротеиновая с азотной кислотой. Белки, обработанные азотной кислотой дают желтое окрашивание.
2. Биуретовая с солями меди в присутствии щелочи. Белки дают фиолетовую окраску за счет образования комплексной соли.
3. Реакция Миллона. С раствором нитрата ртути в азотистой кислоте белки дают красное окрашивание.
4. Сульфгидрильная. При нагревании белков с раствором плюмбита натрия выделяется черный осадок сульфида свинца.
Заключение
Аминокислоты – это «кирпичики», из которых построены молекулы важнейших биополимеров – белков. Многообразие функций, осуществляемых белками в живых организмах, определяется их химической структурой и физико-химическими свойствами.
Для понимания строения и свойств аминокислот, которые являются соединениями со смешанными функциями и проявляют как свойства карбоновых кислот, так и свойства аминов, необходимо изучение и азотсодержащих органических соединений, и карбоновых кислот.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|