
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
План – конспект занятия кружка «Юный химик»
План – конспект занятия кружка «Юный химик»
09-10. 02. 22
Занятие № 45-46
Тема: «Гидролиз».
Ход занятия:
1. Посмотрите ролик о процессах гидролиза: https: //www. youtube. com/watch? v=2qu4mJwPrEA
2. Гидролиз – это взаимодействие ионов солей с водой, приводящие к появлению кислой или щелочной среды, но не сопровождающиеся образованием осадка или газа.
Процесс гидролиза состоит из двух этапов:
1. Диссоциация соли в растворе – необратимая реакция
2. Собственно гидролиз соли – обратимая реакция.
Условия для гидролиза:
А) Наличие воды.
Б) Реакция идет только по первой стадии.
В) Реакция обратима.
Выделяют три типа гидролиза:
1. Соль образованная сильным основанием и сильной кислотой.
Приведите примеры таких солей?
NaCl – соль образованная сильным основанием NaOH, и сильной кислотой – HCl.
Проводится опыт: К раствору соли добавляется индикатор – лакмус. Окрашивание фиолетовое. Учащиеся делают вывод, что реакция среды нейтральная и записывают вывод, что соль образованная сильным основанием и сильной кислотой гидролизу не подвергается и имеет нейтральную реакцию среды.
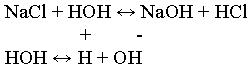
|
Практическое применение поваренной соли.
2. Соль, образованная сильным основанием и слабой кислотой. Гидролиз по аниону.
Приводятся примеры солей.
Na2CO3 - соль образованная сильным основанием NaOH, и слабой кислотой H2CO> 3.
Проводится опыт: Берутся две пробирки, в которые наливают растворы гидроксида натрия, и карбоната натрия добавляем в обе пробирки фенолфталеин.
Учащиеся наблюдают малиновое окрашивание и делают вывод, что реакция среды щелочная и интенсивность окрашивания в обоих пробирках одинакова.
Записывается уравнение реакции.

|
Поэтому сода находит большое применение в быту.
Избыток гидроксид-ионов дает соли щелочную реакцию среды, поэтому лакмус синий, а фенолфталеин становится малиновым.
3. Соль, образованная слабым основанием и сильной кислотой, гидролиз по катиону.
Приводятся примеры таких солей.
CuCl2 - соль образованная сильной кислотой HCI и слабым основанием Cu(OH)2
Проводится опыт: Берутся две пробирки в которые наливаются растворы кислоты и хлорида меди. В обе пробирки приливаем индикатор – лакмус, и наблюдаем красное окрашивание. Интенсивность окрашивания приблизительно одинакова.
Записываем уравнение реакции.
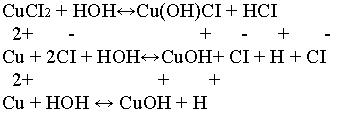
Избыток ионов водорода дает соли кислую реакцию, поэтому лакмус краснеет.
Вывод : Гидролиз – это взаимодействие солей с водой, в зависимости от типа соли индикаторы окрашиваются в различные цвета.
3. Попробуйте ответить на вопросы:
Какие электролиты называются сильными? слабыми? Привести примеры.
- Сильная кислота - это... . Привести примеры (5-6) сильных кислот
- Сильное основание - это.... Привести примеры (4-5).
- Слабая кислота - это... . Привести примеры.
- Слабое основание - это... Привести примеры. .
4. Пройдите он-лайн тест:
https: //obrazovaka. ru/test/gidroliz-soley. html
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|