
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
2. Цыган В.Н, Литвицкий П.Ф. , Дергунов А.В. - Патофизиология. Клиническая патофизиология. Учебник в 2-х томах. Том 1
Кислотно-щелочное равновесие.
Содержание:
Введение …………………………………………………………………с.
Глава 1. Понятие кислотно-щелочного равновесия……. ……………. с.
1. 1. Основные понятия………………………………………………….. с.
1. 2 Буферные системы……………………………………………………с.
1. 2. 1. Бикарбонатная буферная система…………………………………с.
1. 2. 2. Фосфатная буферная система…………………………………….. с.
1. 2. 3. Белковая буферная система………………………………………... с.
1. 2. 4. Гемоглобиновый буфер……………………………………………. с.
1. 3. Компенсационные механизмы КЩР……………………………….. с.
1. 3. 1 Лёгкие……………………………………………………………….. с.
1. 3. 2 Почки…………………………………………………………………с.
1. 3. 3 Печень…………………………………………………………………с.
1. 3. 4 Желудок и кишечник……………………………………………….. с.
1. 4. Показатели КЩР………………………………………………………с.
1. 4. 1. Кровяные показатели………………………………………………с..
1. 4. 2. Альвеоляные показатели……………………………………………. с.
Глава 2. Нарушения КЩР………………………………………………….. с.
2. 1. Респираторный ацидоз…………………………………………………с.
2. 2. Нереспираторный ацидоз……………………………………………….. с.
2. 3. Алкалозы…………………………………………………………………с.
2. 3. 1. Респираторный алкалоз…………………………………………….. с.
2. 3. 2. Нереспираторный алкалоз……………………………………………с.
Заключение……………………………………………………………………с.
Приложение……………………………………………………………………с.
Схема 1. Классификация нарушений КЩР………………………………….. с.
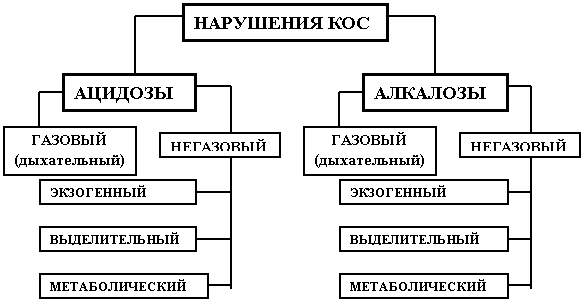
Схема 2. . Виды нарушений КЩР (ацидозы, алкалозы)……………………с.
Список литературы……………………………………………………………. с.
Введение.
Постоянство рН внутренней среды является необходимым условием существования высших организмов. Оно обеспечивается определенным соотношением кислот и оснований – КЩР - в биологических средах, при нарушении которого организм погибает. От соотношения ионов Н+ и ОН- во внутренней среде организма в значительной мере зависят активность ферментов и, следовательно, интенсивность и направленность метаболических процессов, подвижность и чувствительность клеточных рецепторов, проницаемость мембран, физико-химические свойства коллоидов клеток и межклеточных структур: степень их дисперсности, гидрофильность, способность к адсорбции, свойство гемоглобина присоединять и отдавать кислород и т. д.
Все ферментные реакции протекают при строго постоянном рН среды.
Генетические механизмы тоже находятся под контролем концентрации водородных ионов.
Нарушения КЩР наблюдаются при многих заболеваниях и экстремальных состояниях. Они отягощают их течение и подлежат коррекции. Знание причин и механизмов этих отклонений, а также способов их устранения особенно необходимо в подготовке будущего врача.
Давайте рассмотрим изменения кислотно-основного равновесия и механизмы их компенсации и декомпенсации при различных заболеваниях и экстремальных состояниях.
Глава 1. Понятие кислотно-щелочного равновесия.
1. 1. Основные понятия.
Кислотно-щелочное равновесие (КЩР) представляет собой определенное равновесное соотношение между кислыми и основными валентностями организма. При его изменении происходят:
- нарушение работы ферментов
- сдвиг биохимических реакций
- изменение чувствительности рецепторов
- изменение проницаемости
- нарушение диссоциации оксигемоглобина
- нарушение работы К- Na – насоса
- нарушение проведения нервного импульса
Все выше перечисленное позволяет нам сделать вывод о том, что КЩР обеспечивает гомеостазное равновесие – динамическое соотношение кислых и щелочных продуктов. В течение дня человек употребляет различную пищу. Состояние его организма постоянно меняется, и все внутренние органы и системы должны должным образом реагировать на эти изменения. Это говорит о важности обеспечения уровня гомеостаза человеческого организма, постоянности его внутренней среды.
Кислотно-щелочное равновесие (КЩР) оценивают по величине рН — водородному показателю крови, который представляет из себя отрицательный десятичный логарифм молярной концентрации H+ в среде. В норме он изменяется в пределах от 7. 35 до 7. 45. Сдвиг его в сторону закисления может приводить к развитию болезней. Снижение уровня pH у человека до значений 6. 75-6. 8 может приводить даже к летальному исходу. По оценке изменения pH можно говорить о снижении кислотности или увеличении щелочности. Понижение рН свидетельствует об увеличении кислотности, а его увеличение – об увеличении щелочности. Именно поэтому очень важно поддерживать уровень рН неизменным.
1. 2 Буферные системы.
В человеческом организме есть механизмы саморегуляции уровня рН. Существуют четыре буферные системы. Которые сдерживают сдвиги рН за счет своей двух-компонентности. Кислотный компонент выступает как донатор, а щелочной как акцептор протонов H. Химические буферные системы представлены в основном бикарбонатным(53%), фосфатным(5%), белковым(7%) и гемоглобиновым(35%) буферами.
Буферные системы начинают действовать сразу же при увеличении или снижении [H+], и следовательно, представляют собой первую мобильную и действенную систему компенсации сдвигов рН. Например, буферы крови способны устранить умеренные сдвиги КЩР в течение 10–40 с. Ёмкость и эффективность буферных систем крови весьма высока.
Принцип действия химических буферных систем заключается в трансформации сильных кислот и сильных оснований в слабые. Эти реакции реализуются как внутри так и внеклеточно (в крови, межклеточной, спинномозговой и других жидких средах), но в наибольшем масштабе — в клетках.
В поддержке КЩР организма принимают участие почки, легкие, кожа и ЖКТ. Ацидоз и алкалоз являются двумя пограничными состояниями недостаточности и нарушения КЩР.
1. 2. 1. Бикарбонатная буферная система.
Она работает в крови. Бикарбонатная буферная система состоит из слабой кислоты и соли сильного основания, соотношение Н2СО3 /NаНСО3 составляет 1/20.
Емкость бикарбонатной буферной системы составляет 53% всей буферной емкости
крови. При этом на бикарбонат плазмы приходится 35% и на бикарбонат эритроцитов
18% буферной емкости.
Так, при ацидозе: H+ NaHCO3-> Na + H2CO3 H2CO3-> H2O+CO2
При алкалозе: OH+H2CO3+Na+ -> NaHCO3+ H2O
Бикарбонатная буферная система используется как важный диагностический показатель состояния КЩР организма в целом.
1. 2. 2. Фосфатная буферная система.
Фосфатная буферная система играет существенную роль в регуляции КЩР внутри клеток, особенно — канальцев почек. Это обусловлено более высокой концентрацией фосфатов в клетках в сравнении с внеклеточной жидкостью (около 8% общей буферной ёмкости). Фосфатный буфер состоит из двух компонентов: щелочного — (Na2HPO4) и кислого — (NaH2PO4).
Эпителий канальцев почек содержит компоненты буфера в максимальной концентрации, что обеспечивает его высокую мощность. В крови фосфатный буфер способствует поддержанию («регенерации») гидрокарбонатной буферной системы. При увеличении уровня кислот в плазме крови (содержащей и, икарбонатный, и фосфатный буфер) увеличивается концентрация H2CO3 и уменьшается содержание NaHCO3: в норме отношение ¼ = NaH2PO4 / Na2HPO4
Для ацидоза характерно: H+ + Na2HPO4 -> Na+ + NaH2PO4 -> в мочу
Для алкалоза характерно: NaOH + NaH2PO4-> H2O+Na2HPO4 -> в мочу
Поэтому при ацидозе и алкалозе оценка кислотности и щелочности определяется по анализу мочи: увеличивается при ацидозе и уменьшается при алкалозе.
1. 2. 3. Белковая буферная система.
Белковая буферная система — главный внутриклеточный буфер. Он составляет примерно три четверти буферной ёмкости внутриклеточной жидкости. Белок обладает свойством амфотерности, т. е. может выступать в роли слабой кислоты или слабого основания.
Компонентами белкового буфера являются слабодиссоциирующий белок с кислыми свойствами (белокCOOH) и соли сильного основания (белокCOONa). При нарастании уровня кислот они взаимодействуют с солью белка с образованием нейтральной соли и слабой кислоты. При увеличении концентрации оснований реакция их происходит с белком с кислыми свойствами. В результате вместо сильного основания образуется слабоосновная соль.
Белки содержат много ионизируемых групп, которые могут высвобождать или связывать Н+. Большое количество протеиновых буферов локализовано в клетках, ионы Н+ и СО2 диффундируют через клеточные мембраны для буферирования внутриклеточными белками. Альбумин и глобулины плазмы являются основными протеиновыми буферами в
сосудистом секторе.
Буферные свойства белков плазмы (альбумина и др. ) и гемоглобина эритроцитов связаны с тем, что входящие в их состав аминокислоты содержат как кислые (–СООН), так и основные (–NН2) группы и могут диссоциировать с образованием как водородных, так и гидроксильных ионов в зависимости от реакции среды. Большая часть буферной
емкости белковой системы приходится на долю гемоглобинa.
Синтез белков происходит в печени, поэтому патологии белкового буфера связаны с проблемами печени.
1. 2. 4. Гемоглобиновый буфер.
Гемоглобиновая буферная система — наиболее ёмкий буфер крови — составляет более половины всей её буферной ёмкости. Гемоглобиновый буфер состоит из кислого компонента — оксигенированного Hb — HbO2 и основного — неоксигенированного. HbO2 примерно в 80 раз сильнее диссоциирует с отдачей в среду H+, чем Hb. Соответственно, он больше связывает катионов, главным образом K+.
Основная роль гемоглобиновой буферной системы заключается в её участии в транспорте CO2 от тканей к лёгким.
В капиллярах большого круга кровообращения HbO2 отдаёт кислород. В эритроцитах CO2 взаимодействует с H2O и образуется H2CO3. Эта кислота диссоциирует на HCO3– и H+, который соединяется с Hb. Анионы HCO3– из эритроцитов выходят в плазму крови, а в эритроциты поступает эквивалентное количество анионов Cl–. Остающиеся в плазме крови ионы Na+ взаимодействуют с HCO 3– и благодаря этому восстанавливают её щелочной резерв.
В капиллярах лёгких, в условиях низкого pСО2 и высокого pО2, Hb присоединяет кислород с образованием HbO2. Карбаминовая связь разрывается, в связи с чем высвобождается CO2. При этом, HCO3– из плазмы крови поступает в эритроциты (в обмен на ионы Cl–) и взаимодействует с H+, отщепившимся от Hb в момент его оксигенации. Образующаяся H2CO3 под влиянием карбоангидразы расщепляется на CO2 и H2O. CO2 диффундирует в альвеолы и выводится из организма.
1. 3. Компенсационные механизмы КЩР.
Наряду с мощными и быстродействующими буферными системами в организме функционируют органные механизмы компенсации и устранения сдвигов КЩР. Для их реализации и достижения необходимого эффекта требуется больше времени — от нескольких минут до нескольких часов. К наиболее эффективным физиологическим механизмам регуляции КЩР относят процессы, протекающие в лёгких, почках, печени и ЖКТ.
1. 3. 1 Лёгкие
Лёгкие обеспечивают устранение или уменьшение сдвигов КЩР путём изменения объёма альвеолярной вентиляции. Это достаточно мобильный механизм — уже через 1–2 мин после изменения объёма альвеолярной вентиляции компенсируются или устраняются сдвиги КЩР. Причиной изменения объёма дыхания является прямое или рефлекторное изменение возбудимости нейронов дыхательного центра.
Снижение рН в жидкостях организма (плазма крови, СМЖ) является специфическим рефлекторным стимулом увеличения частоты и глубины дыхательных движений. Вследствие этого лёгкие выделяют избыток CO2 (образующийся при диссоциации угольной кислоты). В результате содержание H+ (HCO3– + H+ = H2CO3 ® H2O + CO2) в плазме крови и других жидкостях организма снижается.
Повышение рН в жидких средах организма снижает возбудимость инспираторных нейронов дыхательного центра. Это приводит к уменьшению альвеолярной вентиляции и выведению из организма CO2, т. е. к гиперкапнии. В связи с этим в жидких средах организма возрастает уровень угольной кислоты, диссоциирующей с образованием H+, — показатель рН снижается. Следовательно, система внешнего дыхания довольно быстро (в течение нескольких минут) способна устранить или уменьшить сдвиги рН и предотвратить развитие ацидоза или алкалоза: увеличение вентиляции лёгких в два раза повышает рН крови примерно на 0, 2; снижение вентиляции на 25% может уменьшить рН на 0, 3-0, 4.
1. 3. 2 Почки
К главным механизмам уменьшения или устранения сдвигов КЩР крови, реализуемых нефронами почек, относят ацидогенез, аммониогенез, секрецию фосфатов и K+, Na+обменный механизм. Ацидогенез (способность почек связывать и выводить кислые ионы) - энергозависимый процесс, протекающий в эпителии дистальных отделов нефрона и собирательных трубочек. Он обеспечивает секрецию в просвет канальцев H+ в обмен на реабсорбируемый Na+.
Количество секретируемого H+ эквивалентно его количеству, попадающему в кровь с нелетучими кислотами и H2CO3. Реабсорбированный из просвета канальцев в плазму крови Na+ участвует в регенерации плазменной бикарбонатной буферной системы.
Аммониегенез (способность почек связывать и выводить ионы аммония), как и ацидогенез, реализует эпителий канальцев нефрона и собирательных трубочек. Аммониегенез осуществляется путём окислительного дезаминирования аминокислот. Образующийся при этом аммиак диффундирует в просвет канальцев. Там NH3+ присоединяет ион H+ с образованием иона аммония (NH4+). Ионы NH4+ замещают Na+ в солях и выделяются преимущественно в виде NH4Cl и (NH4)2SO4. В кровь при этом поступает эквивалентное количество бикарбоната натрия, обеспечивающего регенерацию бикарбонатной буферной системы.
Секреция фосфатов осуществляется эпителием дистальных канальцев при участии фосфатной буферной системы:
Na2HPO4 + H2CO3 Û NaH2PO4 + NaHCO3
Образующийся гидрокарбонат натрия реабсорбируется в кровь и поддерживает гидрокарбонатный буфер, а NaH2PO4 выводится из организма с мочой. Таким образом, секреция H+ эпителием канальцев при реализации трёх описанных выше механизмов (ацидогенеза, аммониогенеза, секреции фосфатов) сопряжена с образованием бикарбоната и поступлением его в плазму крови. Это обеспечивает постоянное поддержание одной из наиболее важных, ёмких и мобильных буферных систем — бикарбонатной и как следствие — эффективное устранение или уменьшение опасных для организма сдвигов КЩР.
К+, Na+обменный механизм, реализуемый в дистальных отделах нефрона и начальных участках собирательных трубочек, обеспечивает обмен Na+ первичной мочи на K+, выводящийся в неё эпителиальными клетками. Реабсорбированный Na+ в жидких средах организма участвует в регенерации бикарбонатной буферной системы. K+, Na+обмен контролируется альдостероном. Кроме того, альдостерон регулирует (увеличивает) объём секреции и экскреции H+. Таким образом, почечные механизмы устранения или уменьшения сдвигов КЩР осуществляются путём экскреции H+ и восстановления резерва бикарбонатной буферной системы в жидких средах организма.
1. 3. 3 Печень
Печень играет существенную роль в компенсации сдвигов КЩР. В ней действуют, с одной стороны, общие внутри и внеклеточные буферные системы (бикарбонатная, белковая и др. ), с другой стороны, в гепатоцитах осуществляются различные реакции метаболизма, имеющие прямое отношение к устранению расстройств КЩР. Синтез белков крови, входящих в белковую буферную систему. В печени образуются все альбумины, а также фибриноген, протромбин, проконвертин, проакцелерин, гепарин, ряд глобулинов и ферментов.
Компенсаторные механизмы в печени:
- образование мочевины из аммиака (орнитиновый цикл) – обезвреживание организма
- образование глутамина из аммиака (первый этап аммониогенеза)
- связывание токсичных продуктов с помощью парных серных глюкороновых кислот
- глюконеогенез (образование глюкозы из молочной кислоты)
- синтез белков (белкового буфера).
В печени происходит экскреция в кишечник кислых и основных веществ с жёлчью.
1. 3. 4. Желудок и кишечник
Желудок участвует в демпфировании сдвигов КЩР, главным образом, путём изменения секреции соляной кислоты: при защелачивании жидких сред организма этот процесс тормозится, а при закислении — усиливается. Кишечник способствует уменьшению или устранению сдвигов КЩР посредством:
- секреции кишечного сока, содержащего большое количество гидрокарбоната. При этом в плазму крови поступает H+.
- изменения количества всасываемой жидкости. Это способствует нормализации водного и электролитного баланса в клетках, во внеклеточной и других биологических жидкостях и как следствие —нормализации рН.
- реабсорбции компонентов буферных систем (Na+, K+, Ca2+, Cl–, HCO3–).
Поджелудочная железа способствует компенсации сдвигов КЩР при помощи гидрокарбоната. Его секреция увеличивается при алкалозах и уменьшается в условиях ацидоза.
1. 4. Показатели КЩР.
1. 4. 1. Кровяные показатели.
Кислотно-щелочное равновесие является одним из важнейших показателей гомеостаза. Оно оценивается на основании величин^
- pH крови (7, 35-7, 45),
- концентрации истинных (актуальных) и стандартных бикарбонатов крови (SB) (содержание NaHCO3 в альвеолярной крови),
- концентрации буферных оснований — BB (англ. buffer base) (количества оснований, которые необходимо добавить или удалить для того, чтобы pH вернулась к норме),
- избытка оснований в цельной крови — BE (англ. bases excess)(сумма буферных анионов).
Последние три показателя, в отличие от первого, меняются однонаправленно, и показывают, в какую сторону изменяется процесс КЩР в организме.
1. 4. 2. Альвеолярные показатели.
- РСО2 – напряжение СО2 в крови.
- Альвеолярное РСО2 – содержание СО2 в альвеолярном воздухе.
Используются для оценки респираторных ацидозов и алкалозов.
1. 4. 3. Мочевые показатели.
- ТК – (титрационная кислотность мочи) показатель работы фосфатного буфера.
- NH4+ мочи – показатель процесса аммониогенеза.
Используются для оценки ацидоза и аммониогенеза.
Глава 2. Нарушения КЩР.
Сдвиги КЩР обусловлены изменением концентрации ионов водорода в организме. Недостаточность резервных возможностей вызывает одно из двух противоположных состояний организма - ацидоз или алкалоз. Ацидоз – изменение КЩР, при котором в крови появляется абсолютный или относительный избыток кислот. Алкалоз – изменение КЩР, характеризующееся абсолютным или относительным увеличением оснований в крови. Степень выраженности как ацидоза, так и алкалоза может быть различной и определяется величиной рН.
Ацидозы и алкалозы бывают компенсированные (рН в пределах нормы) и декомпенсированные (ацидоз рН < 7, 35, алкалоз рН > 7. 45).
Компенсированными сдвигами КЩР считаются такие, при которых рН крови не отклоняется за пределы диапазона нормы: 7, 35–7, 45. За «нейтральную» величину условно принимают 7, 39. Отклонения рН в диапазонах:
7, 38–7, 35 — компенсированный ацидоз,
7, 40–7, 45 — компенсированный алкалоз.
При компенсированных формах нарушений КЩР возможны изменения абсолютной концентрации компонентов гидрокарбонатной буферной системы (H2CO3 и NaHCO3). Однако, соотношение [Н2CO3]/[NaHCO3] сохраняется в диапазоне нормы (т. е. 20/1 ).
Декомпенсированными нарушениями КЩР называют такие, при которых рН крови выходит за диапазон нормы:
При рН 7, 34 и ниже — некомпенсированный ацидоз.
При рН 7, 46 и выше — некомпенсированный алкалоз.
Декомпенсированные ацидозы и алкалозы характеризуются значительными отклонениями как абсолютной концентрации H2CO3 и NaHCO3, так и их соотношения.
По типам они подразделяются на нереспираторные (метаболические, выделительные, экззогенные) и респираторные ацидозы и алкалозы.
С учетом этой информации медицинскими работниками вырабатываются принципы коррекции нарушений КЩР.
2. 1. Респираторный ацидоз.
Причины:
- любая бронхолегочная патология, ведущая к гиповентиляции (отек легких, пневмония, эмфизема, ателектаз, БА и др.;
- увеличение концентрации СО2 во вдыхаемом воздухе (нахождение в замкнутом пространстве, неправильно отрегулированный аппарат ИВЛ);
- отравление лекарственными препаратами, барбитуратами и др. (блокада дыхательного центра).
Лабораторные показатели респираторного ацидоза:
- рН крови снижен;
- РаСО2 повышено;
- SB (стандартный бикарбонат) повышен;
- BE (дефицит/избыток буферных оснований) – повышен;
- Альвеолярный СО2- повышен;
- ТК – повышен.
- NH4+ - повышен.
Патологией проявления респираторного ацидоза является то, что он рождает гемодинамические проблемы организма: спазмы сосудов, ишемию органов, повышениедавления, артериальную гиперемию, повышение ВЧД.
Компенсаторные реакции организма при респираторном ацидозе проявляются реакцией буферных систем, направленных на связывание ионов Н+. Они также приводят к выведению ионов Н+ путем:
- ацидогенеза
- аммониогенеза
- выделения NaH2PO4
- секреции Н+ в обмен на Na+.
Патологические проявления при респираторном ацидозе включают в себя:
- наращивание микроциркуляции
- спазм артериол и ишемию органов
- усиление гипоксии и гипоксемии
- усиление вагусных влияний и бронхиолоспазм
- увеличение кровенаполнения мозга и ВЧД
- ионный дисбаланс
- гиперкалиемия
- гиперфосфатемия
- гипохлоремия.
Типовые нарушения кровотока приводят к смешанным вариантам ацидоза, усилению проблем вентиляции легких, проблемам ВЭБ, усилению гипоксии и гипоксемии.
Лечение респираторного ацидоза этиотропное. Оно включает в себя лечение признаков дыхательной недостаточности и устранение гиперкапнии.
2. 2. Нереспираторный ацидоз.
Причины нереспираторных ацидозов.
- Метаболических:
- любая патология сердца и сосудов;
- патология печени;
- СД;
- голодание (вторая стадия);
- обширное воспаление;
- тяжелая физическая работа;
* Экзогенных:
- поступление кислоты извне;
- суицидные попытки;
- в/в введение Vit C более 40 мл.
* Выделительный:
- диарея;
- кишечные свищи;
- ХПН.
Метаболические ацидозы относятся к самой обширной группе заболеваний.
Компенсаторные реакции организма при метаболическом ацидозе проявляются активизацией гидрокарбонатного буфера, направленной на связывание Н+ ионов, активизацией клеточных и внеклеточных буферных систем, усиление альвеолной вентиляции, усиление биохимических процессов, направленных на выведение Н+ ионов.
Патологические проявления при метаболическом ацидозе включают в себя:

Вследствие хронического нарушения функции почек также возникает метаболический ацидоз. Язвенная болезнь желудка, сопровождающаяся рвотой, гепатитом, панкреатитом, колитом, осложняется метаболическим ацидозом; стеноз привратника — метаболическим алкалозом в связи с гипохлоремией; кишечная непроходимость — тканевым ацидозом в результате распада белков, потери натрия и обезвоживания; высоко расположенные наружные свищи — метаболическим алкалозом (потеря хлоридов), низко расположенные — метаболическим ацидозом (потеря щелочей). Сахарный диабет характеризуется диабетическим метаболическим ацидозом: в крови определяются кетоновые тела, а в моче — ацетон.
Метаболический ацидоз — самая частая и тяжелая форма нарушений КЩР.
Различают три вида выделительных ацидозов.
• Почечный выделительный ацидоз (накопление в организме кислот, потеря оснований) возникает вследствие почечной недостаточности, интоксикации сульфаниламидами, гипоксии ткани почек.
• Кишечный выделительный ацидоз (потеря организмом оснований) развивается вследствие диареи, фистулы или открытой раны тонкого кишечника.
• Гиперсаливационный выделительный ацидоз (потеря организмом оснований) связан со стоматитами, токсикозом беременных, гельминтозами, отравлением никотином или препаратами ртути.
Экзогенный ацидоз является следствием поступления в организм соединений с кислыми свойствами.
• Причины:
♦ Приём растворов нелетучих кислот (например, соляной, серной, азотной) по ошибке, либо с целью отравления.
♦ Продолжительное употребление продуктов питания и питья, содержащих большое количество кислот (например, лимонной, яблочной, соляной, салициловой).
♦ Применение ЛС, содержащих кислоты или их соли (например, ацетилсалициловой кислоты).
♦ Трансфузия препаратов донорской крови, консервированной лимоннокислым натрием.
• Механизмы развития:
♦ Диссоциация экзогенных кислот и их солей ведёт к увеличению концентрации H+ в организме и быстрому истощению буферных систем.
♦ Нарушения обмена веществ под влиянием экзогенных кислот сопровождаются накоплением эндогенных кислых метаболитов.
♦ Повреждение печени и почек потенцирует степень ацидоза.
2. 3. Алкалозы.
Алкалоз – (от араб. al-gili – щелочь) – нарушение кислотно-щелочного равновесия,
характеризующееся сдвигом соотношения между анионами кислот и катионами. Алкалоз – состояние, противоположное ацидозу, поэтому его классификация имеет такую же градацию, а показатели противоположны.
2. 3. 1. Респираторный алкалоз.
Респираторный алкалоз возникает при вдыхании чистого кислорода, компенсаторной одышке, сопровождающей ряд заболеваний, пребывании в разряженной атмосфере. При ареспираторном алкалозе в крови уменьшается концентрация растворенного СО2 и гидрокарбонат-ионов (щелочной резерв крови).
Лабораторные показатели респираторного алкалоза:
- рН крови в пределах нормы тили снижен;
- РаСО2 снижен;
- SB (стандартный бикарбонат) повышен;
- BE (дефицит/избыток буферных оснований) – повышен;
- Альвеолярный СО2- повышен;
- ТК – снижена.
- NH4+ - снижен.
Возникновение респираторного алкалоза обусловлено первичной гипервентиляцией, которая может возникнуть вследствие прямой стимуляции дыхательного центра, при поражении головного мозга, истерии и отравлении салицилатами. Рефлекторная стимуляция дыхательного центра возникает, например, вследствие сильного раздражения хеморецепторов при горной, или высотной. болезни, когда вследствие гипоксии происходит раздражение рецепторного аппарата сосудов и возникает компенсаторная гипервентиляция, снижение Рс02 в артериальной крови. Развитие гипервентиляции может также наблюдаться при использовании аппарата искусственного дыхания, а также при некоторых инфекционных токсикозах.
Ведущим признаком респираторного алкалоза является уменьшение РСО2, ниже 35 мм рт. ст. и соответствующее снижение концентрации ионов Н+.
При респираторном алкалозе вовлекаются как быстрые, так и медленные механизмы компенсации.
Быстрый гемический механизм является малоэффективным, гак как буферная емкость бикарбонатной системы при щелочном значении pH довольно низкая. Более значительная роль в компенсации принадлежит легочному механизму. Его роль заключается в торможении возбудимости дыхательного центра, что вызывает уменьшение частоты и глубины дыхания, в результате задерживается углекислый газ. Однако из-за защелачивания нарушается диссоциация оксигемоглобина, уменьшается кислородное обеспечение организма с развитием гипоксии, которая в свою очередь влечет за собой развитие внутриклеточного ацидотического сдвига.
Механизм почечной, медленной компенсации заключается в том, что уменьшение РС02 крови при газовом алкалозе вызывает снижение образования Н2СО3, что приводит к диссоциации NaHCO3 в плазме крови. Снижение образования Н2СО3 приводит к уменьшению секреции ионов Н+ эпителием почечного канальца.
Чем меньше эта секреция, тем слабее реабсорбируется Na+ и меньше поступает в кровь ионов НС03. Вследствие этого происходит увеличение выделения NaHC03 и Na2HP04, что и вызывает компенсаторный сдвиг мочи в щелочную сторону и уменьшение содержания оснований в плазме крови. При респираторном алкалозе уменьшение РСО2 усиливает переход ионов С1~ из эритроцитов в плазму, что частично компенсирует снижение содержания анионов в плазме крови.
Таким образом, первичным при респираторном алкалозе является уменьшение РСО2. а вторичным — компенсаторное уменьшение концентрации оснований в крови.
К патологическим эффектам респираторного алкалоза при декомпенсированной его форме относится повышение тонуса сосудов головного мозга и сердца и уменьшение тонуса периферических сосудов, что приводит к гипотензии. Указанные сосудистые изменения при тяжелом алкалозе могут привести к коллапсу.
Избыточное выведение из организма оснований в виде натриевых, калиевых солей приводит к обезвоживанию организма, что вызывает резкие нарушения обменных процессов. Уменьшение содержания ионов Н— вызывает снижение концентрации ионизированного кальция, что в свою очередь приводит к повышению нервно-мышечной возбудимости вплоть до явления тетании. Кроле того, для алкалоза характерно увеличение сродства гемоглобина к кислороду, что приводит к гипоксии, в первую очередь ткани мозга.
2. 3. 2. Нереспираторный алкалоз.
Причины нереспираторных алкалозов:
- Метаболический
- синдром Конна;
- болезнь Иценко-Кушинга;
- вторичный гиперальдостеронизм;
- Выделительный
- рвота
- свищи желудка
- запоры
- Экзогенный
- употребление большого количества щелочных продуктов.
Для нереспираторного алкалоза характерно смещение соотношения между кислотными анионами и катионами оснований крови в сторону увеличения катионов. Бикарбонат плазмы поднимается выше 26 ммоль/л, а рН поднимается выше 7, 45. Метаболический алкалоз возникает в результате либо чрезмерной потери кислот, в основном хлора в составе HC1, и калия из внеклеточной жидкости организма (затем возникают гипокалиемические, гипохлоремические алкалозы), либо из-за избыточного потребления солей щелочных металлов. - вводят бикарбонаты и т. д. натриевые соли, например NaHCO3, тогда такой алкалоз, как правило, является гипернатриемическим.
Потеря хлора часто возникает при рвоте, особенно неукротимой рвоте у беременных, при желудочных свищах, повторном промывании желудка. Гипокалиемия при метаболическом алкалозе часто сопровождается гипохлоремией. Однако потеря калия может быть основной причиной нарушения CBS, например, при использовании диуретиков, после обширных хирургических вмешательств, гемолиза и других состояний. Метаболический алкалоз также развивается при снижении функций околощитовидной железы.
Компенсаторные механизмы, которые развиваются при алкалозе, заключаются в основном в снижении возбудимости дыхательного центра за счет повышения рН, а также в мобилизации почечных механизмов. Эффективность буферных систем крови при алкалозе менее выражена, чем при ацидозе. Уменьшение минутного объема дыхания приводит к компенсаторному увеличению РСО2 в крови, что вызывает образование большого количества углекислоты, являющейся источником ионов H +.
Характер механизмов почечной компенсации зависит от особенностей нарушения электролитного обмена при алкалозе. Так, при гипохлоремической форме алкалоза экскреция натрия и калия почками усиливается, а при гипернатриемии из-за выделения большого количества бикарбонатов натрия наблюдается увеличение экскреции с мочой NaHCO3 из-за уменьшения его реабсорбция в почечных канальцах. Механизм этого процесса заключается в том, что при алкалозе секреция ионов водорода в просвете почечных канальцев уменьшается, и поэтому первичная моча подщелачивается, что снижает реабсорбцию бикарбоната.
Алкалоз характеризуется увеличением сродства гемоглобина к кислороду, что вызывает недостаточное снабжение тканей кислородом с характерным нарушением окислительно-восстановительных процессов и добавлением внутриклеточного метаболического ацидоза. В свою очередь, в капиллярах легочного кровообращения наблюдается максимальное насыщение гемоглобина кислородом, использование которого, однако, из артериальной крови уменьшается, а следовательно, уменьшается артериовенозная разница кислорода и развивается гипоксия головного мозга.
Существует три вида выделительных алкалозов.
• Желудочный выделительный алкалоз развивается вследствие потери организмом HCl при рвоте желудочным содержимым (например, при токсикозе беременных, пилороспазме, пилоростенозе, кишечной непроходимости) или отсасывании его через зонд.
• Почечные (ренальные) выделительные алкалозы обусловлены выведением из организма Na+ и задержкой гидрокарбоната почками.
♦ Торможение реабсорбции Na+ и воды под влиянием диуретиков (например, фуросемида) приводит к выведению из организма Na+, а вместе с ним и Cl- в повышенном количестве, а содержание щелочных анионов гидрокарбоната в плазме крови возрастает.
♦ Наличие в клубочковом фильтрате почек плохо реабсорбируемых ионов (анионов нитрата, сульфата, продуктов метаболизма пенициллина). Накопление плохо реабсорбируемых анионов в первичной моче сопровождается усилением экскреции почками К+ и H+ и реабсорбции HCO3-.
• Кишечный (энтеральный) выделительный алкалоз развивается вследствие повышенного выделения из организма К+кишечником (например, при злоупотреблении слабительными), что стимулирует транспорт в клетки H+ из межклеточной жидкости и плазмы крови, где развивается алкалоз.
Экзогенный алкалоз - сравнительно редкое нарушение КЩР - является, как правило, следствием попадания в организм избытка гидрокарбоната либо щелочей.
• Причины:
♦ Введение в течение короткого времени избытка HCO3--содержащих растворов (например, при коррекции лактатацидоза или кетоацидоза у пациентов с СД).
♦ Продолжительное использование продуктов питания и питья, содержащих большое количество щелочей. Наблюдается у пациентов с язвенной болезнью желудка, принимающих в больших количествах щелочные растворы и молоко.
• Механизм развития. Основное звено патогенеза экзогенного алкалоза - увеличение концентрации HCO3- в плазме крови.
Часто у пациента может быть больше одного нарушения КЩР (сочетанные нарушения), проявления которых зависят от тяжести отдельных нарушений и их специфики. Наличие однонаправленных нарушений (комбинированные) увеличивает вероятность изменений рН до опасной для жизни величины, тогда как раз разнонаправленные отклонения (смешанные), оказывают взаимнокомпенсирующее воздействие, что зачастую делает возможным поддержание концентрации ионов водорода в пределах физиологической нормы.
Заключение.
Анализ кислотно-щелочного равновесия является неотъемлемой частью быстрой оценки тяжести состояния пациента при различных патологиях. Поэтому абсолютно оправдано внедрение в клиническую практику анализа кислотно-основного равновесия и газового состава крови.
Расстройства КЩР — это нарушения физико-химического гомеостаза. КЩР определяется соотношением ионов Н+ и ОН–, влияющим на активность ферментов, интенсивность метаболических процессов, функции ряда органов, чувствительность рецепторов к медиаторам, проницаемость клеточных мембран. Расстройства КЩР сопровождают практически все заболевания, поэтому аналогично другим видам нарушений обмена веществ относятся к типовым патологическим процессам, которые особенно важно знать молодому специалисту-медику.
Приложение.
Схема 1. Классификация нарушений КЩР.
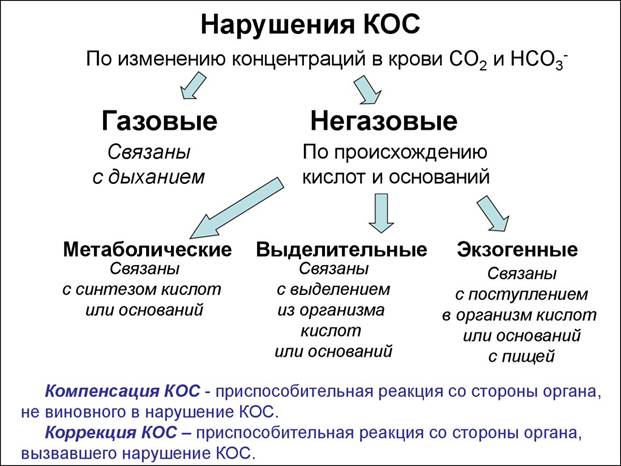
Схема 2. Виды нарушений КЩР (ацидозы, алкалозы)
Список литературы:
1. Моррисон В. В., Чеснокова Н. П., Бизенкова М. Н. Кислотно-основное состояние. Типовые нарушения кислотно-основного состояния // Международный журнал прикладных и фундаментальных исследований. – 2015. – № 3-2. – С. 273-278;
URL: https: //applied-research. ru/ru/article/view? id=6530 (дата обращения: 18. 11. 2022).
2. Цыган В. Н, Литвицкий П. Ф. , Дергунов А. В. - Патофизиология. Клиническая патофизиология. Учебник в 2-х томах. Том 1
3. Горн М. М., Хейтц У. И., Сверинген П. Л., Вебер К. С. Водно-электролитный и кислотно-основной баланс. М., Просвещение/Бином, 2017 г.
4. Порядина, Г. В. Патофизиология: курс лекций: учебное пособие / под ред. Г. В. Порядина - Москва: ГЭОТАР-Медиа, 2018. - 688 с.
5. Патофизиология [Электронный ресурс] / Новицкий В. В., Уразова О. И. - М.: ГЭОТАР-Медиа, 2018. Режим доступа: http: //www. studentlibrary. ru/book/ISBN9785970439951. html
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|