
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Задание по пат.физиологии от 25.05.2020
Задание по пат. физиологии от 25. 05. 2020
Кожевникова Екатерина 6201
Задание 1. Характеристика анаболических эффектов Соматотропного гормона, инсулина (желательно схемой).
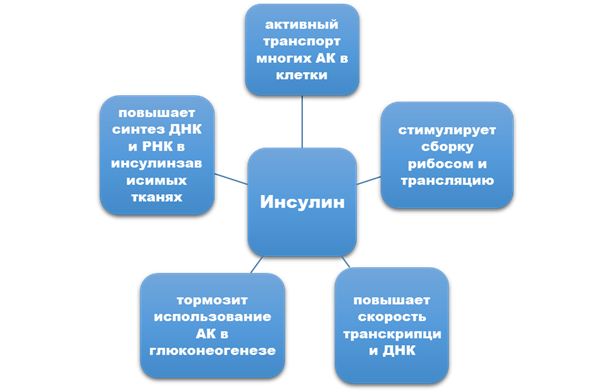
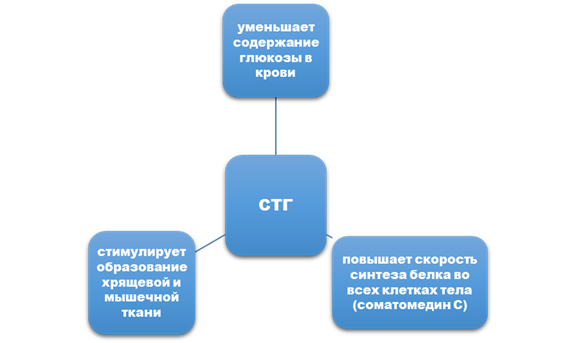
Задание 2. Особенности влияния на белковый обмен глюкокортикоидов, гормонов щитовидной железы (желательно схемой).
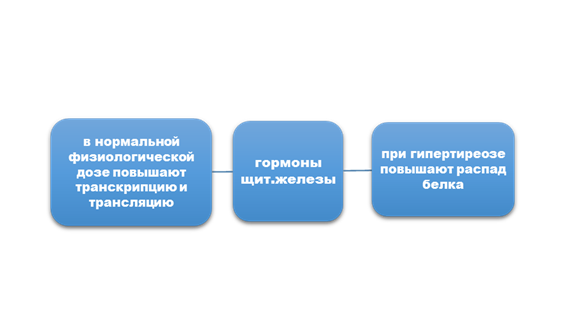
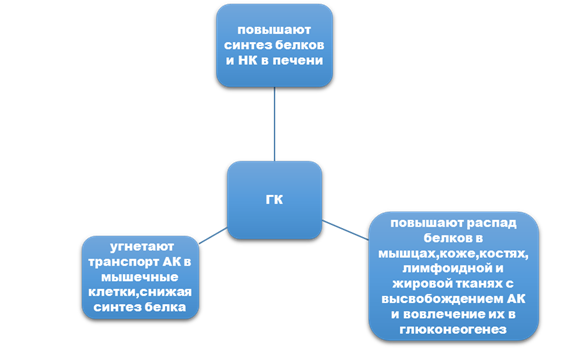
Задание 3
1. Соляная кислота необходима для активации:
а) пепсина;
б) амилазы;
в) липазы;
г) транскетолазы.
Соляная кислота в просвете желудка активирует пепсиноген ( предшественник пепсина). В кислой среде в результате гидролиза пептидной связи между Лейц44-Иле45, от N-концевого участка цепи песпиногена отщепляется ингибирующий белковый комплекс и образуется активный пепсин.
2. Секрецию поджелудочного сока усиливают:
а) соматостатин;
б) гастрин;
в) холецистокинин;
г) йодтиронины;
Холецистокинин-панкреозимин стимулирует опорожнение желчного пузыря и секрецию поджелудочного сока, богатого ферментами.
Гастрин усиливает секрецию желудка (HCL), усиливает моторику желудка и тонкого кишечника. Гастрин увеличивает секрецию секретина, холецистокинина, соматостатина и ряда других гормонально активных кишечных и панкреатических пептидов, а также секрецию кишечных и панкреатических ферментов. Тем самым гастрин создаёт условия для осуществления следующей, кишечной, фазы пищеварения.
3. Состав панкреатического сока входит:
а) трипсиноген;
б) гексокиназа;
в) фосфолипаза;
г) дипептидаза.
Панкреотический сок содержит протеолитические ферменты- трипсин, хемотрипсин, пептидазы, карбоксипетидазы А и Б, липолитические – липазу и фосфолипазу, амолитические – а-амилазу, мальтазу, лактазу. Трипсин и хемотрипсин выделяются в неактивной форме- в виде зимогенов трипсиногена и хемотрипсиногена, которые активируются ферментом кишечного сока – энтерокиназой.
4. Для активации пептидаз в кишечнике необходимым условием является:
а) кислая среда;
б) желчные кислоты;
в) выделение воды;
г) действие трипсина.
Полипептиды, образовавшиеся в результате действия на белки пепсина, а затем трипсина и химотрипсина, подвергаются дальнейшему расщеплению в кишечнике, которое осуществляется под влиянием пептидаз. Как трипсин и химотрипсин пептидазы выделяются железистыми клетками слизистой тонкой кишки в недеятельной или малоактивной форме. Активация их происходит под действием трипсина.
5. Активация секреции желудочного сока, богатого ферментами, происходит под влиянием:
а) инсулина;
б) СТГ;
в) гастрина;
г) энтерогастрона
Гастрин усиливает секрецию желудочного сока, усиливает моторику желудка и тонкого кишечника.
6. Биологическая ценность пищевых белков обусловлена:
а) наличием углеводов;
б) наличием незаменимых аминокислот;
в) наличием витаминов;
г) наличием в молекуле аминокислот атомов серы, кислорода, углерода.
Незаменимые аминокислоты не синтезируются в организме и должны поступать с пищей.
7. При отсутствии соляной кислоты переваривание белков в желудке:
а) не происходит;
б) усиливается;
в) скорость переваривания не изменяется;
г) происходит денатурация белков.
Соляная кислота необходима для активации пепсиногена из которого образуется активный пепсин, расщепляющий белок.
8. В кишечнике всасываются:
а) олигопептиды;
б) аминокислоты;
в) полипептиды;
г) белки.
Белки денатурируются в желудке под действием соляной кислоты и становятся более чувствительными к атаке эндопептидазами желудочного сока и секрета поджелудочной железы. Образующиеся при этом пептиды расщепляются далее до аминокислот находящимися в кишечнике экзопептидазами. Затем аминокислоты всасываются слизистой кишечника с одновременным поглощением ионов Na+. Для отдельных групп аминокислот существуют соответствующие общие транспортные системы.
9. Реакции декарбоксилирования:
а) служат источником биогенных аминов;
б) дают исходные вещества для получения энергии;
в) необходимы для синтеза некоторых витаминов;
г) участвуют в синтезе гликогена.
Декарбоксилирование – один из путей метаболизма АК. Отщепление от АК а-карбоксильной группы ведет к образованию СО2 и биогенных аминов.
10. Для образование заменимых аминокислот из кетокислот необходимы ферменты:
а) липазы;
б) аминотрансферазы;
в) изомеразы;
г) синтетазы.
Аминотрансферазы (трансаминазы) — ферменты из группы трансфераз, катализирующие перенос аминогрупп от аминокислот на кетокислоты без образования свободного аммиака.
11. Для того, чтобы окислить аминокислоту до углекислого газа и воды, необходимо ее сначала:
а) декарбоксилировать;
б) дезаминировать;
в) изменить радикал;
г) превратить аминокислоту в аминоациладенилат.
При окислительном дезаминировании сначала идет ферментативное дегидрирование глутамата и образование а-иминоглутарата. Далее идет неферментативное гидролитическое отщепление иминогруппы в виде NH3. В р-те образуется а-кетоглутарат, который в последующем расщепляется до CO2 и H2O.
12. Трансаминирование – важнейший процесс аминокислотного обмена, с участием которого происходит:
а) образование субстратов для глюконеогенеза;
б) синтез незаменимых аминокислот;
в) начальный этап катаболизма углеводов;
г) синтез белков в тканях.
При трансаминировании образуются кетокислоты, которые далее могут использоваться для синтеза глюкозы или окисления до CO2 и H2O.
13. Некоторые аминокислоты и их производные декарбоксилируются, при этом образуются вещества, которые могут:
а) использоваться в глюконеогенезе;
б) быть источниками энергии;
в) входить в состав гепарина;
г) выполнять роль нейромедиаторов или тканевых гормонов.
При декарбоксилировании образуются биогенные амины (биологически активные амины). Они являются медиаторами, с помощью которых сигнал передается с одной клетки к другой и от одной молекулы к другой (гистамин).
14. Интенсивный распад тканевых белков наблюдается при введении:
а) тироксина;
б) инсулина;
в) соматотропина;
г) андрогенов.
При введении тироксина его концентрация в организме увеличится, а при повышенной дозе гормонов щитовидной железы наблюдается увеличение распада белков.
15. В ходе переаминирования аминокислоты превращаются:
а) в кетокислоты;
б) в амины;
в) в лактат;
г) в ацетил-КоА.
При трансаминировании происходит перенос аминогруппы на а-кетолазу. В результате образуется новая кетокислота и новая АК.
16. Для нормального протекания реакции декарбоксилирования аминокислот необходимы:
а) глутаматдегидрогеназа;
б) декарбоксилаза;
в) изомераза;
г) витамин В1;
Карбоксилазы или декарбоксилазы — ферменты из класса лиаз, воздействующие на связь углерод-углерод, которые катализируют присоединение или отщепление карбоксильной группы от органических соединений. Эти ферменты катализируют декарбоксилирование аминокислот, бета-кетокислот и альфа-кетокислот.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|