
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
1. ОСНОВНЫЕ ПОНЯТИЯ И УСЛОВИЯ МЕЖФАЗОВОГО
1. ОСНОВНЫЕ ПОНЯТИЯ И УСЛОВИЯ МЕЖФАЗОВОГО
РАВНОВЕСИЯ. ПРАВИЛО ФАЗ
Вещества, образующие термодинамическую систему, могут находиться в различных агрегатных состояниях: газообразном, жидком и твердом.
Термодинамическая система, состоящая из различных по своим свойствам частей, разграниченных поверхностями раздела, называется гетерогенной системой.
Примеры гетерогенных систем:
- смесь двух кристаллических веществ,
- смесь ограниченно растворимых друг в друге жидкостей (вода - бензол, вода - керосин),
- вода - водяной пар,
- сплав Pb - Sn и др.
Термодинамическая система, внутри которой нет поверхностей раздела, отделяющих разные по свойствам части системы, называется гомогенной. Например: смесь газов, раствор, кристаллы чистого вещества, некоторые сплавы (Ag - Au, Pt - Pd).
Для гетерогенных систем характерным является скачкообразное изменение некоторых свойств на границе раздела, например, плотности, коэффициента преломления, теплоемкости и других физико-химических свойств. Скачкообразно может меняться химический состав системы, состоящей из двух ограниченно растворимых жидкостей.
Для описания гетерогенных систем введены следующие понятия:
Физическая составная часть - это каждая гомогенная часть гетерогенной системы, отделенная от остальной части системы поверхностью раздела.
Фаза - это совокупность физических составных частей, имеющих одинаковые химические и термодинамические свойства.
Например, в колбу с дистиллированной водой бросили пять кусочков льда. В этой системе будет семь физических составных частей: 5 твердых, 1 жидкая и 1 газообразная, а фаз - три.
Однако понятия: физическая составная часть и фаза отражают только физическую природу системы, но не характеризуют ее химическую сущность.
Химическая составная часть - это химически индивидуальное вещество, входящее в состав системы, которое может быть выделено из системы в чистом виде и существовать самостоятельно.
Независимые химические составные части, входящие в систему, называются компонентами.
Число компонентов равно числу химических составных частей минус число протекающих между ними реакций. Например, при обжиге известняка (CaCO3) образуется гетерогенная система, состоящая из трех фаз: CaCO3, CaO, CO2, трех химических составных частей, но двух компонентов.
Итак, каждая гетерогенная система состоит из нескольких фаз. Жидкие и твердые фазы называются конденсированными. Равновесие в системе, состоящей из нескольких фаз, называется гетерогенным или фазовым
(Тв1 Û Тв2, Тв Û Ж, Тв Û Г, Ж1 Û Ж2, Ж Û Г).
Если две соприкасающиеся фазы системы содержат один и тот же компонент, то возможен переход этого вещества из одной фазы в другую и наоборот.
Например, в системе (вода - водяной пар) будет происходить испарение молекул H2O с поверхности жидкости и конденсация молекул H2O из паровой фазы. Т. е. перед нами обратимый физико-химический процесс
испарение
жидкость Û пар
конденсация
H2O(ж) Û H2O(г)
В некоторый момент времени скорости прямого и обратного процессов становятся равными и система приходит в состояние динамического равновесия, т. к. любая предоставленная самой себе система с течением времени приходит в состояние равновесия.
Таким образом, сущность межфазового равновесия заключается в наличии двух противоположно направленных процессов, идущих с одинаковыми скоростями и взаимно компенсирующих друг друга.
Достигнутое состояние равновесия системы будет неизменным, если:
1) температура Т во всех точках системы одинакова и не меняется с течением времени, иначе будет происходить выравнивание температуры, и состояние системы будет меняться;
2) давление р во всех частях системы одинаково.
Из химической термодинамики известно условие равновесия, т. е. при достижении равновесия изменение изобарного потенциала dG = 0, и
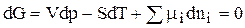 , (1)
, (1)
где mi - химический потенциал;
dni - изменение числа моль вещества.
Соотношение 1 справедливо при dp = 0, т. е. p = const, dT = 0, т. е. Т = const
и 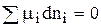 (2)
(2)
Запишем 2 для одного компонента, находящегося в двух фазах
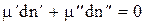 (3)
(3)
Но 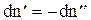 (*), т. е. в состоянии динамического равновесия, сколько моль вещества покинуло одну фазу, столько же пришло во вторую фазу.
(*), т. е. в состоянии динамического равновесия, сколько моль вещества покинуло одну фазу, столько же пришло во вторую фазу.
Подставим *, тогда 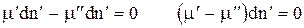 .
.
А это возможно, если
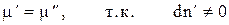 (4)
(4)
Если этот компонент находится в третьей фазе, то условием равновесия во второй и третьей фазе будет 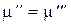 .
.
И тогда для всех трех фаз: 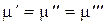 .
.
Если компонент находится в ф фазах, то условием его равновесия в ф фазах будет
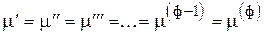 , (5)
, (5)
т. е. всего (ф - 1) уравнений. (“ф - 1” значков “=”)
Правило фаз. (Получим его)
Основной закон фазового равновесия, часто называемый правилом фаз Гиббса, является одним из важных применений второго закона термодинамики к изучению превращений в гетерогенных системах.
Пусть система состоит из ф фаз и содержит К компонентов, которые присутствуют во всех фазах. В равновесной системе температура Т, давление р и химические потенциалы mi каждого компонента i во всех фазах одинаковы (равенство интенсивных параметров во всех фазах).
Состояние каждой фазы определяется температурой, давлением и концентрациями всех компонентов. Концентрации не всех компонентов являются независимыми. Так как концентрации выражают по отношению к общему количеству вещества в каждой фазе (объему, массе, числу моль), то из К компонентов, находящихся в одной фазе, независимыми являются К - 1 концентраций, а концентрация одного компонента будет являться функцией концентраций остальных компонентов. Тогда во всех фазах независимых концентраций будет ф (К - 1).
Поскольку кроме независимых концентраций имеются еще две независимые переменные Р и Т, то общее число независимых переменных, описывающих состояние гетерогенной системы, состоящей из ф фаз и К компонентов будет равно:
ф (К - 1) + 2 (6)
Запишем условие равновесия такой системы, обозначив индексами 1, 2, 3...., К значение химических потенциалов, соответствующих компонентам, а индексами (1), (2), (3).... (ф) принадлежность их к соответствующим фазам т. е. 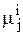 - химический потенциал j - го компонента в i-той фазе, j пробегает значение от 1 до К, а i пробегает значение от 1 до ф.
- химический потенциал j - го компонента в i-той фазе, j пробегает значение от 1 до К, а i пробегает значение от 1 до ф.
1-й компонент 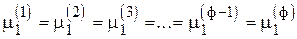 , т. е. (ф - 1) уравнений
, т. е. (ф - 1) уравнений
2-й компонент 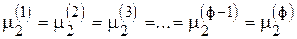 , т. е. (ф - 1) уравнений
, т. е. (ф - 1) уравнений
3-й компонент 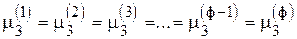 , т. е. (ф - 1) уравнений
, т. е. (ф - 1) уравнений
.............................................................
К-й компонент 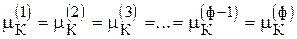 , т. е. (ф - 1) уравнений
, т. е. (ф - 1) уравнений
Всего, К (ф - 1) уравнений.
Таким образом, равновесие гетерогенной системы будет определяться К (ф - 1) уравнениями и двумя тождествами.
Т(1) = Т(2) = Т(3) =. . . = Т(ф - 1) = Т(ф)
р(1) = р(2) = р(3) =. . . = р(ф - 1) = р(ф), т. е. давление и
температура во всех фазах одинаковы при равновесии.
Условием равновесия многокомпонентной многофазной системы является равенство интенсивных параметров во всех фазах.
Условием совместности системы уравнений, т. е. когда система имеет единственное решение или множество решений, является следующее условие:
число уравнений £ число независимых переменных.
Т. е. в нашем случае
К (ф - 1) £ ф (К - 1) + 2
Решая это неравенство, получаем
К - ф + 2 ³ 0 (8)
Знак равенства в 8 соответствует единственному решению системы.
Обозначим через S = К - ф + 2 (9)
число степеней свободы системы, т. е. число независимых переменных (Т, р, с), которые можно одновременно произвольно изменять, а система все равно будет находиться в равновесии.
Выражение 9 известно как правило фаз Гиббса (1876 г. ): число степеней свободы равновесной термодинамической системы, на которую влияют только Т и р, равно числу компонентов системы минус число фаз плюс 2.
Равновесные системы можно классифицировать в зависимости от поставленной задачи:
а) по числу компонентов (К)
существуют: однокомпонентные,
двухкомпонентные,
многокомпонентные системы
б) по числу фаз (ф):
однофазные,
двухфазные, трехфазные,
многофазные
в) по числу степеней свободы (S).
Число степеней свободы характеризует вариантность системы
S = 0 S = 1 S = 2 и т д.
безвариантные одновариантные двухвариантные
нонвариантные моновариантные бивариантные
Число степеней свободы возрастает с увеличением числа компонентов (К) и уменьшается с увеличением числа фаз (ф). Число степеней свободы не может быть отрицательным числом, поэтому число фаз в системе не может быть больше (К + 2), т. е.
ф £ К + 2 (11)
Если состояние системы определяется не только Т и р, но и другими внешними факторами (например электрическим, магнитным полем и другими), то их необходимо учитывать. В общем случае, когда на систему действуют n факторов, правило фаз Гиббса будет записано так:
S = К - ф + n
Если составы двух равновесных фаз одинаковы, то число степеней
свободы уменьшается на единицу.
2. УРАВНЕНИЕ КЛАПЕЙРОНА – КЛАУЗИУСА, ПРИМЕНЕНИЕ ЕГО К ОДНОКОМПОНЕНТНЫМ СИСТЕМАМ
Простейшим типом гетерогенного равновесия является равновесие чистого вещества со своим насыщенным паром. Т. е. равновесие
жидкость Û пар
твердое тело Û пар
Такое равновесие можно изобразить графически:
давление насыщенного пара - температура
 |
Рис. 1. Зависимость давления от температуры.
Давление насыщенного пара - это равновесное давление, которое создается при Т = const некоторым количеством вещества в закрытом сосуде, не содержащем посторонних газов.
Давления насыщенного пара при разных температурах дают кривую испарения.
Давления насыщенного пара над твердым веществом при разных температурах дают кривую возгонки (сублимации).
Верхняя точка кривой испарения - критическая точка.
Верхняя граница кривой возгонки - точка плавления.
Направление кривых испарения и возгонки определяется уравнением Клаузиуса - Клапейрона.
Получим его.
Когда две фазы чистого вещества находятся в равновесии, их изобарные потенциалы
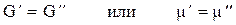 ,
,
т. к. химический потенциал - это изобарный потенциал 1 моль вещества
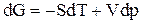 , то можно записать
, то можно записать
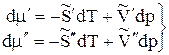 (12)
(12)
величины 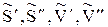 - также относятся к одному моль, т. е. это молярные энтропии и мольные объемы.
- также относятся к одному моль, т. е. это молярные энтропии и мольные объемы.
При равновесии 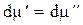 , тогда
, тогда
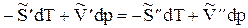 или
или 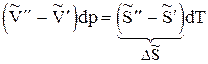
Отсюда 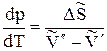 , (13)
, (13)
где DS - изменение энтропии при переходе 1 моль вещества из фазы 1 в фазу 2.
Из второго закона термодинамики известно, что для обратимых изотермических процессов 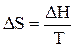 (14)
(14)
Подставим 14 в 13 и получим уравнение Клапейрона - Клаузиуса (1850 г. )
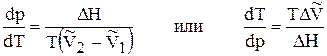 , (15)
, (15)
которое характеризует зависимость температуры фазового перехода от внешнего давления.
Уравнение Клапейрона - Клаузиуса описывает фазовые переходы I рода, к которым относятся переходы вещества из одного агрегатного состояния в другое, переходы из одной кристаллической модификации в другую. Среди них плавление, испарение, конденсация, возгонка,
S(ромб) Û S(монокл) Sn(сер) Û Sn(бел) С(гр) Û С(алм)
DH - теплота фазового перехода 1 моль вещества.
При фазовых переходах скачком изменяются молярная энтропия 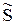 и молярный объем
и молярный объем 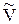 .
.
Рассмотрим некоторые конкретные случаи применения уравнения Клапейрона - Клаузиуса:
а) Равновесие жидкость Û пар, тогда 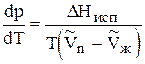 ,
,
DH > 0, т. к. рассматривается переход жидкости в пар, энергия поглощается
T > 0 и 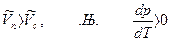 .
.
Это значит, что давление насыщенного пара растет с увеличением температуры.
Предположим, что пар подчиняется уравнению состояния идеального газа, т. е. 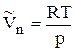 .
.
И если система далека от критической температуры, то 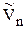 > >
> > 
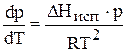 (16)
(16)
Делим переменные и интегрируем, предполагая, что DHисп не зависит от Т.
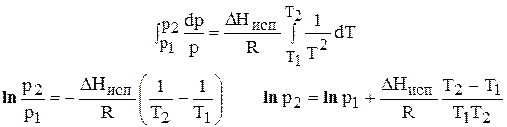
или 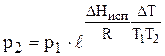 (17)
(17)
По этому уравнению можно рассчитать давление насыщенного пара р2 зная р1 и DHисп.
Можно также рассчитать DHисп.
а) Равновесие жидкость Û твердое тело
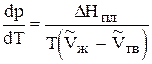 (18)
(18)
Разность DV мала, поэтому кривая плавления идет круто вверх.
Когда плотность твердого вещества больше плотности жидкого DV > 0 и 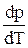 > 0, кривая наклонена вправо.
> 0, кривая наклонена вправо.
Когда плотность твердого вещества меньше плотности жидкого DV < 0, то 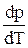 < 0 и кривая наклонена влево.
< 0 и кривая наклонена влево.
Вода, висмут, галлий, чугун имеют кривую, наклоненную влево.
У льда с повышением давления Тплав понижается, что объясняет скользкость льда (под давлением конька образуется вода, играющая роль смазки).
. К = 1 S = 1 - ф + 2 ® S = 3 - ф
При равновесии в системе не может быть больше трех фаз, иначе число степеней свободы будет отрицательным числом, что не имеет физического смысла.
Т. е. в однокомпонентной системе одновременно могут существовать максимально три фазы: например, паровая, жидкая, твердая.
Диаграмму однокомпонентной системы, например H2O, можно изобразить следующим образом.
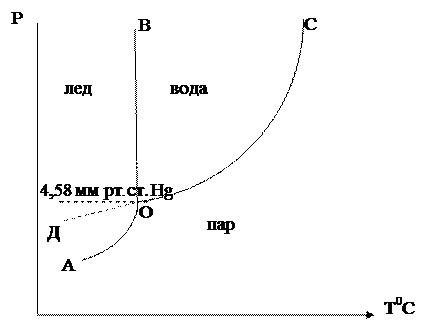 |
Рис. 2. Диаграмма состояния воды
В большинстве случаев за независимые переменные выбирают р и Т.
Фазовой точкой называется точка на диаграмме, изображающая состояние одной фазы.
Совокупность фазовых точек, изображающих состояние одной фазы называется фазовым полем
I - фазовое поле пара, II – фазовое поле жидкости, III - твердая фаза.
Фазовые поля разделены фазовыми линиями:
ОС - соответствует равновесию двух фаз пар - жидкость, ОА - пар - твердая фаза, ОВ - жидкость - твердая фаза.
В точке О в равновесии находятся все три фазы.
Число степеней свободы:
на фаз. поле S = 3 - 1 = 2 (два параметра можем менять),
на фаз. линии S = 3 - 2 = 1 ( один параметр можем менять),
в т. О S = 3 - 3 = 0 (параметры менять нельзя).
Если продлить ОС до Д, то ОД соответствует равновесию пар - переохлажденная жидкость.
Давление насыщенного пара над переохлажденной жидкостью больше, чем надо льдом, т. е. переохлажденная жидкость является неустойчивой (метастабильной) фазой относительно льда.
Диаграмма состояния с несколькими твердыми фазами.
В однокомпонентной системе может быть только 1 паровая и 1 жидкая фаза, а твердых фаз может быть несколько. Например, сера в твердом состоянии существует в двух модификациях S(ромб) и S(монокл) с различной кристаллической решеткой, для Fe известны 4 модификации a -, b -, g - и d -, для воды известны 5 твердых форм и т. д.
Каждая из этих модификаций выступает как отдельная самостоятельная фаза и на диаграмме ей соответствует отдельное фазовое поле.
 Рассмотрим диаграмму состояния серы.
Рассмотрим диаграмму состояния серы.
Рис. 3. Диаграмма состояния серы
В данном случае 4 фазовых поля, 6 фазовых линий и три тройных точки А, В и С.
А - Sромб Û Sмонокл Û Sпар
В - Sромб Û Sмонокл Û Sжид
С - Sмонокл Û Sжид Û Sпар
Равновесие всех четырех фаз не может быть осуществлено, т. к. число степеней свободы в этом случае S = 1 - 4 + 2 = -1, что противоречит действительности.
Энантиотропные и монотропные превращения
Многие вещества способны существовать в различных кристаллических модификациях, каждая из которых обладает определенными границами устойчивости. При этом существует некоторая температура перехода, выше которой устойчивой является одна из модификаций, а ниже – вторая.
Если превращение в точке перехода может самопроизвольно протекать как в прямом, так и в обратном направлениях, то такой переход называется энантиотропным (рис. 3). В этом случае между модификациями существует равновесие
М1 Û М2 Û Ж
Примером энантиотропного фазового перехода может служить процесс взаимного перехода серы ромбической и серы моноклинической. Энантиотропные превращения наблюдаются только в таких системах, в которых температура взаимного перехода модификации ниже температуры плавления таких модификаций.
 |
Рис. 4. Диаграмма состояния однокомпонентной системы с
энантиотропными фазовыми превращениями
Если при любых условиях одна из модификаций более устойчива, чем вторая, то возможен переход только второй модификации в первую, но не обратно.
Ж Û М2 ® М1,
неуст.
т. е. вторая модификация образуется из жидкости, но не из первой модификации.
Превращение модификаций, которые могут протекать только в одном направлении называются, монотропными.
В таких системах переход от модификации, устойчивой при более высоких температурах, к модификации, устойчивой при более низких температурах, невозможен. Обратный переход осуществляется и протекает тем быстрее, чем выше температура. Примерами монотропных фазовых переходов являются превращения a - бензофенона в b - бензофенон, белого фосфора в красный и др.
Рассмотрим диаграмму состояния бензофенона (рис. 5).
 |
Рис. 5. Диаграмма состояния бензофенона
На этой диаграмме кривые аО, вО и КО изображают устойчивые двухфазные равновесия b - бензофенона. a - бензофенон является неустойчивой модификацией и может самопроизвольно превращаться в b-(C6Н5)2CО, тогда как обратный переход невозможен.
Линии аО и а¢ О¢ отображают равновесия кристаллических b- и a-C6Н5)2CО с паром, они должны пересечься в точке с (точки О и О¢ ). Так как перегреть кристаллическое вещество выше его температуры плавления невозможно, то линии аО и аО¢ отражают физически нереальные состояния.
ЗАКЛЮЧЕНИЕ
Рассмотренные закономерности фазовых равновесий и фазовых переходов имеют большое значение для химиков-технологов, т. к. позволяют установить оптимальный режим протекания химических и физико-химических процессов.
.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|