
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ФАРМАТАН кормовая добавка Приложение 34
ФАРМАТАН кормовая добавка Приложение 34
Экспертный отчет о влиянии Фарматана на Clostridium perfringens,
E. Coli и Salmonella
Люблянский университет
Ветеринарный факультет
Кафедра микробиологии и паразитологии
1115 Любяна, 3425
Гербичева 60
Тел.: (061) 1779-100
Факс: (061) 332-243
30 ноября 2000
Танин Севница д. д.
Херманова 1
8290 СЕВНИЦА
Ответ: Экспертный отчет о влиянии Фарматана на Clostridium perfringens, E. coli и Salmonella
Введение
В соответствии с планом разработки по изучению действия Фарматана на различные бактерии, была исследована его активность на нескольких различных штаммах Clostridium perfringens, кишечной палочки и сальмонеллы. Действие Фарматана на кокцидии не изучалось, поскольку доступные лабораторные методы были неадекватными.
Методы
В данном исследовании использовались следующие штаммы: эталонный патогенный штамм Clostridium perfringens типа C (ATCC 51880), вызывающий некротический энтерит у сосущих поросят, патогенный штамм Escherichia coli G491 (= 138: K81, 88a), вызывающий диарею у поросят-отъмышей и у поросят-сосунков и наши собственные изоляты сальмонеллы серотипов S. typhimurium, S. enteritidis, S. senftenberg и S. livingstone.
Фарматан:
Концентрации танина: 0. 0015625% до 0. 5% были использованы для C. perfringens.
Концентрации танина: 0. 05%, 0. 5% и 2. 5% были использованы для E. coli.
Концентрации танина: 0. 5% были использованы для сальмонеллы.
Концентрации относятся к активному веществу.
Условия испытаний
Влияние на рост исследовали путем суспендирования бактерий в жидкой культуральной среде. 0, 5 мл Фарматана в необходимом разведении и 0, 05 мл бактериальной суспензии добавляли к 2 мл культуральной среды (BHI для C. perfringens и Salmonellen, BHI, PV и TSB для E. coli).
Одновременно из бактериальной суспензии готовили 10-кратный раствор, 0, 01 мл которого вносили на твердую культуральную среду. После 20-24 часов инкубации подсчитывали количество выросших колоний, рассчитывали плотность бактерий в суспензии и рассчитывали количество в инокулуме. Тестовые культуральные среды с Фарматаном и контроли без Фарматана инкубировали в течение 12 часов с C. perfringens, в течение 8 часов с E. coli и в течение 24 часов с Salmonella. После окончания инкубации 0, 01 мл культур C. perfringens или Salmonella инокулировали на твердую культуральную среду для подсчета бактерий в отдельных разведениях. Для E. coli было выполнено 2-кратное разведение тестовой среды и 0, 01 мл этого инокулировали на твердую культуральную среду. Сравнение КОЕ (колониеобразующих единиц) с Фарматаном и без него показало, что разные концентрации Фарматана обладают ингибирующей активностью. Измеряли pH культуральной среды BHI, TSB и PV с 0, 05%, 0, 5% и 2, 5% таннина.
Результаты:
Clostridium perfringens Тип C: в предварительном испытании 0, 05% таннина в BHI снижали инокулят 4, 4 × 104 КОЕ / мл в 44 раза в течение 12 часов (ниже предела обнаружения). Контрольный инокулум без танина за тот же период увеличился в 382 раза. Тест с инокулумом 5, 4 × 104 КОЕ / мл дал 9, 36 × 107 КОЕ / мл в контроле без танина. Концентрации танинов 0, 05%, 0, 025% и 0, 0125% снижали количество КОЕ в инокулуме более чем в 54 раза (ниже предела обнаружения). Концентрация 0, 006225% позволила минимальное увеличение до 7, 3х104. Концентрация 0, 003125% снизила рост в 2, 7 раза. Концентрация 0, 0015625% снизила рост в 1, 7 раза.
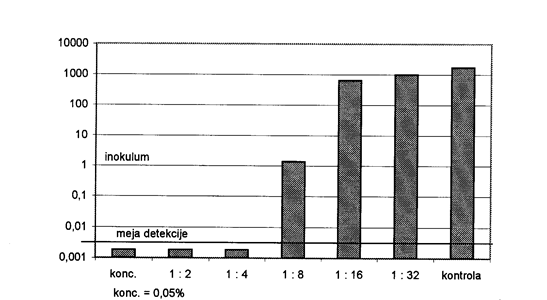
Диаграмма 1: Влияние танина на инокулят штамма типа C - C. perfringens.
konc. = конц. kontrola = контроль, meja detekcije = предел обнаружения; Inokulum = инокулум
Escherichia coli (кишечная палочка): Инокулум составлял 2, 2 × 1106 КОЕ / мл. КОЕ увеличилось в 488 раз за 8 часов в контрольной среде без танина. Соответствующее увеличение BHI и PV составило 376 и 197 раз соответственно. Концентрация танина 0, 05% практически не влияла на КОЕ / мл. При концентрации танина 0, 5% инокулум в TBS увеличивался в 91 раз, в BHI в 10 раз и в PV в 4 раза. При концентрации танина 2, 5% количество инокулума в PV снижалось более чем в 1090 раз (ниже предела обнаружения), в BHI в 436 раз и в TBS в 218 раз. Влияние концентрации танина показано на графике 2. Значения pH приведены в таблице 1.
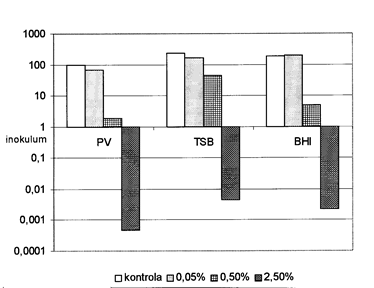 |
Диаграмма 2: Влияние концентрации танина на рост E. coli в различных культуральных средах.
Kontrola= контроль; inokulum=инокулум; 0, 01=0. 01 и т. д.
Таблица 1: Влияние концентрации танина на pH культуральных сред TBS, BHI и PV
| Концантрация танина | Культуральная среда | ||
| TSB | BHI | PV | |
| 0. 05% | 7. 28 | 7. 02 | 6. 95 |
| 0. 5% | 6. 78 | 6. 85 | 5. 89 |
| 2. 5% | 5. 77 | 5. 09 | 4. 43 |
Salmonellae: Концентрация танина 0, 5% в культуральной среде BHI немного подавляла рост сальмонелл. Эффект зависел от серотипа. Рост штамма S. typhimurium был наиболее сильно подавлен; Было зарегистрировано 36% контрольных бактерий. Для S. livingstone рост составил 53% от контроля, для S. Senftenberg - 61% от контроля, а для S. enteritidis - 64% от контроля (см. График 3).
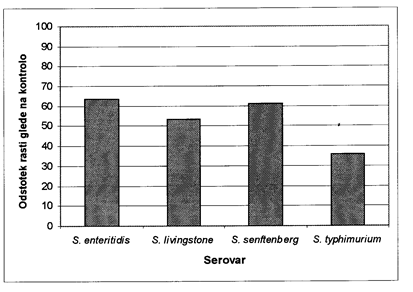
serovar= серологический тип; Odstotek rasti glede na kontrolo= количество бактерий относительно контроля
Диаграмма 3: Влияние танина на рост сальмонелл по сравнению с контролем (%)
Дискуссия:
Было обнаружено, что C. perfringens чувствителен к танину. Бактерицидная активность обнаружена при концентрации 0, 0125% (уменьшение количества клеток в инокулуме). Концентрация 0, 006225% позволила лишь незначительный рост. Эффект был намного меньше при более низких концентрациях танина.
Эффект у E. coli сильно зависел от используемой культуральной среды. E. coli реплицируется в 2, 5 раза больше в TBS, чем в PV (более бедная питательная среда). Влияние танина на pH питательной среды зависит от буферных свойств питательной среды. Буферная среда лучше всего нейтрализует действие танина. Концентрация 0, 05% мало влияла на рост кишечной палочки. Концентрация 0, 5% была ингибирующей, хотя она сильно зависела от культуральной среды. Концентрация 2, 5% была бактерицидной, поскольку количество бактерий в инокулуме снизилось от 218 до 1090 раз (ниже предела обнаружения).
Концентрация 0, 5% таннина в культуральной среде BHI снижает рост Salmonellae на одну-две трети по сравнению с контролем, в зависимости от серотипа.
Подписи:
Отчет:
Доктор Войка Боле-Хрибовшек
Профессор Маринка Дробнич-Кошорек
Руководитель института
Профессор Янез Мехле
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|