
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Практична робота № 4. Тема: Перевірка законів ідеального газу. Ізопроцеси.. Теоретичні відомості
Практична робота № 4
Тема: Перевірка законів ідеального газу. Ізопроцеси.
Мета: Перевірка газових законів. Навчитися будувати графіки ізопроцесів.
Обладнання: Скляна пробірка, лінійка, ємності з холодною та гарячою водою, барометр, шприц, калориметр.
Питання до захисту практичної роботи:
а) Дати визначення ізобаричному, ізохоричному та ізотермічному процесам.
б) Що являють собою графіки ізобари, ізохори, ізотерми?
в) Співвідношення температур за Кельвіном та Цельсієм.
г) Зв'язок кінетичної енергії молекул і температури.
Теоретичні відомості
Ідеальний газ – це газ, в якому силами взаємодії між молекулами можна знехтувати.
Співвідношення для фіксованої маси ідеального газу 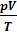 завжди залишається сталим.
завжди залишається сталим.
1. Тиск 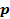 – це сила, що діє на одиницю площі.
– це сила, що діє на одиницю площі. 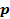 = F/S. Одиниця вимірювання тиску – Паскаль.
= F/S. Одиниця вимірювання тиску – Паскаль. 
Таблиця несистемних одиниць вимірювання тиску.
| Бар | Технічна атмосфера | Фізична атмосфера | Міліметр ртутного стовпа |
| 1 Па= 10− 5[бар] | 1 Па= 10, 197·10− 6[ат] | 1 Па= 9, 8692·10− 6[атм] | 1 Па= 7, 5006·10− 3[мм рт. cт. ] |
| 1 бар=10− 5 [Па] | 1 ат= 98066, 5 [Па] | 1 атм=101325 [Па] | 1мм. рт. ст. =133, 3 [Па] |
На 1 см² земної поверхні повітря чинить тиск 1, 033 кг. Якщо прийняти площу поверхні тіла людини близько 15000 см², то, очевидно, що вона знаходиться під тиском порядку 15500 кг.
2. Температура Т – це міра кінетичної енергії молекул. 
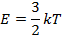
Кінетична енергія 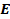 і температура пов’язані сталою Больцмана
і температура пов’язані сталою Больцмана 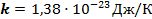 ·
·
Для газових законів температуру необхідно виражати у Кельвінах, а не в Цельсіях.
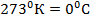
Нуль градусів по Кельвіну ( - 273°С) – це температура абсолютного нуля, тобто, температура, при якій молекули речовини мають найменш можливу кінетичну енергію.
3. Об’єм 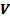 - число кубічних одиниць.
- число кубічних одиниць.
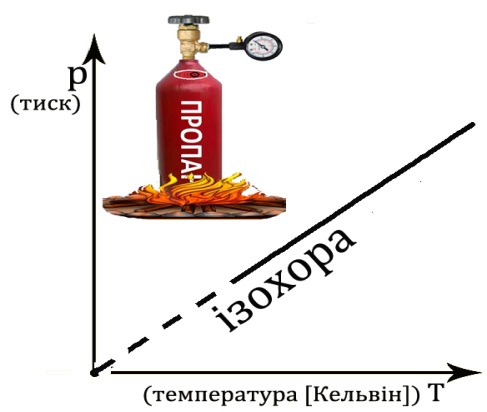
4. Ізопроцеси:
Ізотермічний
(закон Бойля — Маріотта)

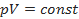
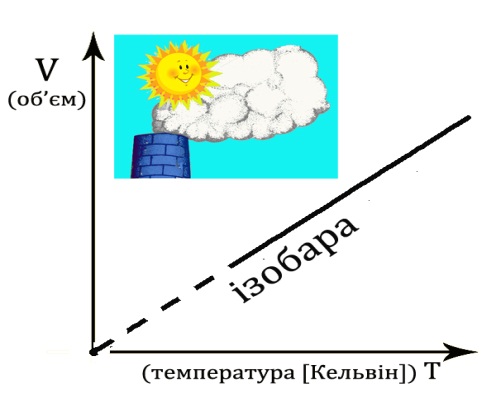
| Ізохорний(закон Шарля)

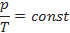
| Ізобарний(закон Гей-Люссака)

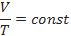
|

| 
| 
|
 Хід роботи:
Хід роботи:
1. Перевірка з. Гей-Люссака ( ізобаричний процес ).
а)Наповнити пробірку водою до країв. Перелити воду у мірну посудину та визначити об’єм води  . Ці дані використовувати як об’єм повітря у пробірці.
. Ці дані використовувати як об’єм повітря у пробірці.
Для контролю даних вимірювання об’єму пробірки зважити перелиту воду у мірній посудині на вагах. Віднявши масу пустої мірної посудини, отримаємо масу води у пробірці 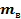 . Згідно формули
. Згідно формули 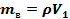 , знаючи густину води
, знаючи густину води 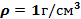 , обчислити об’єм
, обчислити об’єм 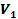 . Порівняти дані, або взяти середнє між ними, якщо вони різняться.
. Порівняти дані, або взяти середнє між ними, якщо вони різняться.
б) Виміряти температуру у аудиторії 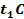 , перевірити температуру холодної води (вона повинна дорівнювати кімнатній), температуру гарячої води
, перевірити температуру холодної води (вона повинна дорівнювати кімнатній), температуру гарячої води  . Перевести дані у Кельвіни.
. Перевести дані у Кельвіни. 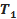 - температура нагрітого повітря.
- температура нагрітого повітря. 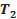 – кімнатна температура повітря.
– кімнатна температура повітря.
в) Опустити порожню пробірку у гарячу воду та зачекати, поки вона прогріється. Повітря в середині пробірки розшириться і частина його вийде, тиск залишиться атмосферним. Вважаємо, що повітря в середині пробірки прогрівається до температури гарячої води.
г) Закривши отвір пробірки пальцем (або пластиліном), обережно витягнути пробірку з гарячої води, перевернути отвором вниз та опустити у холодну воду (температура якої дорівнює кімнатній) вертикально. Відкрити отвір пробірки під водою. Закріпити пробірку на штативі, щоб тепло руки не передавалося до пробірки. Зачекати, поки система прийде у стан теплової рівноваги (поки пробірка охолоне до в кімнатної температури). Об’єм повітря у пробірці зменшиться згідно закону Гей-Люссака:
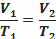
Тиск  - залишиться атмосферним.
- залишиться атмосферним.
д) Щоб перевірити справедливість цього закону необхідно визначити 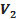 - об’єм, який займає повітря в середині пробірки після охолодження до кімнатної температури
- об’єм, який займає повітря в середині пробірки після охолодження до кімнатної температури 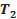 . Для цього необхідно від об’єму пробірки
. Для цього необхідно від об’єму пробірки 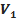 відняти об’єм водяного стовпчика
відняти об’єм водяного стовпчика 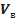 ., що зайшов у пробірку. Не виймаючи пробірку з води – виміряти висоту водяного стовпчика
., що зайшов у пробірку. Не виймаючи пробірку з води – виміряти висоту водяного стовпчика 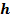 , потім виміряти внутрішній діаметр пробірки d, обчислити площу поперечного перерізу пробірки
, потім виміряти внутрішній діаметр пробірки d, обчислити площу поперечного перерізу пробірки

 - формула для об’єму циліндра. Отже:
- формула для об’єму циліндра. Отже:

| Температура теплої води | Температура кімнатна | Об’єм пробірки | Висота вод. стовпчика | Діаметр пробірки | Площа отвору | Об’єм вод. стовпчика | Об’єм охол. повітря |

| 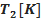
| 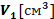
| 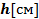
| d[см] | 
| 
| 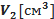
|
2. Побудова графіку ізотермічного процесу (Закон Бойля-Маріотто).
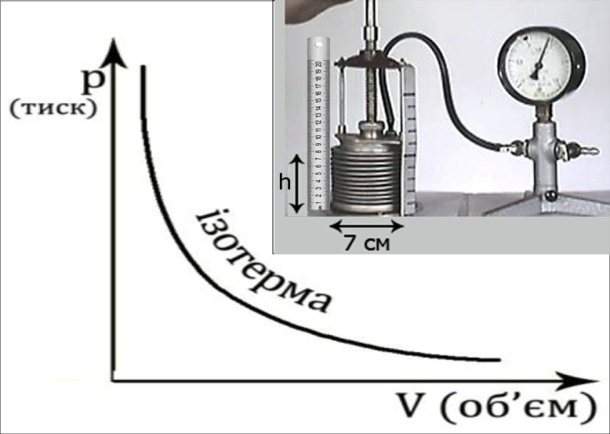 За допомогою демонстраційного приладу для вивчення газових законів зняти показники тиску p, змінюючи об’єм циліндру
За допомогою демонстраційного приладу для вивчення газових законів зняти показники тиску p, змінюючи об’єм циліндру 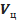 . Застарілу одиницю вимірювання тиску «технічна атмосфера» - переводити у Паскалі (табл. – дивись вище).
. Застарілу одиницю вимірювання тиску «технічна атмосфера» - переводити у Паскалі (табл. – дивись вище).
Об’єм циліндру: 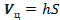 , де
, де
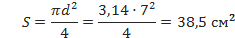

| |||||||
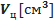
| |||||||
p 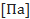
|
3. Записати висновки.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|