
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Энтропия.
Энтропия – величина, которая показывает число способов расположения частиц в пространстве и распределения их по энергиям.
Мысленный эксперимент. Пролили бензин в дальнем углу гаража. Что произойдет и почувствуем ли мы запах бензина при открывании дверей? Имеет ли место диффузия? Возможна диффузия при отсутствии воздуха?
Возьмем две емкости объединенные перегородкой. Поместим в одну из них несколько молекул бензина( пусть 5).
Емкость1 Емкость2
Емкости без воздуха. Откроем перегородку. Что произойдет? Имеет ли место хаотичность движения?
Вероятность молекуле бензина остаться в емкости 1: 1 / 25 = 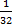
Вывод: молекулы диффундируют вследствие того, что способов расположения во всем объеме больше, чем когда они находятся все только в одном месте.
Понятие « число возможных вариантов или способов» важно: оно определяет, насколько вероятны изменения в системе.
Идея такова: события, которые происходят, имеют наибольшую вероятность произойти. Чем больше возможных вариантов дл того, чтобы события могли произойти, тем, больше вероятность того, что оно произойдет.
Почему смешиваются жидкости?
Опыт: в стакан положите слой арахиса и слой кешью (месяцеобразный). Встряхните. Что произойдет? Можно ли вернуть в первоначальное состояние? Только теоретически.
Вывод: жидкости смешиваются потому, что число возможных способов их смешивания больше, чем способов разделения.
Но так происходит не всегда. Пример: вода + бензин. Почему? Сила взаимодействия между молекулами каждой из жидкостей больше сил взаимодействия воды и бензина. Поэтому расслаиваются. Сравните эмульсию воды в нефти при стабилизаторах – смолы + асфальтены (битум + минеральные вещества). Её даже разрушают центрифугированием, повышением температуры и направленным действием электрического поля.
Общее правило смешивания: вещества стремятся перемешаться, если не существует сил противодействия.
Таким образом, число способов очень важно для определения того, как происходит изменение в системе.
Для химической системы (реагент – продукт) изменения в системе характеризуются энтропией.
Используется для оценки химических процессов изменение энтропии, а не абсолютное ее значение. Обозначается Δ S. При Δ S> 0 процесс протекает, а при Δ S< процесс по энтропии не разрешен. [S]=Дж/ моль·К.
Сравним стандартную молярную энтропию S0 для некоторых веществ:
| Вещество | S0 Дж/ моль·К. | Вещество | S0 Дж/ моль·К. |
| Н2Олед | алмаз | 2. 4 | |
| Н2Ожидкость | СН4 | 186. 2 | |
| Н2Огаз | 188. 7 | С3Н6 | 229. 9 |
Закономерность изменения энтропии:
1. у газов энтропия > чем у жидкости > чем у твердых веществ.
2. вещества со сложной структурой имеют энтропию > чем простые вещества.
3. алмаз – одна из самых правильных и совершенных структур природы. Энтропия минимальная.
Тренировочные упражнения:
1. Для каких процессов энтропия уменьшается, увеличивается, остается постоянной?
| Процесс | S0 Дж/ моль·К.: ↑, ↓, const |
| Испарение бензина | ↑ |
| Конденсация паров бензина | ↓ |
| Растворение сахара в воде | ↑ |
| Смешивание масла с бензином | ↑ |
| Разделение суспензии масла в воде на два слоя | const |
| Эмульсия природной нефти с водой | const |
2. Какие вещества обладают большей энтропией и почему?
-твердый воск или расплавленный воск.
-бром жидкий или бром газообразный
-отдельные образцы меди и цинка или латунь (их сплав)
-пентан С5Н12 или октан С 8Н18?
Первый закон термодинамики позволяет предсказать изменения в системе и окружающей среде при отсутствии на самом деле самих процессов.
Второй закон термодинамики дает ответы на такие вопросы, как: какими законами определяются самопроизвольность течения термодинамических процессов? Можно ли предсказать направления самопроизвольных процессов? При каких условиях процессы протекают полнее? Какая работа будет получена при этом? и т. д.
Второй закон термодинамики имеет несколько формулировок:
1. Невозможен процесс, единственным результатом которого было бы превращение теплоты в работу (постулат Томсона).
2. Невозможен самопроизвольный переход теплоты от холодного тела к горячему (постулат Клаузиуса).
3. Невозможно построить такую машину (вечный двигатель второго рода), все действия которой сводились бы к производству работы и соответствующему охлаждению теплового источника. Всякая машина производит работу только при наличии разности температур между теплоотдатчиком (Т1) и теплоприемником (Т2). (первый постулат Планка).
4. Любая форма энергии может полностью преобразовываться в теплоту, но теплота преобразуется в другие виды энергии лишь частично (второй постулат Планка).
Самая ранняя формулировка второго закона термодинамики, появилась раньше первого начала, связана с работами С. Карно.
КПД машины = (Т1 –Т2)/Т1
В основном реакции протекают, если Δ Н< 0. Но известно, что самопроизвольно идут реакции, сопровождающиеся увеличением энтальпии и охлаждением реактора (эндотермические). Для характеристики таких реакций введена новая функция – энтропия. Обозначается S. Измеряется ее изменение Δ S. [S]=Дж/моль·К.
Изменение энтропии равно минимальной теплоте, подводимой к системе в обратном изотермическом процессе, деленной на абсолютную температуру процесса: Δ S=Qмин / T.
| Открытая система | Изолированная система dQ=0 |
| Самопроизвольный процесс Δ S> Qмин / T. Равновесный процесс Δ S=Qмин / T. Несамопроизвольный процесс Δ S< Qмин / T. | Самопроизвольный процесс Δ S> 0. Равновесный процесс Δ S= 0. Несамопроизвольный процесс Δ S< 0. |
В общем случае Δ S ≥ 0 (процесс протекает или находится в состоянии равновесия). Δ S ≥ Qмин / T. Это неравенство Клаузиуса. Аналитическое выражение второго закона термодинамики.
Существуют две точки зрения на применимость второго закона термодинамики.
Не применим к системам с небольшим числом частиц, космическим системам, живым объектам как открытым системам. Почему? Теряется смысл для систем с малым числом частиц. Вселенная неравновесная и стремится к однородному изотермическому состоянию (энтропия стремится к максимуму, тепловая смерть Вселенной). Живые системы способны к самосозиданию (автопоэз). Сами удаляются от классического динамического равновесия и делают еще неравновесной окружающую среду.
На этом подходе американец Джеймс Лавлок в 1965г. предложил в качестве критерия наличия жизни на Марсе оценивать равновесность состава атмосферы.
| Земля, температура +40-(-50) º С | Марс, температура +20 – (-125) º С, среднесуточная -60 º С. |
| Кислород 21% Азот 78% Метан 0. 00018% Водород 0. 00005% Монооксид углерода СО 0. 00001% Углекислый газ СО2 0. 035% | Углекислый газ СО2 95% Кислород 1% Метан (восстановитель) не обнаружен. |
| Смесь газов неравновесна. Земная атмосфера – открытая система, в формировании которой постоянно участвуют живые организмы. Т. е. жизнь присутствует. | Атмосфера Марса равновесна, все реакции между газами уже осуществились. В настоящее время жизни на Марсе нет. |
Согласно другой точки зрения: Вселенная постоянно расширяется (вещества в ней рассредотачиваются), а также под действием сил тяготения происходит скопление веществ: звезд, планет, галактик и т. д. Все эти процессы идут в строгой согласованности с законами термодинамики.
Тоже и для живых объектов. Открытые живые системы на определенных временах можно рассматривать как квазизакрытые ( без постороннего вмешательства) по отношению к процессам, для которых устанавливаются локальные равновесия. Каждую неравновесную систему можно разбить на бесконечно малые объемы, что их неоднородностью можно пренебречь. Каждый малый объем неравновесной системы в любой момент времени находится в состоянии равновесия.
Игнорировать второй закон термодинамики равносильно тому, чтобы не прочесть ни строчки Шекспира.
«Энтропия – стрела времени». Эддисон.
«Выигрыш в информации – это проигрыш в энтропии». Льюис.
«Выигрыш в энтропии – выигрыш в идиотизме».
Второй закон термодинамики предсказывает вероятность события и причину его свершения.
- Нельзя дважды войти в одну и ту же воду.
-Нельзя ничего вернуть в первоначальное состояние.
Задача 1. Возможно ли образование сероводорода H2S из простых веществ при стандартных условиях по энтропии?
Химическая реакция: Н2 (Г) + S(к) → H2S(г) Справочник: cтандартные абсолютные энтропии
Н2 (Г) =+130. 5Дж/ К·моль S(к)=+31. 9 Дж/ К·моль
H2S(г) = + 205, 7 Дж/ К·моль
Решение: Δ S0 реакции = 205. 7 – (130. 5 +31. 9) = 205. 7 – 162. 4 =43. 3( Дж/ К·моль) > 0 Процесс возможен.
Задача 2. С точки зрения изменения энтропии оцените возможность протекания процесса:
1вариант 2 вариант
Н2О (ж) → Н2О (п) Сграфит → Салмаз
Справочник: Н2О (ж) =70. 1 Дж/ К·моль Н2О (п)=188. 7 Дж/ К·моль Сграфит=5. 7 Дж/ К·моль Салмаз =2. 3 Дж/ К·моль
Решение: (записать самостоятельно! ).
Ответ: 118. 6 Дж/ К·моль, возможен; -3. 4 Дж/ К·моль, невозможен.
Задача 3. Оценить возможность самопроизвольного процесса Н2О (ж) → Н2О (тв) при t=-10º C и t=+10º C.
Справочные данные:
| Вещество | Δ Н0, кДж/моль | Δ S0, Дж/ К·моль |
| Н2О (ж) Н2О (тв) | -285. 84 -291. 85 |
Δ Н0х. р. = -291. 85 – (-285. 84) = -6. 01( кДж/моль) < 0, процесс возможен.
Δ S0х. р. = 48-70 = -22(Дж/ К·моль) < 0, процесс невозможен.
Δ Sокр. среды = - Δ Н / T и Δ Sобщ. = Δ S0х. р. + Δ Sокр. среды
При температуре +10 º C: Δ Sокр. среды = - (6010Дж/моль): (273+10) = -21. 2 Дж/ К·моль
Δ Sобщ. = 22 +(-21. 2) =+0. 8 Дж/ К·моль > 0 Процесс возможен. Самопроизвольный.
При температуре -10 º C: Δ Sокр. среды = - (-6010Дж/моль): (273-10) = +22. 9 Дж/ К·моль
Δ Sобщ. =- 22 +22. 9) =+0. 9 Дж/ К·моль > 0 Процесс возможен. Самопроизвольный.
Задание:
Вычислить значение энтропии при стандартных условиях для той реакции, для которой вы рассчитывали энтальпию в предыдущем задании. Предоставить расчет к 16 декабря.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|