
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Присоединение
АЛКЕНЫ (ОЛЕФИНЫ) - (от лат. oleum-масло) (этиленовые углеводороды), ненасыщенные углеводороды, содержащие одну двойную связь С=С. Алкены содержат в своей молекуле меньшее число водородных атомов, чем соответствующие им алканы (с тем же числом углеродных атомов), поэтому такие углеводороды называют непредельными или ненасыщенными. Общая формула СnН2n. Атомы углерода при двойной связи имеют sp2-гибридизацию и образуют s- и p-связи. Энергия связи ~615 кДж/моль. Простейший алкен - этилен, валентные углы которого практически равны 120°.
В природе алкены встречаются в значительно меньшей степени, чем предельные углеводороды, по-видимому, вследствие своей высокой реакционной способности. Поэтому их получают с использованием различных реакций.
I. Крекинг алкенов.
II. Отщепление (элиминирование) двух атомов или групп атомов от соседних
атомов углерода с образованием между ними p-связи:
1)Дегидрогалогенирование моногалогеналканов при действии спиртового раствора щелочи.
2) Дегидратация спиртов при температуре менее 150°C в присутствии водоотнимающих реагентов.
3) Дегалогенирование дигалогеналканов, имеющих атомы галогена у соседних атомов углерода, при действии активных металлов.
4) Дегидрирование алканов при 500°С.
Физические свойства
Физические свойства некоторых алкенов показаны в табл. 1. Первые три представителя гомологического ряда алкенов (этилен, пропилен и бутилен) — газы, начиная с C5H10(амилен, или пентен-1) — жидкости, а с С18Н36 — твердые вещества. С увеличением молекулярной массы повышаются температуры плавления и кипения. Алкены нормального строения кипят при более высокой температуре, чем их изомеры, имеющие изостроение. Температуры кипения цис-изомеров выше, чем трансизомеров, а температуры плавления — наоборот.
Алкены плохо растворимы в воде (однако лучше, чем соответствующие алканы), но хорошо — в органических растворителях. Этилен и пропилен горят коптящим пламенем.
1
| Физические свойства алкенов | |||||
| № | Название | Формула | Т плавления, °С | Т кипения, °С | Плотность, d4 |
| Этилен | С2H4 | − 169, 1 | − 103, 7 | 0, 5700* | |
| Пропилен | C3H6 | − 187, 6 | − 47, 7 | 0, 5193* | |
| Бутен-1 (бутилен) | C4H8 | − 185, 3 | − 6, 3 | 0, 5951* | |
| цис-Бутен-2 | CH3-CH=CH-CH3 | − 138, 9 | 3, 7 | 0, 6213 | |
| транс-Бутен-2 | CH3-CH=CH-CH3 | − 105, 5 | 0, 9 | 0, 6042 | |
| 2-Метилпропен-1 | CH3-C=CH2 | − 140, 4 | − 7, 0 | 0, 5942* | |
| Пентен-1 | С5H10 | − 165, 2 | 30, 1 | 0, 6405 | |
| Гексен-1 | С6H12 | − 139, 8 | 63, 5 | 0, 6730 | |
| Гептен-1 | С7H14 | − 119, 0 | 93, 6 | 0, 6970 | |
| Октен-1 | С8H16 | − 101, 7 | 121, 3 | 0, 7140 | |
(табл. 1) * Значения измерены при температуре кипения.
Химические свойства
Алкены химически активны. Их химические свойства во многом определяются наличием двойной связи. Для алкенов наиболее характерны реакции электрофильного присоединения и реакции радикального присоединения. Также алкены легко вступают в реакции окисления, гидрируются сильными восстановителями или водородом под действием катализаторов до алканов, а также способны к аллильному радикальному замещению.
Химические свойства алкенов Присоединение Окисление Полимеризация
1) водорода 1) полное окисление
(гидрирование) (горение)
2) галогена 2) неполное окисление
(галогенирование) а) в нейтральной среде
3) галогеноводорода б) в кислой среде
(гидрогалогенирование)
4) гидратация
2
Присоединение
1. Гидрирование алкенов. Алкены способны присоединять водород в присутствии катализаторов гидрирования — металлов — платины, палладия, никеля:
CH3—СН2—СН=СН2 + Н2 -> CH3—CH2—СН2—СН3.
Эта реакция протекает и при атмосферном и при повышенном давлении и не требует высокой температуры, так как является экзотермической. При повышении температуры на тех же катализаторах может пойти обратная реакция — дегидрирование.
2. Галогенирование (присоединение галогенов). Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе (ССl4) приводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образования дигалогеналканов.
3. Гидрогалогенирование (присоединение галогеноводорода).
Реакция присоединения галогеноводорода более подробно будет рассмотрена ниже. Эта реакция подчиняется правилу Марковникова:
При присоединении галогеноводорода к алкену водород присоединяется к более гидрированному атому углерода, т. е. атому, при котором находится больше атомов водорода, а галоген — к менее гидрированному.
4. Гидратация (присоединение воды). Гидратация алкенов приводит к образованию спиртов. Например, присоединение воды к этену лежит в основе одного из промышленных способов получения этилового спирта:
CH2=CH2 + H2O -> СН3—СН2ОН
этен этанол
Обратите внимание на то, что первичный спирт (с гидроксигруппой при первичном углероде) образуется только при гидратации этена. При гидратации пропена или других алкенов образуются вторичные спирты.
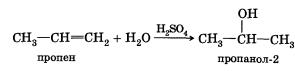
Эта реакция также протекает в соответствии с правилом Марковникова — катион водорода присоединяется к более гидрированному атому углерода, а гидроксигруппа — к менее гидрированному.
Окисление. Реакции окисления.
Как и любые органические соединения, алкены горят в кислороде с образованием С02 и Н20.
3
В отличие от алканов, которые устойчивы к окислению в растворах, алкены легко окисляются под действием водных растворов перманганата калия. В нейтральных или слабощелочных растворах происходит окисление алкенов до диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам, между которыми до окисления существовала двойная связь.
Как вы уже знаете, непредельные углеводороды — алкены способны вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|