
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Работа газа численно равна площади фигуры под графиком процесса в координатах (р,V).
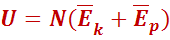 Внутренняя энергия тела - сумма кинетической и потенциальной энергии всех молекул тела.
Внутренняя энергия тела - сумма кинетической и потенциальной энергии всех молекул тела.
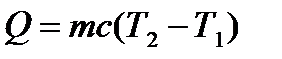 Способы изменения внутренней энергии: теплопередача и работа. Изменение внутренней энергии в термодинамических процессах при теплопередаче ∆ U=Q При нагревании, плавлении, парообразовании внутренняя энергия вещества увеличивается: Q> 0. При охлаждении, конденсации, кристаллизации, сгорании внутренняя энергия вещества уменьшается: Q< 0
Способы изменения внутренней энергии: теплопередача и работа. Изменение внутренней энергии в термодинамических процессах при теплопередаче ∆ U=Q При нагревании, плавлении, парообразовании внутренняя энергия вещества увеличивается: Q> 0. При охлаждении, конденсации, кристаллизации, сгорании внутренняя энергия вещества уменьшается: Q< 0
} Нагревание (охлаждение ): с – удельная тепоёмкость вещества - количество теплоты, необходимое для нагревания 1кг вещества на 10С.
} 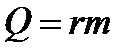 Парообразование при кипении: r- удельная теплота парообразования - количество теплоты, необходимое для превращения 1кг жидкости в пар при температуре кипения.
Парообразование при кипении: r- удельная теплота парообразования - количество теплоты, необходимое для превращения 1кг жидкости в пар при температуре кипения.
} 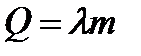
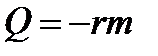 Конденсация при температуре кипения.
Конденсация при температуре кипения.
} Плавление. 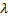 - удельная теплота плавления - количество теплоты, необходимое для расплава 1кг вещества при температуре плавления
- удельная теплота плавления - количество теплоты, необходимое для расплава 1кг вещества при температуре плавления
} 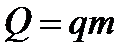
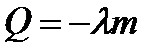 Кристаллизация при температуре плавления
Кристаллизация при температуре плавления
} Сгорание топлива q - удельная теплота сгорания - количество теплоты, выделяющееся при сгорании 1кг топлива.
Внутренняя энергия одноатомного идеального газа .
Т. к. потенциальная энергия молекулидеального газа равна нулю (молекулы не взаимодействуют), то 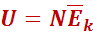
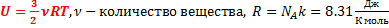 - универсальная газовая постоянная
- универсальная газовая постоянная 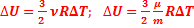 - изменение внутренней энергии одноатомного идеального газа
- изменение внутренней энергии одноатомного идеального газа 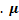 - молярная масса вещества – масса 1 моля. Способы изменения внутренней энергии
- молярная масса вещества – масса 1 моля. Способы изменения внутренней энергии
 Совершение работы ∆ U = -A: Газ сам совершает работу: UŒ, A > 0. Над газом совершают работу: U›, A < 0. Механический эквивалент теплоты, установленный Джоулем: 1калория =4, 19Дж. Первое начало термодинамики: всё подводимое системе тепло идёт частично на совершение газом работы A, а частично - на изменение его внутренней энергии ∆ U. Q =A + ∆ U Первое начало термодинамики для изопроцессов. Работа газа в изобарном процессе. A = ∆ Vp, Q = ∆ Vp + ∆ U
Совершение работы ∆ U = -A: Газ сам совершает работу: UŒ, A > 0. Над газом совершают работу: U›, A < 0. Механический эквивалент теплоты, установленный Джоулем: 1калория =4, 19Дж. Первое начало термодинамики: всё подводимое системе тепло идёт частично на совершение газом работы A, а частично - на изменение его внутренней энергии ∆ U. Q =A + ∆ U Первое начало термодинамики для изопроцессов. Работа газа в изобарном процессе. A = ∆ Vp, Q = ∆ Vp + ∆ U
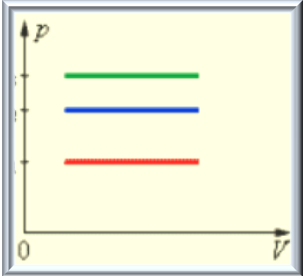
Работа газа численно равна площади фигуры под графиком процесса в координатах (р, V).
При изобарном расширении Q > 0 – тепло поглощается газом, и газ совершает положительную работу. При изобарном сжатии Q < 0 – тепло отдается внешним телам. В этом случае A < 0. Температура газа при изобарном сжатии уменьшается, T2 < T1; внутренняя энергия убывает, Δ U < 0.
 Работа в изотермическом процессе.
Работа в изотермическом процессе.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|